肝细胞线粒体NDUFA13 蛋白缺陷可诱导小鼠自发性慢性肝纤维化
徐小惠,曾 欣,李 锐,冯金梅,黄道超,黄 轶
重庆医科大学附属儿童医院儿科研究所//国家儿童健康与疾病临床医学研究中心//儿童发育疾病研究教育部重点实验室//儿童发育重大疾病国家国际科技合作基地//儿童感染免疫重庆市重点实验室,重庆400014
肝纤维化是肝脏应对损伤进行自我修复的病理生理过程。各种慢性肝脏疾病过程中,肝细胞损伤与持续炎症刺激可导致肝星状细胞(HSCs)激活和细胞外基质(ECM)过度沉积加速肝纤维化病理进程[1],从而促肝硬化甚至肝癌发生。近年来,肝纤维化发病率逐年上升,但仍然缺乏有效的防治手段[2]。因此,深入探讨肝纤维化的发病机制,寻找阻滞或逆转肝纤维化的有效靶点,对肝纤维化的早期防治具有重要意义。
NDUFA13是一种核基因编码的线粒体蛋白,主要定位在线粒体内膜,是组成NADH脱氢酶Ⅰ复合体的基本亚单位,对于线粒体呼吸链膜电位及氧化磷酸化功能维持至关重要[3]。大量研究发现NDUFA13作为一种抑癌基因,在多种恶性肿瘤组织中表达紊乱,参与多种信号通路而调控肿瘤细胞增殖、凋亡及细胞侵袭与转移等过程,且与疾病的预后密切相关[3-7]。课题组前期研究揭示了NDUFA13在胃癌癌前炎症恶性进展中渐进性下调的特点[6],我们进一步证实NDUFA13蛋白失活可诱导小鼠自发性肝炎病理表型[8]。然而,NDUFA13蛋白缺失是否能够诱导小鼠肝脏纤维化的发生,仍需进一步证实。
目前,有关肝纤维化的药物或机制研究大多基于胆汁淤积、毒物诱导等干预的小鼠肝纤维化模型[9],并不能很好地模拟人类肝脏慢性纤维化的疾病状态。因此,制备能模拟人类肝炎-肝纤维化病理进程的动物模型,是探索肝纤维化疾病发生机制与治疗手段的重要基础。本研究重点关注NDUFA13蛋白失活对肝纤维化形成的影响,以期为肝纤维化治疗提供新的靶点,同时提供一种自发性、慢性肝纤维化动物模型,为肝纤维化的发病机制研究及治疗药物筛选提供新思路。
1 材料和方法
1.1 材料与试剂
1.1.1 实验动物 NDUFA13fl/fl基因编辑小鼠、Alb-Cre转基因小鼠及肝脏特异性NDUFA13 杂合敲除小鼠(NDUFA13fl/-;Alb-Cre)参照前期实验方法获得[8]。C57BL/6小鼠购买于重庆医科大学实验动物中心。所有小鼠均饲养于重庆医科大学附属儿童医院实验动物中心,SPF环境下(12 h/12 h光照/黑暗),自由采食与饮水。分别在4周龄、2年龄时处死小鼠,获取肝组织样本用于检测。所有操作均遵照实验动物伦理学要求(GDY1801016)进行。
1.1.2 主要试剂 蛋白裂解液(碧云天),BCA蛋白浓度测定试剂盒(碧云天),NDUFA13小鼠抗人单克隆抗体(Santa cruz),小鼠抗β-actin 抗体(sigma),Western BrightTMECL显色试剂盒(Advansta),α-SMA小鼠抗人单克隆抗体(Bioss),Collagen-Ⅰ兔抗人多克隆抗体(Bioss),Collagen-Ⅲ兔抗人多克隆抗体(Bioss),MMP-9兔抗人多克隆抗体(Bioss),TIMP-1兔抗人多克隆抗体(Bioss),F4/80 大鼠抗小鼠单克隆抗体(Biolegend),TGF-β1兔抗小鼠多克隆抗体(Bioss),TNF-α小鼠抗人单克隆抗体(Bioss),IL-1β兔抗人多克隆抗体(Bioss),即用型免疫组化(兔)试剂盒(福建迈新),即用型免疫组化(小鼠)试剂盒(福建迈新),大鼠二步法试剂盒(中杉金桥),山羊抗兔Alexa-Fluor 555荧光二抗(Bioss),山羊抗小鼠Alexa-Fluor 647荧光二抗(Bioss)。
1.1.3 主要仪器 台式高速离心机(Thermo Fisher Scientific),凝胶电泳仪(Bio-Rad),ChemiDocTMTouch成像系统(Bio-Rad),病理切片仪(Leica),A1R激光共聚焦显微镜(Nikon)。
1.2 实验方法
1.2.1 HE与Masson染色 经4%PFA溶液固定的小鼠肝组织,进行脱水及石蜡包埋,制成4 μm石蜡切片,于60 ℃烤箱烘烤后行二甲苯、梯度酒精脱蜡水化程序。用于HE染色的切片,分别进行苏木素染细胞核、伊红染细胞浆,再经梯度乙醇及二甲苯脱水、透明,中性树胶封片后用于镜检。用于Masson染色的切片,根据Masson染色试剂盒操作步骤依次进行Weigert铁苏木素溶液、丽春红品红溶液以及苯胺蓝溶液染色,经过相应分化与洗涤,最后脱水、透明并封固后用于镜下观察,每组小鼠取10个高倍视野(×400),进行Ishak纤维化评分分析[10]。
1.2.2 Western blot检测 取2年龄小鼠肝组织,采用蛋白提取试剂盒提取各组小鼠肝组织全蛋白,通过BCA蛋白定量试剂盒测量蛋白浓度,然后加入5×SDS PAGE上样缓冲液混合,于100 ℃加热5 min。取30 μg总蛋白上样,经10%SDS PAGE电泳后,电转至PVDF膜,利用含5%脱脂奶粉的TBST溶液封闭1 h,加入相应的一抗(NDUFA13 1∶300,内参为小鼠抗β-actin 单克隆抗体1∶7000),4 ℃孵育过夜。TBST漂洗3次,加入相应二抗(辣根过氧化物酶标记的山羊抗小鼠IgG 1∶5000稀释),室温孵育1 h,TBST再次清洗3次后,滴加ECL显色剂,采用全自动化学发光成像分析系统进行检测、成像,并利用Image J软件对条带进行灰度值分析。
1.2.3 免疫荧光染色 取2年龄小鼠新鲜肝脏组织,经OCT快速冷冻包埋,在冰冻切片机中切成8 μm冰冻切片,切片迅速置于4%PFA溶液固定0.5 h。PBS洗涤3次,加山羊血清室温封闭1 h,甩干后滴加稀释好的一抗溶液(F4/80 1∶300,TGF-β1 1∶200,TNF-α 1∶300,IL-1β 1∶300),置于4 ℃冰箱孵育过夜。PBS洗涤后,滴加相应二抗溶液,室温孵育1 h,再次PBS洗涤,滴加DAPI溶液染细胞核,最后洗涤并采用抗荧光淬灭封片剂封片,用于激光共聚焦检测成像。每组小鼠选取10个高倍视野(×400),进行平均荧光强度分析[11-13]。
1.2.4 免疫组化染色 2年龄小鼠肝组织石蜡切片经脱蜡水化后,采用0.01 mol/L pH6.0枸橼酸钠缓冲液微波加热修复15 min,室温冷却后经PBS洗涤,滴加3%H2O2溶液避光孵育20 min,再次洗涤后,加5%BSA溶液室温封闭30 min。轻轻甩干,然后滴加稀释好的一抗溶液(α-SMA1∶800,MMP-91∶400,TIMP-11∶400,Collagen-Ⅰ1∶400,Collagen-Ⅲ1∶600)于4 ℃孵育过夜。PBS洗涤3次,滴加相应二抗溶液覆盖组织,室温孵育1 h,再次洗涤后,加新鲜配制的DAB显色液,镜下控制显色时间。最后脱水透明并封片,用于显微镜镜检。每组小鼠选取10个高倍视野(×400),结合阳性细胞百分比与着色强度进行免疫组化评分分析[11-13]。
1.2.5 统计学分析 采用GraphPad Prism 7.0 和SPSS 18.0软件进行统计分析,组间差异行配对t检验或单因素方差分析,P<0.05为差异具有统计学意义。
2 结果
2.1 NDUFA13fl/-小鼠肝组织损伤及肝纤维化表型
小鼠肝组织石蜡切片用于HE染色、Masson染色分析。图1 结果显示,相比同年龄对照小鼠,4 周龄NDUFA13fl/-小鼠肝组织小叶结构不清,肝细胞胞核皱缩坏死,Masson染色未见明显的胶原纤维生成(图1A、C);2年龄对照小鼠肝组织结构基本清晰,大部分肝细胞形态正常,少许细胞胞浆出现衰老性水样变性,而同年龄NDUFA13fl/-小鼠肝组织肝小叶排列紊乱,中央静脉及汇管区域出现大量浅蓝色胶原沉积(P<0.001,图1B、C),大部分肝细胞发生肿胀坏死,且可见炎症细胞浸润。
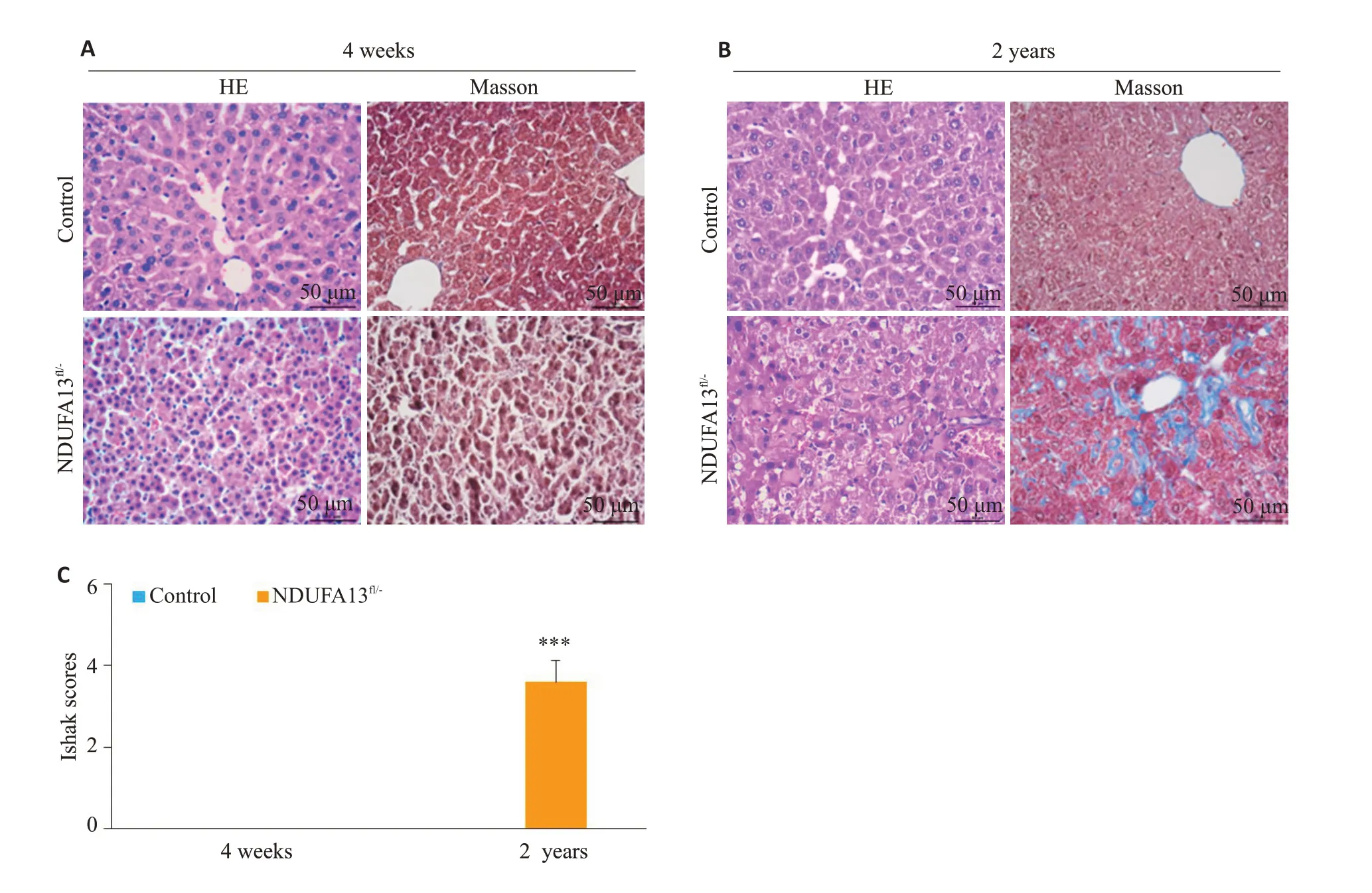
图1 HE染色、Masson染色检测小鼠肝组织损伤及纤维化情况Fig.1 Pathological and fibrotic changes in liver tissues of the mice revealed by HE staining and Masson staining(Original magnification:×400).A:HE staining and Masson staining of 4-week-old mice liver tissues. B:HE staining and Masson staining of 2-year-old mice liver tissues. C:Ishak scores of Masson staining.***P<0.001 vs control.
2.2 NDUFA13fl/-小鼠肝组织中NDUFA13蛋白的表达情况
2年龄小鼠肝组织提取全蛋白,用于Western blot检测NDUFA13蛋白表达水平。图2结果显示,相比对照小鼠,NDUFA13fl/-小鼠肝组织中的NDUFA13蛋白表达明显减少(P<0.001,图2A、B)。
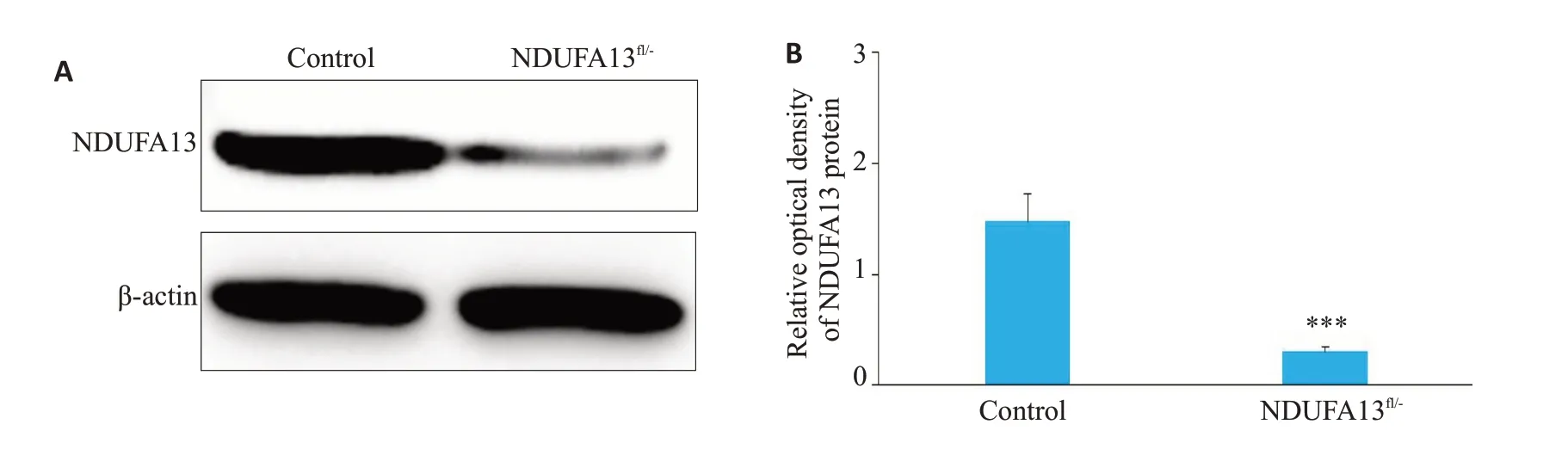
图2 NDUFA13fl/-小鼠肝组织NDUFA13蛋白表达检测Fig.2 NDUFA13 protein expression in the liver tissues detected by Western blotting.A:Western blots.B:Relative density of NDUFA13 expression.***P<0.001 vs control.
2.3 NDUFA13缺陷诱导巨噬细胞及炎症因子活化
2年龄小鼠肝组织用于免疫荧光检测,图3结果显示,与对照小鼠相比,NDUFA13fl/-小鼠肝组织中F4/80巨噬细胞浸润明显增多,伴随TGF-β1 分泌显著增加(P<0.001,图3A);且TNF-α与IL-1β炎症因子的表达也明显增强(P<0.001,图3B)。
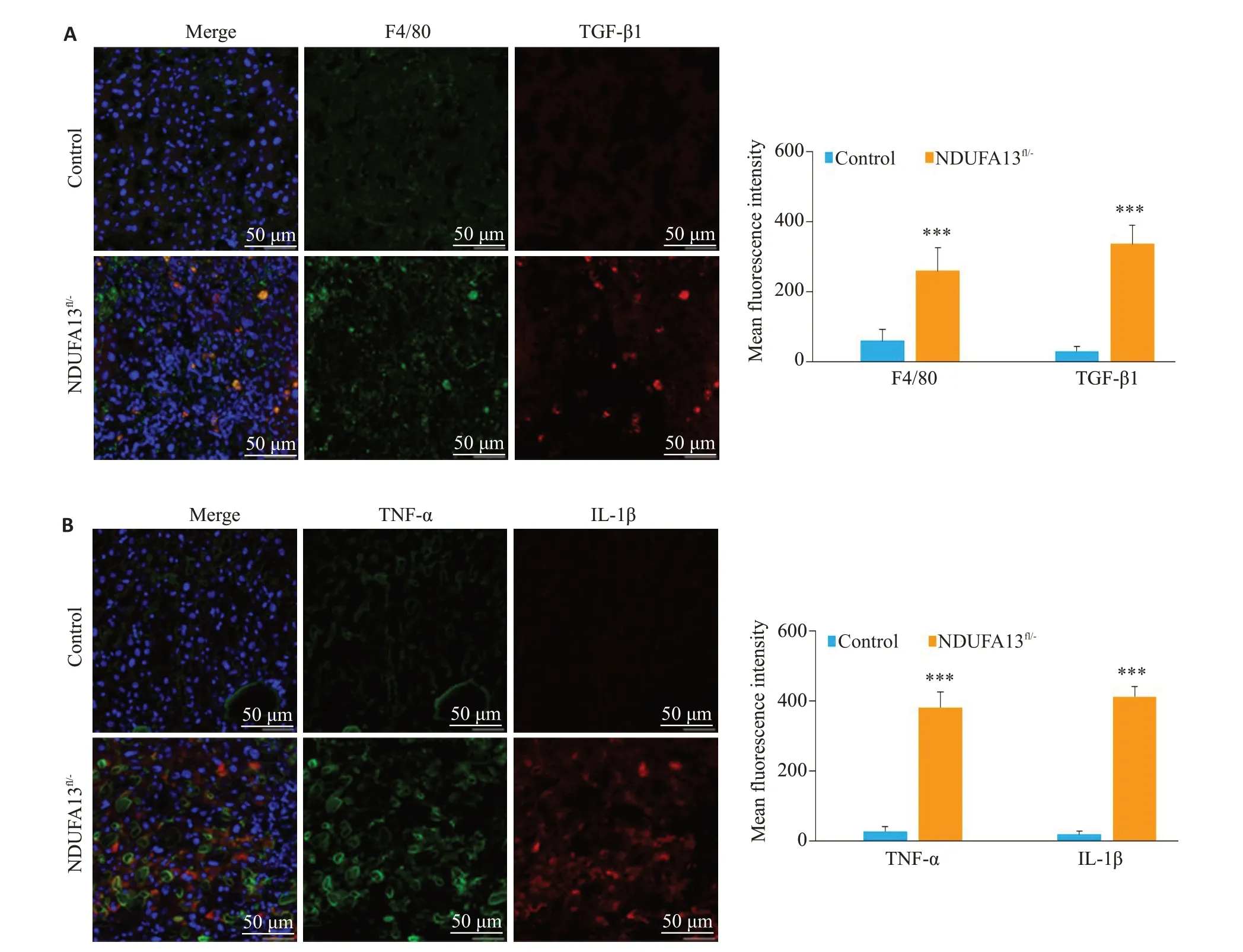
图3 NDUFA13缺陷诱导巨噬细胞及炎症因子活化Fig.3 NDUFA13 loss promotes activation of macrophages and inflammatory cytokines(Original magnification:×400).A:F4/80 and TGF-β1 expression in control and NDUFA13fl/-mice detected by immunofluorescence assay.B:TNF-α and IL-1β expressions in control and NDUFA13fl/-mice detected by immunofluorescence assay.***P<0.001 vs control.
2.4 NDUFA13缺陷诱导纤维化相关因子激活
2.4.1 肝星状细胞活化标志物α-SMA检测 2年龄小鼠肝组织用于免疫组化检测,结果显示对照小鼠肝脏组织未见明显的α-SMA阳性表达,而NDUFA13fl/-小鼠肝脏肝小叶内可见明显的胞浆棕褐色颗粒沉积,α-SMA阳性细胞显著增加(P<0.001,图4A、B)。
2.4.2 肝脏组织MMP-9、TIMP-1检测 2年龄小鼠肝组织用于免疫组化检测(图5),对照组小鼠肝组织可见散在的棕褐色颗粒MMP-9 表达,而NDUFA13fl/-小鼠肝组织MMP-9的表达明显减少(P<0.001,图5A、B);对照组小鼠肝组织中仅见少许TIMP-1阳性分布,而NDUFA13fl/-小鼠肝组织TIMP-1表达显著增强(P<0.001,图5A、C)。
2.4.3 肝脏组织胶原纤维Collagen-Ⅰ、Collagen-Ⅲ检测2年龄小鼠肝组织用于免疫组化检测,对照组小鼠肝组织未见明显的胶原沉积,而NDUFA13fl/-小鼠肝脏汇管区、中央静脉区及肝小叶内均有大量棕褐色聚集,Collagen-Ⅰ、Collagen-Ⅲ表达显著增加(P<0.001,图6A~C)。
3 讨论
肝纤维化是慢性肝损伤向肝硬化甚至肝癌转变的必经病理路径,能否在此阶段阻遏或逆转纤维化进程,是慢性肝疾病防控的难点与重点[14-15]。目前,有关肝纤维化的细胞与分子机制成为研究的热点,包括肌成纤维细胞激活、炎症信号转导、细胞自噬与衰老及细胞器功能失调等[16-17]。其中,线粒体作为细胞能量代谢和氧化应激调节的关键场所,其结构或功能的紊乱是多种急慢性肝病的重要病理特征,如线粒体肿胀、氧化磷酸化功能减弱及活性氧异常释放等[17],引起肝细胞代谢障碍和炎症激活[15]。此外,线粒体应激和损伤还可通过钙离子释放、融合与分裂动力学改变以及介导胞内信号转导等方式,调节肝脏细胞的自我更新、增殖与凋亡等过程[15]。探寻改善线粒体结构与功能稳态的治疗药物或靶点,可能是缓解肝炎与肝纤维化疾病的有效途径[14,18]。
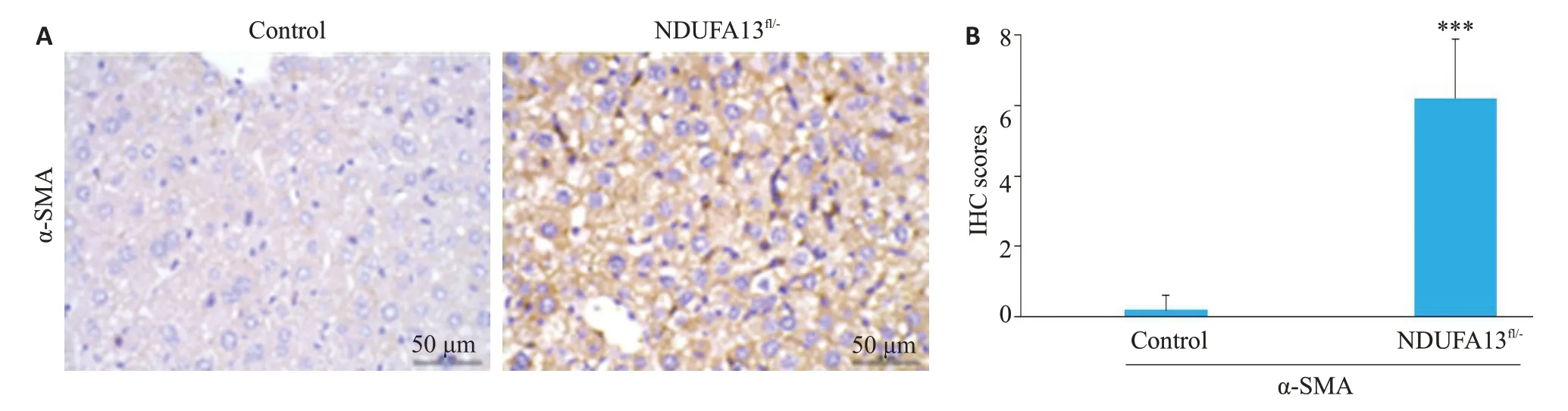
图4 NDUFA13缺陷诱导肝星状细胞α-SMA激活Fig.4 NDUFA13 deficiency induces α-SMA activation in hepatic stellate cells (× 400). A:α-SMA expression in control and NDUFA13fl/-mice revealed by IHC staining.B:Statistical analysis of α-SMAin control and NDUFA13fl/-mice.***P<0.001 vs control.
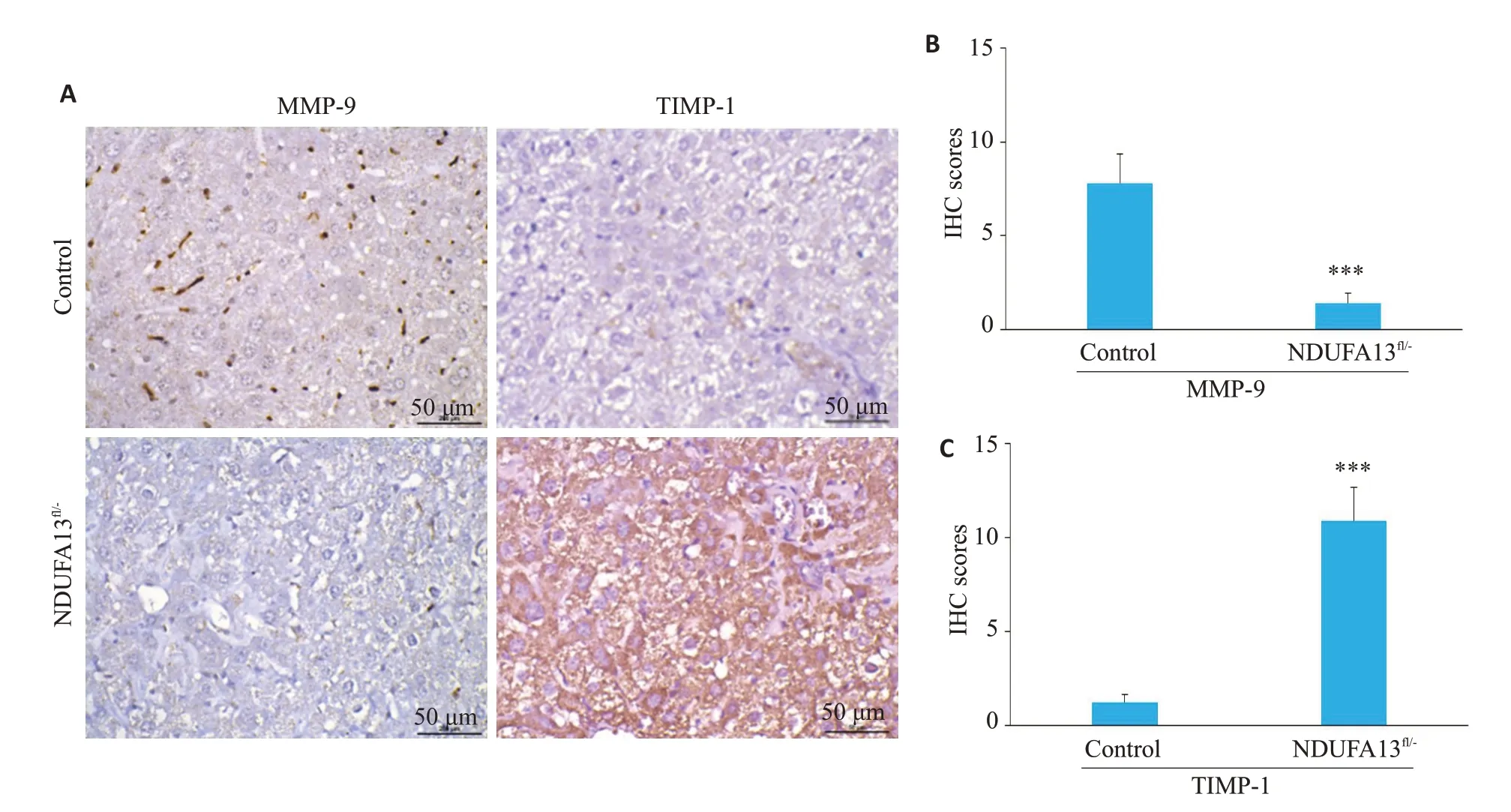
图5 NDUFA13缺陷诱导MMP-9/TIMP-1表达失衡Fig.5 NDUFA13 inactivation results in abnormal MMP-9 and TIMP-1 expression(×400).A:MMP-9 and TIMP-1 expression in Control and NDUFA13fl/- mice analyzed by IHC staining. B, C:Statistical analysis of MMP-9 and TIMP-1 in control and NDUFA13fl/-mice.***P<0.001 vs control.
NDUFA13作为一种线粒体呼吸链组分蛋白,对小鼠器官发育极其重要。有文献报道NDUFA13基因整体敲除可导致小鼠胚胎死亡[19],而我们实验发现NDUFA13 纯合敲除的小鼠几乎无法存活,这提示NDUFA13 蛋白在肝脏发育中的重要作用。近期NDUFA13作为一种新型的抑癌基因而备受关注,在多种恶性肿瘤中表达紊乱[7]。最新研究发现,NDUFA13蛋白可抑制STAT3信号介导的炎症反应而减轻DSS诱导的结肠炎[20],并可抑制类风湿关节炎成纤维细胞样滑膜细胞的增殖和侵袭[21],在炎症调控中发挥重要作用。课题组前期揭示了NDUFA13在慢性萎缩性胃炎病理进程中表达渐进性下调的特点[6],后续我们证实了NDUFA13失活可通过激活ROS/NF-κB/NLRP3炎症通路,募集炎症细胞并分泌炎症因子,从而诱导小鼠自发性肝炎[7]。本研究进一步探讨了肝细胞NDUFA13缺陷在诱导小鼠自发性肝纤维化中的作用及初步机制,发现NDUFA13缺失可诱导巨噬细胞活化并分泌TGF-β1等促纤维化炎性因子,进而激活HSCs,导致胶原沉积而促成肝纤维化。
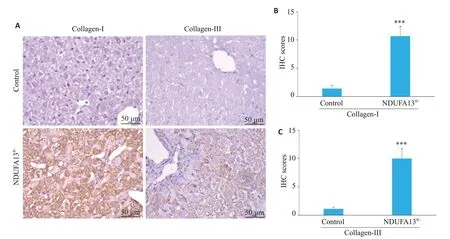
图6 NDUFA13缺陷诱导胶原纤维沉积Fig.6 NDUFA13 inactivation causes collagen deposition in the liver(×400).A:Collagen-I and collagen-III expression in control and NDUFA13fl/- mice analyzed by IHC staining. B, C:Statistical analysis of collagen-I and collagen-III in control and NDUFA13fl/-mice.***P<0.001 vs control.
细胞外基质(ECM)的过度沉积是慢性肝损伤发生纤维化转变的直接原因,而HSCs作为胶原纤维的主要生产者,其增殖与活化是肝纤维化病理的核心环节[16]。多种炎症和纤维化相关的信号通路均可激活HSCs[16]。其中,转化生长因子TGF-β家族涉及各种纤维化疾病的发生发展过程[22],能与多种信号分子如活性氧(ROS)、血小板源生长因子(PDGF)、结缔组织生长因子(cTGF)等相互作用,被认为是驱动HSCs活化与ECM沉积的关键因子[23]。作为研究最广泛的一类转化生长因子,TGF-β1主要由肝组织内Kupffer巨噬细胞表达和释放,通过激活Smad2/3信号通路诱导HSCs内Collagen-Ⅰ、Collagen-Ⅲ胶原转录[16],还可介导脂质富集的肝细胞死亡[24],并诱导肝细胞结缔组织生长因子产生[25],促进肝纤维化发生。但鉴于TGF-β1广泛的生物学作用,其对肝纤维化及慢性肝病也存在其他多种调控机制与途径[23]。除了分泌TGF-β1等促纤维化因子,肝脏巨噬细胞也释放促肝细胞凋亡介质,募集炎症细胞并激活肌成纤维细胞[26]。此外,巨噬细胞还能促进HSCs的增殖与迁移[27]。我们的研究结果发现,NDUFA13表达缺失的小鼠肝组织中,巨噬细胞趋化聚集并分泌大量TGF-β1,刺激并激活静息HSCs转化为可分泌α-SMA的肌成纤维细胞。这提示NDUFA13缺陷可诱导肝脏巨噬细胞活化与TGF-β1释放,为HSCs的活化提供诱因。
炎症因子的分泌伴随慢性肝炎-肝纤维化病理的全过程,在纤维化的起始和延续中发挥重要作用。IL-1β与TNF-α作为强效炎症细胞因子,可由多种细胞分泌产生如巨噬细胞或活化HSCs 等。IL-1β在炎症小体NLRP3的作用下剪切成熟与释放,触发炎症反应,参与多种因素诱导的肝纤维化病理过程[27]。TNF-α可促进肝细胞凋亡、免疫细胞活化和抑制星状细胞凋亡。研究报道了NLRP3通过IL-1β、TNF-α等促炎因子的活化而诱导肝细胞损伤与肝纤维化[28-29]。此外,IL-1β、TNF-α均可上调基质金属蛋白酶组织抑制剂TIMP-1的表达,并介导巨噬细胞对星状细胞NF-κB信号的活化,但它们并不直接活化HSCs,而是通过促进活化星状细胞在体内外的存活而发挥作用[30]。结合我们前期的研究结果,NDUFA13失活诱导活性氧ROS异常释放而活化NF-κB/NLRP3炎症通路,引起IL-1β、TNF-α等炎症因子的分泌与释放,进一步促进HSCs增殖与活力,推动纤维化进程。
肝脏ECM的动态平衡主要由基质金属蛋白酶/基质金属蛋白酶组织抑制剂(MMPs/TIMPs)调节和维持。MMPs 可降解胶原蛋白,其活性受TIMPs 的抑制。在活化的HSCs中,MMPs/TIMPs 合成与分泌失衡,导致ECM降解减少而异常沉积,促进纤维化形成[28]。文献报道了纤维细胞因子TGF-β1 和炎性细胞因子IL-1β、TNF-α等均可调控MMPs/TIMPs蛋白的表达与活性[27,31]。这与我们的实验结果相一致,NDUFA13缺陷的小鼠肝脏中,活化的巨噬细胞分泌产生大量TGF-β1及IL-1β、TNF-α,通过影响MMP-9表达下调、TIMP-1表达上调,促进组织内Collagen-Ⅰ、Collagen-Ⅲ等胶原纤维的沉积,最终形成肝纤维化。
综上所述,小鼠肝脏NDUFA13缺陷可以诱导自发性的慢性肝纤维化病理表型,其可能机制为NDUFA13缺失诱导巨噬细胞活化并分泌TGF-β1及IL-1β、TNF-α等炎症相关因子,进一步激活HSCs 并扰乱MMPs/TIMPs平衡,促进Collagen-Ⅰ、Collagen-Ⅲ等胶原纤维的分泌与沉积。本研究立足于前期有关“小鼠肝脏NDUFA13失活通过调控ROS/NF-κB/NLRP3炎症通路诱导自发性肝炎病理进程”的研究[8],进一步明确了NDUFA13在后续肝纤维化中的调控作用与初步机制,对慢性肝病及肝纤维化恶性进展的早期防治具有重要意义,并为慢性肝炎-肝纤维化相关药物或机制研究提供一种有利的动物模型。后续我们将采用诱导型敲除小鼠模型,实现在小鼠出生后的肝脏特异性敲除,获得NDUFA13 杂合和纯合敲除小鼠,继而深入探究NDUFA13缺陷活化肝星状细胞的具体分子机制,揭示其相关区域的免疫学特征。