康艾注射液联合化疗治疗晚期非小细胞肺癌疗效的Meta分析
周翔辉 闫志国 刘文攀 倪昌国
【摘要】 目的:評价康艾注射液联合化疗治疗晚期非小细胞肺癌(NSCLC)的疗效。方法:计算机检索中国知网(CNKI)、万方数据库、维普数据库(VIP)、中国生物医学文献数据库(CBM)、PubMed、Embase、Cochrane library等中英文数据库近10年有关康艾注射液联合化疗治疗晚期NSCLC的随机对照试验。文献质量进行评价后对符合标准的文献予以纳入,提取研究结果等相应指标,用RevMan5.0软件对治疗总有效率、治疗后KPS评分、骨髓抑制发生情况、胃肠道反应发生率等指标进行Meta分析。结果:共纳入16篇文献,1 223例患者纳入研究,康艾注射液联合化疗组在总有效率[RR=1.44,95%CI(1.26,1.65),P<0.01]、KPS评分改善情况[RR=0.56,95%CI(0.02,1.09),P<0.01]和减轻胃肠道反应[RR=0.62,95%CI(0.53,0.72),P<0.01]方面优于单纯化疗组;在减轻骨髓抑制方面的亚组分析显示,对于减轻Ⅰ°~Ⅱ°骨髓抑制,联合组和单纯化疗组效果相当,差异无统计学意义[RR=0.83,95%CI(0.69,1.00),P=0.05],但在减轻Ⅲ°~Ⅳ°骨髓抑制上,联合组明显优于单纯化疗组[RR=0.40,95%CI(0.26,0.62),P<0.01],并且最终亚组合并效应为联合组优于单纯化疗组[RR=0.70,95%CI(0.59,0.83),P<0.01]。结论:康艾注射液联合化疗治疗晚期NSCLC有一定增效、减毒、减轻不良反应的作用,但由于所纳入文献质量均为小样本、单中心研究,可能存在一定偏倚,尚需更多多中心随机对照试验进一步证实。
【关键词】 康艾注射液 化疗 晚期非小细胞肺癌
[Abstract] Objective: To evaluate the efficacy of Kangai injection combined with chemotherapy for advanced non-small cell lung cancer (NSCLC). Method: The databases like CNKI, Wangfang, VIP, CBM, PubMed, Embase and Cochrane library for RCT about the treatment of Kangai Injection combined with chemotherapy for advanced NSCLC were searched. After the evaluation of the quality of the literatures, the literatures meeting the standards were included, and the corresponding indicators such as the research results were extracted. The total effective rate, KPS score after treatment, incidence of myelosuppression, incidence of gastrointestinal reactions and other indicators were meta analyzed by revman5.0 software. Result: 16 studies and 1 223 patients were absorbed into this article. Kangai Injection combined chemotherapy group in the total effective rate[RR=1.44, 95%CI(1.26, 1.65), P<0.01], KPS improvement [RR=0.56, 95%CI(0.02, 1.09), P<0.01] and reducing the gastrointestinal reaction [RR=0.62, 95%CI(0.53, 0.72), P<0.01] was better than pure chemotherapy group. The subgroup analysis of reducing the bone marrow suppression showed: for reducing the Ⅰ°-Ⅱ° bone marrow suppression, there was no statistically significant difference in these two groups [RR=0.83, 95%CI(0.69, 1.00), P=0.05]; but in reducing the Ⅲ°-Ⅳ° marrow suppression, Kangai Injection combined chemotherapy group is better than pure chemotherapy group [RR=0.40, 95%CI(0.26, 0.62), P<0.01], in total effect, the experimental group was better than the control group [RR=0.70, 95%CI(0.59, 0.83), P<0.01]. Conclusion: Kangai Injection combined chemotherapy for advanced NSCLC can increase curative effect and reduce the toxicity of chemotherapy, however quality are included in the literature are based on small samples, single-center study,we meed more polycentric study to prove further.
[Key words] Kangai Injection Chemotherapy Advanced non-small cell lung cancer
原发性肺癌是指起源于支气管黏膜上皮的恶性肿瘤,肺癌已成为全球发病率和死亡率均第一的恶性肿瘤,从我国近年来城乡前10位恶性肿瘤构成来看,肺癌已超过肝癌成为我国首位恶性肿瘤,严重威胁国民健康[1]。根据其组织病理学类型不同,肺癌又可分为小细胞肺癌(small cell lung cancer,SCLC)及非小细胞肺癌(small cell lung cancer,NSCLC)。在我国以NSCLC更为常见,约占85%[2]。根据美国国立癌症综合网络(NCCN)关于NSCLC的指南指出:许多NSCLC患者一经诊断即为中晚期,部分甚至出现多处远处转移等,丧失手术机会[3]。治疗晚期NSCLC强调以全身治疗为主的综合治疗,而化疗作为晚期肺癌的重要治疗手段,在患者预期寿命的延长,提高和改善生活质量,延缓疾病进展等方面起着重要作用,常用方案为含铂的经典双药联合方案[4]。然而化疗对人体免疫系统、骨髓造血系统有较明显的抑制作用,且不良反应明显,严重影响疾病的治疗和患者的生活质量[5]。康艾注射液是由黄芪、人参、苦参提取物组成的复方中成药制剂,在增强晚期NSCLC患者机体免疫力、减轻化疗不良反应和骨髓移植方面有着一定作用[6]。随即不少关于康艾注射液联合化疗治疗晚期NSCLC的研究大量展开,本文通过对有关研究进行检索,通过Meta分析以证实其疗效,现报道如下。
1 资料与方法
1.1 检索策略 计算机检索中国知网(CNKI)、万方数据库、维普数据库(VIP)、中国生物医学文献数据库(CBM)、PubMed、Embase、Cochrane library等中英文数据库2009年至今有关康艾注射液联合化疗治疗晚期NSCLC的随机对照试验,语种包括中文和英文。中文检索词为“康艾注射液联合化疗,晚期非小细胞肺癌”英文检索词为“Kangai injection combined with chemotherapy,advanced non-small cell lung cancer,advanced NSCLC”。
1.2 文献纳入与排除标准 纳入标准:(1)研究对象,均为经病理组织学或细胞学明确诊断为Ⅲ~Ⅳ的NSCLC,具体性别、年龄、种族均不限;(2)研究类型,随机对照试验(RCT),无论是否采用盲法,基线需一致具有可比性;(3)干预措施,试验组采用康艾注射液联合化疗,对照组仅采用化疗,无论化疗方案;(4)观察指标:①采用WHO公布的实体瘤疗效评价標准,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(NC)、疾病进展(PD),总体有效=CR+PR;②以Karnofsky评分标准作为生活质量评定标准,其中经治疗后KPS提高≥10分为改善,KPS减小>10分为恶化,KPS增减<10分为稳定;③骨髓抑制发生情况(Ⅰ°~Ⅳ°);④胃肠道不良反应发生情况为至少包含上述一种指标。排除标准:(1)2009年以前的研究;(2)数据不详尽,难以进行Meta;(3)除中英文以外的其他文献;(4)动物实验。
1.3 资料提取与质量评价 由两位研究者按照纳入与排除标准进行资料的提取,如遇分歧时由第三位研究者进行判定,提取的资料包括语种、文献题目、作者、年份、随机方法、盲法应用、研究对象纳入与排除标准、干预措施、观察指标等。文献的质量评价采用改良Jadad评分表进行评价,其中包括随机化方法恰当与否(恰当2分,不详1分,不当0分),是否分配隐藏(采用2分,不清楚1分,未采用0分),是否应用盲法(应用2分,不详1分,未应用0分),是否描述退出研究或失访人数及原因(描述1分,未描述0分)。
1.4 统计处理 采用Cochrane协作网提供的RevMan5.0软件进行Meta分析,采用字2检验进行各研究间的异质性检验,当I2>50%时提示各研究存在明显异质性,采用随机效应模型;当I2<50%提示各研究异质性不明显,采用固定效应模型。计量资料采用加权均数差(WMD)或标准化均数差(SMD)进行统计分析,而对计数资料则采用相对危险度(RR)或比值比(OR),并计算95%可信区间(95%CI)。
2 结果
2.1 文献检索结果 经过计算机检索出156篇文献,通过阅读标题和摘要初步筛选出38篇文献,对其进行进一步深入阅读进行排除,最终纳入16篇文献。
2.2 文献基本资料的提取和质量评价结果 在所纳入的16篇文献中均采用随机化原则,其中2篇采用随机数字表法,其余随机方法不详。所有研究两组基线一致,具有可比性,所有文献盲法应用不详。基本资料及质量评价结果见表1、2。
2.3 Meta分析结果
2.3.1 联合治疗总有效率 16篇文献[7-22]均对康艾注射液联合化疗治疗晚期NSCLC的总有效率进行了报道,各研究的异质性小(P=0.67,I2=0),采用固定效应模型。Meta分析结果表明试验组总体有效率高于对照组,两组差异有统计学意义[RR=1.44,95%CI(1.26,1.65),P<0.01],联合康艾治疗组能提高总体疗效。见图1。
2.3.2 治疗后KPS评分改善情况比较 10篇文献[8,10-11,15-21]对治疗后KPS评分改善情况进行了报道,KPS评分提高>10分即认为KPS得到改善,各研究的异质性小(P=0.21,I2=25%),采用固定效应模型。Meta分析结果表明试验组治疗后KPS评分改善率高于对照组,两组差异有统计学意义[RR=0.56,95%CI(0.46,0.68),P<0.01],联合康艾试验组能改善患者KPS评分,提高患者生活质量。见图2。
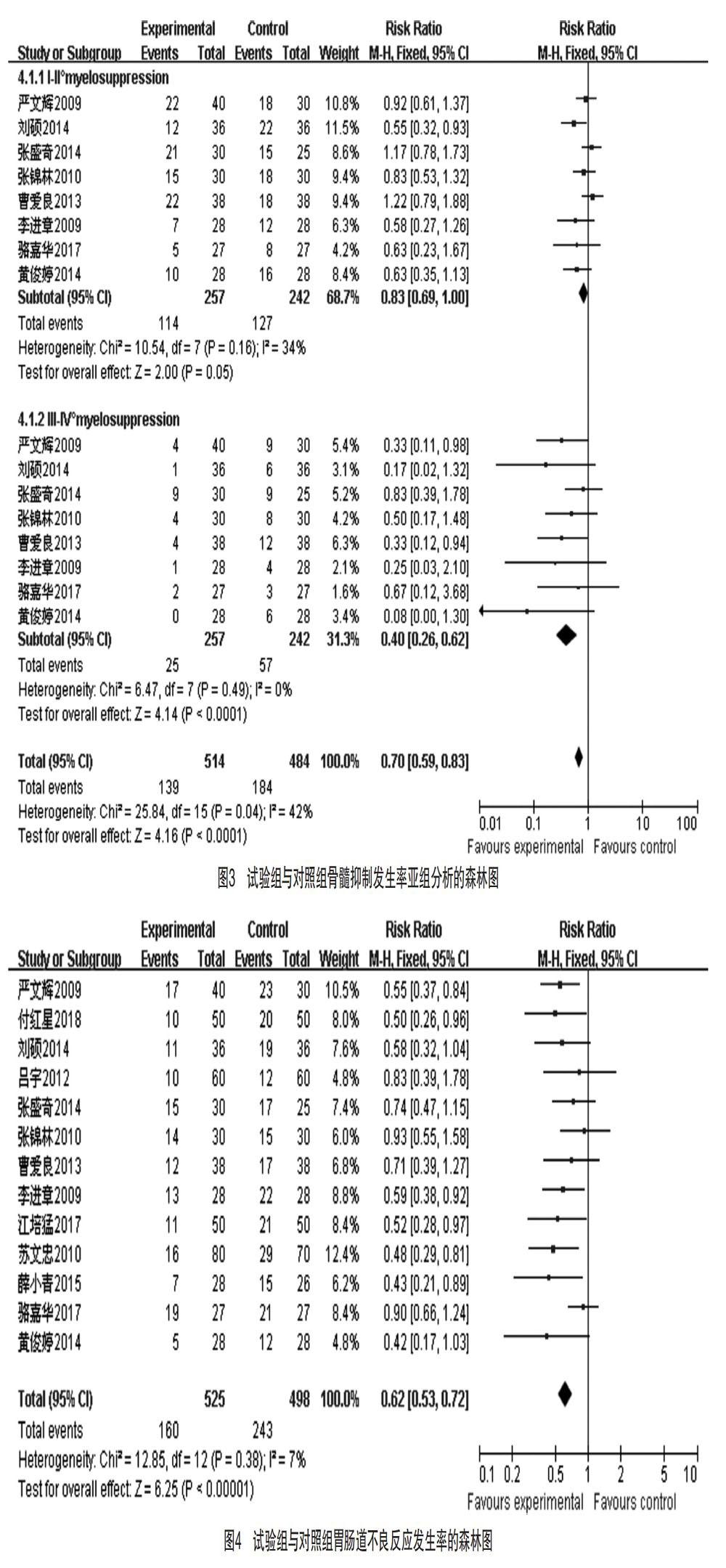
2.3.3 患者骨髓抑制发生率的亚组分析 8篇文献[7-8,10,12,15,17-18,20]对治疗后Ⅰ°~Ⅱ°和Ⅲ°~Ⅳ°骨髓抑制发生情况进行了报道,各研究的异质性中等(P=0.04,I2=42%),采用固定效应模型,Ⅰ°~Ⅳ°骨髓抑制总体发生率试验组低于对照组,差异有统计学意义[RR=0.70,95%CI(0.59,0.83),P<0.01]。按Ⅰ°~Ⅱ°和Ⅲ°~Ⅳ°骨髓抑制进行两个亚组分析,亚组Meta分析显示试验组和对照组Ⅰ°~Ⅱ°骨髓抑制发生率一致,差异无统计学意义[RR=0.83,95%CI(0.69,1.00),P=0.05];而Ⅲ°~Ⅳ°骨髓抑制試验组明显低于对照组,差异有统计学意义[RR=0.40,95%CI(0.26,0.62),P<0.01],提示化疗联合康艾能有效降低严重骨髓抑制的发生率,但同样有一定程度会发生轻微骨髓抑制。见图3。
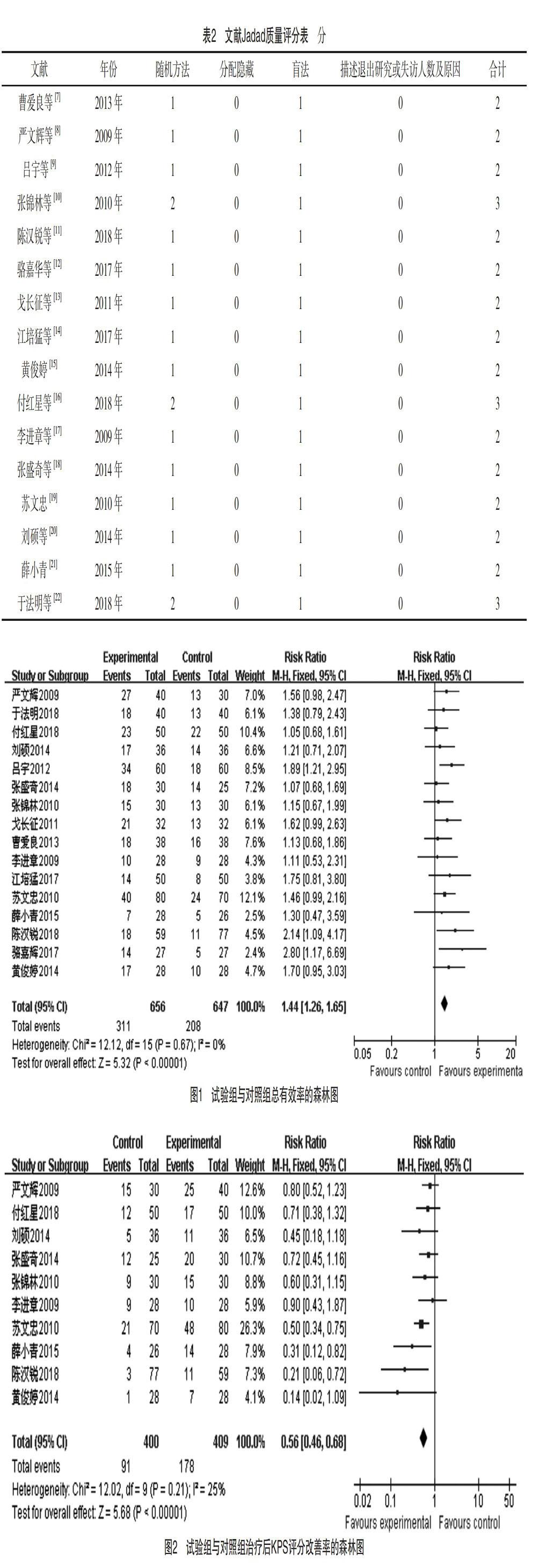
2.3.4 两组胃肠道不良反应发生率的比较 13篇文献[7-10,12,14-21]对两组胃肠道不良反应发生情况进行了报道,各研究的异质性小(P=0.38,I2=7%),采用固定效应模型。Meta分析结果表明试验组胃肠道不良反应发生率低于对照组,两组差异有统计学意义[RR=0.62,95%CI(0.53,0.72),P<0.01],联合康艾治疗能减轻化疗对患者胃肠道的不良反应。见图4。
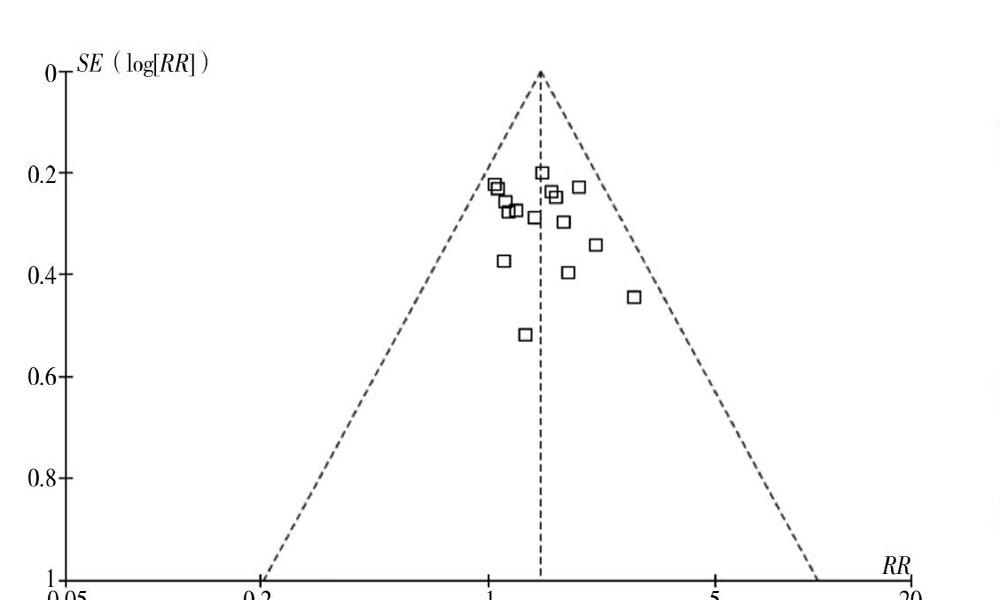
2.3.5 发表偏倚 以总有效率做漏斗图,漏斗图散点左右基本对称,表明发表偏倚较小。见图5。
3 讨论
含铂的双药化疗方案为晚期NSCLC的有效治疗手段,可将患者2年生存率提升到10%左右[23],但由于化疗缺乏组织特异性,对肿瘤组织和正常组织均有杀伤作用,在杀灭肿瘤的同时也会产生免疫抑制、骨髓抑制、胃肠道反应等一系列不良反应,降低患者的治疗效果、生活质量和依从性,疗效受到一定限制[24-25]。人参、黄芪、苦参为康艾注射液的主要成分,中医理论认为,人参性微温,能益气固脱、大补元气,其有效成分人参皂苷、人参挥发油均有一定抗肿瘤作用,而黄芪能补气升阳、益气固表,苦参则清热燥湿、滋阴养阴,三者合用具有协同作用,是许多抗肿瘤药的增敏药和减毒药。不少现代药理学研究也证实了其抗肿瘤活性,例如明海霞等[26]研究表明黄芪多糖能提高肺癌小鼠体内多种免疫增强细胞因子的水平,增强免疫力,童明传等[27]证明人参皂苷能减低乳腺癌小鼠模型中VEGF的水平,从而一定程度上能发挥抑制肿瘤血管生成功效。
本研究通过对康艾注射液联合化疗治疗晚期NSCLC的相关研究结果进行Meta分析,结果表明康艾联合化疗能提高化疗总体治疗有效率,改善患者KPS评分,即提高患生活质量,起到一定增效作用。并且化疗联合康艾后能明显降低患者中重度骨髓抑制和胃肠道不良反应发生率,增加患者舒适度和治疗依从性,起一定减毒功效,与前述理论及研究相符合。但对于轻度骨髓抑制的发生,康艾联合化疗和单纯化疗并无明显差别,表明联合治疗仍有一定程度轻微骨髓抑制的发生。然而本研究所纳入文献均为小样本、单中心文献,方法学水平不高,各研究存在一定的异质性,虽然漏斗图基本对称,但仍呈现一定的不对称性,可能存在一定的发表偏倚。所以为了进一步证实康艾注射液联合化疗治疗晚期NSCLC的增效减毒疗效和具体机制,仍需通过更多多中心、大样本、高质量的随机对照研究和基础研究来进一步阐明。
参考文献
[1] Siegel R L,Miller K D,Jemal A.Cancer statistics,2019[J].CA Cancer J Clin,2019,69(1):7-34.
[2] Gazdar A F,Bunn P A,Minna J D.Small-cell lung cancer: what we know, what we need to know and the path forward[J].Nat Rev Cancer,2017,17(12):725-737.
[3] Ettinger D S,Wood D E,Aisner D L,et al.Non-Small Cell Lung Cancer, Version 5.2017, NCCN Clinical Practice Guidelines in Oncology[J].J Natl Compr Canc Netw,2017,15(4):504-535.
[4]石远凯,孙燕,于金明,等.中国晚期原发性肺癌诊治专家共识[J].中国肺癌杂志,2016,19(1):1-15.
[5] Verma R,Foster R E,Horgan K,et al.Lymphocyte depletion and repopulation after chemotherapy for primary breast cancer[J].Breast Cancer Res,2016,18(1):10.
[6]樊慧婷,林洪生.康艾注射液调节荷瘤机体免疫功能的研究[J].中国新药杂志,2016,25(18):2154-2160.
[7]曹爱良,彭顺清,严权.康艾联合化疗对非小细胞肺癌的临床疗效及免疫功能的影响[J].中外医学研究,2013,11(22):45-46.
[8]严文辉,彭新茂,朱中山,等.康艾注射液联合DP方案治疗晚期非小细胞肺癌对照研究[J].中南药学,2009,7(5):384-86.
[9]吕宇.康艾注射液联合TP方案治疗晚期非小细胞肺癌的临床研究[J].现代预防医学,2012,39(22):6061-6062,6065.
[10]张锦林,杨磊.康艾注射液联合TP方案治疗中晚期肺癌的临床观察[J].现代肿瘤医学,2010,18(6):1132-1134.
[11]陈汉锐,田华琴,陈志明,等.康艾注射液联合单药化疗治疗老年晚期非小细胞肺癌的有效性和安全性[J].实用医学杂志,2018,34(2):316-319.
[12]骆嘉华,李增辉,汤忠明.康艾注射液联合化疗用于中晚期非小细胞肺癌的疗效观察[J].吉林医学,2017,38(5):830-831.
[13]戈长征,徐炎华,张定富,等.康艾注射液联合化疗治疗老年晚期非小细胞肺癌32例临床观察[J].中医药导报,2011,17(9):24-26.
[14]江培猛,陈静波,胡刚.康艾注射液联合化疗治疗老年晚期非小细胞肺癌100例的效果观察[J].临床医学,2017,37(6):119-120.
[15]黄俊婷.康艾注射液联合化疗治疗老年晚期非小细胞肺癌疗效观察[J].当代医学,2014,20(6):145-146.
[16]付红星,冯小剑,彭文苗,等.康艾注射液联合化疗治疗晚期非小细胞肺癌的臨床研究[J].医学信息,2018,31(24):115-117.
[17]李进章,姬发祥,赵久达,等.康艾注射液联合化疗治疗晚期非小细胞肺癌临床研究[J].中国现代医药杂志,2009,11(12):12-13.
[18]张盛奇,林丽芳,郑泓斌,等.康艾注射液联合化疗治疗晚期肺癌55例疗效观察[J].中国医药科学,2014,4(12):62-64.
[19]苏文忠.康艾注射液联合化疗治疗中晚期非小细胞肺癌临床观察[J].山西中医,2010,26(12):31-32.
[20]刘硕,王辉,林洪生.康艾注射液配合化疗治疗晚期非小细胞肺癌的临床研究[J].世界中医药,2014,9(3):323-325.
[21]薛小青.康艾注射液联合化疗治疗晚期非小细胞肺癌的临床研究[D].新疆:新疆医科大学,2015.
[22]于法明,姜东亮,赵云,等.DP化疗方案联合康艾注射液对晚期非小细胞肺癌的控制效果[J].中国卫生工程学,2018,17(2):278-280.
[23] Hanna N,Johnson D,Temin S,et al.Systemic Therapy for Stage IV Non-Small-Cell Lung Cancer: American Society of Clinical Oncology Clinical Practice Guideline Update[J].J Clin Oncol, 2017,35(30):3484-3515.
[24] Dumont D,D? P,Lerouge D,et al.Off-Label Use of Crizotinib as a Neoadjuvant Treatment for a Young Patient When Conventional Chemotherapy Gave No Benefits in Stage IIIA on-Small Cell Lung Cancer[J].Am J Case Rep,2017,18:890-893.
[25]李崇阳,段忠玉,杨榆青,等.晚期肺癌化疗后肺部感染的病原学分析[J].昆明医科大学学报,2014,35(5):64-67.
[26]明海霞,陈彦文,胡永浩,等.黄芪多糖对Lewis肺癌小鼠细胞因子及顺铂所致免疫功能低下的影响[J].中国实验动物学报,2014,22(5):44-48.
[27]童传明,郑荆州.重组人血管内皮抑素联合人参皂甙Rg3抑制乳腺癌移植瘤生长的动物研究[J].海南医学院学报,2016,22(6):531-534.
(收稿日期:2020-03-10) (本文编辑:周亚杰)

