右美托咪定抑制HMGB1/TLR4/NF-κB信号通路减轻大鼠心肌缺血再灌注损伤研究
金莲锦 胡春阳 李罡 刘岩 李琳 温立勇
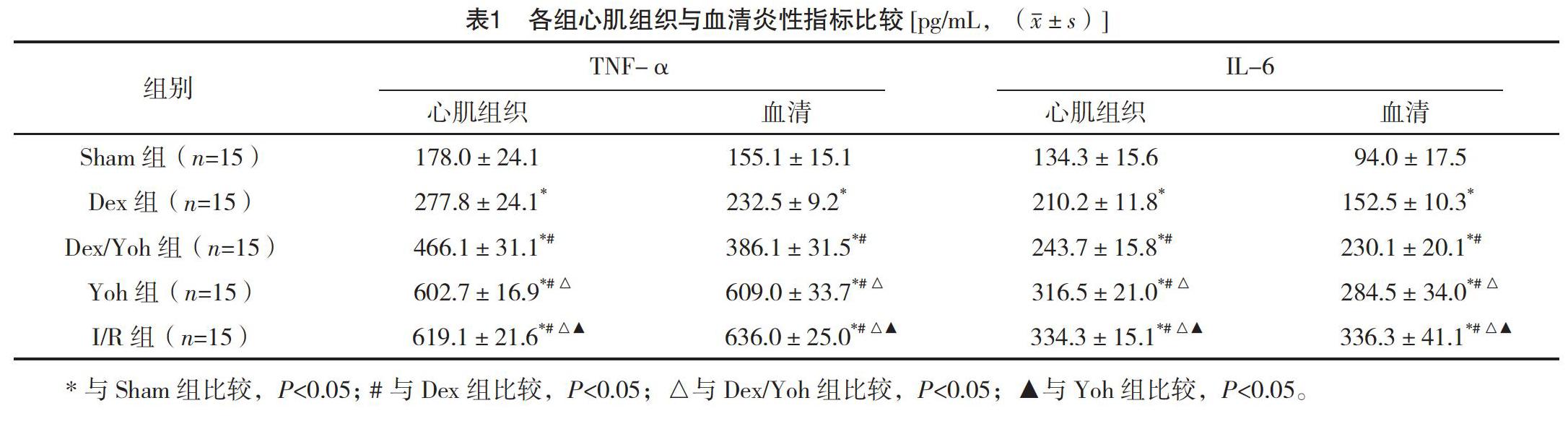

【摘要】 目的:观察右美托咪定(Dex)对心肌缺血再灌注损伤大鼠心肌功能、炎症反应及HMGB1/TLR4/NF-κB信号通路的影响。方法:取75只成年SPF级10周龄雄性SD大鼠。运用可复性结扎LAD法建立心肌缺血再灌注损伤(MIRI)模型。随机均分为假手术组(Sham组)、Dex预处理+MIRI组(Dex组)、Dex+育亨宾+MIRI组(Dex/Yoh组)、育亨宾预处理+MIRI组(Yoh组)与MIRI组(I/R组),每组15只。比较各组心肌梗死面积(IS/AAR)。运用ELISA检测并比较各组心肌组织与血清TNF-α、IL-6水平。采用 Western blot检测并比较心肌组织HMGB1、TLR-4、MyD88、NF-κB蛋白表达情况。结果:Dex组、Dex/Yoh组、Yoh组及I/R组心肌组织与血清TNF-α、IL-6水平均高于Sham组,其中Dex组 【关键词】 右美托咪定 HMGB1/TLR4/NF-κB信号通路 心肌缺血再灌注损伤 [Abstract] Objective: To observe the effects of Dexmedetomidine (Dex) on myocardial function, inflammatory response and HMGB1/TLR4/NF-κB signaling pathway in rats with myocardial ischemia-reperfusion injury. Method: A total of 75 adult SPF 10-week-old male SD rats were selected. The model of myocardial ischemia reperfusion injury (MIRI) was established by using the repeatable ligation LAD method. They were randomly divided into Sham operation group (Sham group), Dex pretreatment+MIRI group (Dex group), Dex+Yohimbine+MIRI group (Dex/Yoh group), Yohimbine pretreatment+MIRI group (Yoh group) and MIRI group (I/R group), 15 rats in each group. The myocardial infarction area (IS/AAR) was compared in each group. The levels of TNF-α and IL-6 in myocardial tissue and serum were detected and compared by ELISA. The protein expressions of HMGB1, TLR-4, MyD88 and NF-κB in myocardial tissues were detected and compared by Western blot. Result: The levels of TNF-α and IL-6 in myocardial tissue and serum of the Dex group, Dex/Yoh group, Yoh group and I/R group were higher than those in the Sham group, and Dex group group NF-κB in myocardial tissues of Dex group, Dex/Yoh group, Yoh group and I/R group were higher than those in Sham group, and Dex group [Key words] Dexmedetomidine HMGB1/TLR4/NF-κB signaling pathway Myocardial ischemia-reperfusion injury First-authors address: Hongqi Hospital Affiliated to Mudanjiang Medical College, Mudanjiang 157011, China doi:10.3969/j.issn.1674-4985.2021.09.007 缺血性心肌病(ICM)属于一类心血管疾病,对人类健康造成了严重危害,死亡人数达到了每年700万以上,在全球范围内导致患者死亡的疾病中,ICM占有重要地位[1]。缺血心肌在恢复血液再灌注后,可导致心肌细胞出现不可逆损伤加重,即为心肌缺血再灌注损伤(MIRI)。相关研究指出,右美托咪定(Dex)可通过抑制心肌炎症反应来减轻再灌注损伤[2]。因此,本文研究了MIRI大鼠中Dex对心肌的保护作用及其机制,现报道如下。 1 材料与方法 1.1 材料 (1)实验动物:购买苏州西诺塞生物科技有限公司提供的成年SPF级10周龄雄性SD大鼠75只[使用许可证号:SCXK(苏)2013-0003],在恒温(22.0±2.0)℃的单笼中饲养,所有操作均在光照时间内进行,周期光照9:00~21:00,在笼上放置饲料、纯净水,让大鼠自由食用。(2)造模材料:购买江苏恒瑞医药股份有限公司生产的右美托咪定,美国Selleck公司生产的育亨宾,国药集团化学试剂有限公司生产的水合氯醛,上海奥尔科特生物科技有限公司生产的小动物呼吸机(型号:ALC-V8型),浙江史密斯医学仪器有限公司生产的双通道微量注射泵(型号:WZS-50F6),苏州碧迪医疗器械有限公司生产的静脉留置针(型号:3REF83403直型),BD公司生产的2 mL与5 mL注射器。 1.2 方法 1.2.1 可复性结扎LAD法造模 术前12 h让SD大鼠禁食,不禁水,给予大鼠腹腔注射0.8~1.0 mL/100 g 4%水合氯醛进行麻醉,然后大鼠取仰卧位,在手术台上固定,将电极针插入大鼠四肢,对其术中心电图变化进行持续监测。气管插管后连接呼吸机,将潮气量、呼吸频率分别调节为2.0~2.5 mL/100 g、75 次/min。分离大鼠右侧颈总动脉后插管,连接实验动物监测系统,记录平均动脉压(MAP)、心率(HR)数值。将胸腔打开,位置为胸骨旁0.5 cm,方向为沿着胸骨左缘3~4肋间,分离心包膜,寻找左冠状动脉前降支(LAD),用4-0慕丝线结扎LAD中上1/3,缺血成功的标准为心电图检查ST段弓背向上抬高,维持30 min后将结扎丝线解开,再持续灌注2 h。最后可见抬高的ST段回落。提示MIRI模型建立成功。 1.2.2 分组方法及处理 75只大鼠随机平均分为假手术组(Sham组)、右美托咪定预处理+缺血再灌注组(Dex组)、右美托咪定+育亨宾+缺血再灌注组(Dex/Yoh组)、育亨宾预处理+缺血再灌注组(Yoh组)与心肌缺血再灌注组(I/R组),每组15只。Sham组只穿线不结扎。Dex组右颈静脉持续泵注Dex 1μg/kg,10 min+0.7μg/(kg·h),15 min后制备模型。Dex/Yoh组经右颈静脉持续泵注育亨宾1 mg/kg(kg·h) 15 min+0.5 mg/kg(kg·h)20 min。完成5 min 后给予Dex 1 μg/kg 10 min+0.7 μg/(kg·h) 15 min后制备模型。Yoh组经颈静脉持续泵注育亨宾1 mg/kg 5 min+0.5 mg/(kg·h)20 min后制备模型。I/R组直接制备MIRI模型。 1.2.3 心肌梗死面积检测 (1)于再灌注结束时,将左冠状动脉前降支的结扎线重新结扎,待确定结扎确切后,经右颈静脉快速注射2 mL 2%伊文氏蓝,使正常心肌组织(蓝色)和缺血危险区心肌组织(未着色)显色充分。(2)肉眼观察缺血危险区显示清楚后迅速摘取心脏,用冰冻0.9%氯化钠溶液在冰上冲洗后剪除心房及多余的结缔组织,在-80 ℃冰箱中冰冻15 min,沿左室长轴切成5 片约2 mm厚的薄片。(3)将切好的心肌组织薄片置于装满1%氯化三苯基四氮唑(TTC)溶液的6孔板中,使心肌组织充分浸于溶液中。于37 ℃温箱中孵育15~30 min取出,用4%多聚甲醛溶液固定。(4)用照相机拍照,在图片中正常的心肌组织为蓝色,缺血危险区的心肌组织呈红色,梗死的心肌组织呈苍白色。通过相应软件计算心肌梗死面积,心肌梗死面积=缺血梗死区域苍白色的心肌组织/缺血危险区红色的心肌组织(IS/AAR)。 1.2.4 ELISA检测大鼠心肌组织、血清TNF-α、IL-6浓度 (1)将5 μL 240、120、60、30、15、7.5 ng/mL的标准品依次加入标准品孔中,将50 μL待檢测大鼠心肌组织和血清样本提取液加入样品孔中,空白孔加双蒸水;(2)将50 μL HRP试剂分别加入标准品孔、样品孔中;(3)以轻柔的动作摇晃,将封板膜盖上,在37 ℃恒温箱中进行1 h孵育;(4)将封板膜小心揭掉,将孔内液体弃去。甩干后将300 μL洗涤液加入每孔中,30 s静置后弃去,重复5次后将孔内液体拍干; (5)将50 μL显色剂A、B加入每孔中,振荡混匀,在37 ℃恒温箱中10 min避光孵育;(6)将50 μL终止液加入每孔中;(7)空白孔凋零,在450 nm波长处对各孔OD值进行测量;(8)依据标准品OD值、浓度将标准曲线绘制出来,进而将样品浓度计算出来。 1.2.5 Western blot检测HMGB1、TLR-4、MyD88、NF-κB蛋白表达 组织块称重;利用液氮、研钵粉碎组织块;加入RIPA缓冲液(每克组织3 mL RIPA),PMSF(每克组织30 μL,10 mg/mL PMSF),利用Polytron进一步匀浆(15 000 r/min,1 min)维持4 ℃;加入PMSF(每克组织30 μL 10 mg/mL PMSF),冰上孵育30 min;移入离心管,4 ℃, 15 000 r/min,15 min离心;上清液为细胞裂解液,分装-20 ℃保存;取相同质量的细胞裂解液(体积×蛋白质浓度),并加等体积的2×电泳加样缓冲液;沸水浴3 min。把聚丙烯酰胺凝胶中的蛋白质电泳转移到硝酸纤维膜上。转移缓冲液洗涤凝胶和硝酸纤维素膜,将硝酸纤维素膜铺在凝胶上,用5 mL移液管在凝胶上来回滚动去除所有的气泡。在凝胶和滤膜外再包一张3 mm滤纸(预先用转移缓冲液浸湿),将凝胶夹在中间,保持湿润和没有气泡。将滤纸、凝胶、薄膜、滤纸按照厂家建议方法放入电泳装置中,凝胶面向阴极。将上述装置放入缓冲液槽中,并灌满转移缓冲液以淹没凝胶。按照厂家所示接通电源开始电泳转移。转移结束后,取出薄膜和凝胶,弃去凝胶。将薄膜漂在氨基黑中快速染色,直至分子量标准显现时取出,记录下标准位置。用100 mL水洗涤纤维素膜,必要时可用脱色缓冲液。膜置印迹缓冲液中于37 ℃保温1 h。室温下,用PBS-Tween缓冲液洗涤薄膜。用封口机将薄膜封入塑料袋中,尽可能不留空气。5%脱脂奶加在装薄膜的袋中,于室温封闭1h。用总体积300 mL PBS-Tween缓冲液,分4次在一浅盘中洗涤薄膜,每次75 mL。将稀释好的一抗加在袋内,于4 ℃孵育过夜。洗涤后加入HRP标记的二抗,于室温下摇动2 h。洗涤后将等体积A液和B液加在膜蛋白面上并摇晃使其混合,1 min后去尽残液,将膜蛋白面朝上放入荧光化学发光成像系统中进行显影和拍照,用凝胶成像处理系统进行分析。 1.3 统计学处理 采用SPSS 21.0软件对所得数据进行统计分析,计量资料用(x±s)表示,比较采用t检验;计数资料以率(%)表示,比较采用字2检验。以P<0.05为差异有统计学意义。 2 结果 2.1 各组心肌组织与血清炎性指标比较 Dex组、Dex/Yoh组、Yoh组及I/R组心肌组织与血清TNF-α、IL-6水平均高于Sham组,其中Dex组 2.2 各组心肌梗死面积比较 Dex组(27.2±1.0)%、Dex/Yoh组(43.2±3.3)%、Yoh组(50.5±5.4)%及I/R组(55.3±6.6)%的IS/ARR均高于Sham组(0),其中Dex组 2.3 各组心肌组织HMGB1、TLR-4、MyD88、NF-κB蛋白表达量比较 Dex组、Dex/Yoh组、Yoh组及I/R组心肌组织HMGB1、TLR-4、MyD88、NF-κB蛋白表达量均高于Sham组,其中Dex组 3 讨论 Dex为高效、高选择性的α2肾上腺素能受体激动剂,一方面不会对呼吸造成抑制,另一方面还能够将抗焦虑、镇痛、镇静作用发挥出来[3-6]。Dex在重症监护病房围术期得到了广泛应用,它能够对应激反应进行有效抑制,促进心率、血压的降低,对氧供需平衡进行改善,用于冠心病患者围术期心肌保护[7-12]。通过缺血预处理和缺血后处理可减轻小鼠心肌缺陷再灌注损伤,在MIRI前应用Dex保护心肌的具体机制尚未阐明,有研究指出,可能经过预处理将相关促存活信息传导激活,比如 Ras-MEK1/2、PI3K/Akt等信号通路,促进下游信号蛋白级联反应的发生,发挥心脏保护作用[13-20]。本研究结果显示,Dex组、Dex/Yoh组、Yoh组及I/R组心肌组织与血清TNF-α、IL-6水平均高于Sham组,其中Dex组 综上所述,右美托咪定能够减轻心肌缺血再灌注损伤大鼠炎症反应,减少心肌梗死面积,途径可能为抑制HMGB1/TLR4/NF-κB信号通路。 参考文献 [1]张世平,王臻,金梅梅,等.右美托咪定对糖尿病大鼠心肌缺血再灌注损伤的保护机制[J].解放军医药杂志,2018,30(7):7-11. [2]黎仕煥,李繁,黄奕弟.右美托咪定联合咪达唑仑对心肌缺血再灌注损伤大鼠的心肌保护作用研究[J].临床误诊误治,2019,32(10):103-108. [3]李红霞,翁亦齐,喻文立,等.右美托咪定对大鼠肝脏冷缺血再灌注诱发心肌损伤的保护作用[J].中华器官移植杂志,2019,40(6):374-378. [4]夏凡,嵇富海,张娟,等.右美托咪定预处理通过迷走神经减轻大鼠心肌缺血/再灌注损伤[J].国际麻醉学与复苏杂志,2017,38(12):1068-1072. [5]刘军,董友靖.右美托咪定对心肌缺血-再灌注损伤大鼠的心肌保护作用及机制[J].临床和实验医学杂志,2018,17(23):2476-2479. [6]陈海明,杨玲,薛凯凯.右美托咪定中枢远端干预对大鼠心肌缺血再灌注损伤的影响[J].山西医科大学学报,2019,50(5):533-536. [7]党旭云,蔚俊星,李静.右美托咪定对缺血再灌注损伤大鼠心肌VEGF表达的影响[J].山西医科大学学报,2015,46(10):959-961. [8]杨玲,程桥,杨春艳,等.预先鞘内注射右美托咪定对大鼠心肌缺血再灌注损伤的影响[J].中华麻醉学杂志,2018,38(3):304-307. [9]张世平,沈鑫,李会玲,等.右美托咪定预处理对糖尿病大鼠心肌缺血-再灌注损伤的作用和机制[J].临床麻醉学杂志,2018,34(7):707-711. [10]李超,朱康生,申军梅,等.mito-KATP通道在右美托咪定减轻大鼠心肌缺血再灌注损伤中的作用[J].中华麻醉学杂志,2017,37(11):1318-1321. [11]胡静,谷小雨,孟炎,等.右美托咪定后处理对糖尿病大鼠心肌缺血再灌注损伤及炎症反应的影响[J].南方医科大学学报,2017,37(11):1506-1511. [12]汪欢,郭志祥.右美托咪定后处理联合肢体缺血后处理对大鼠心肌缺血再灌注损伤的影响[J].中华麻醉学杂志,2016,36(5):559-562. [13]李红霞,翁亦齐,喻文立,等.右美托咪定预先给药对肝缺血再灌注致大鼠心肌损伤时JAK/STAT信号通路的影响[J].中华麻醉学杂志,2019,39(1):44-47. [14]刘亚兵,郭政,郭建丽,等.内源性神经肽对大鼠心肌缺血再灌注引起心肌损伤的影响[J].中国现代医生,2013,51(12):15-17. [15]袁梦,王丙琼,丁明.磷酸肌酸钠对大鼠肢体缺血再灌注心肌损伤的影响[J].中国现代医生,2014,52(1):1-3,封3. [16] Xu Z,Wang D,Zhou Z,et al.Dexmedetomidine Attenuates Renal and Myocardial Ischemia/Reperfusion Injury in a Dose-Dependent Manner by Inhibiting Inflammatory Response[J].Ann Clin Lab Sci,2019,49(1):31-35. [17] Bunte S,Behmenburg F,Majewski N,et al.Characteristics of Dexmedetomidine Postconditioning in the Field of Myocardial Ischemia-Reperfusion Injury[J].Anesth Analg,2020,130(1):90-98. [18] Du J,Xu Z,Zhen J,et al.Dexmedetomidine attenuates myocardial ischemia/reperfusion injury through regulating lactate signaling cascade in mice[J].Eur Rev Med Pharmacol Sci,2019,23(8):3527-3532. [19] Zhang J,Jiang H,Liu D H,et al.Effects of dexmedetomidine on myocardial ischemia-reperfusion injury through PI3K-Akt-mTOR signaling pathway[J].Eur Rev Med Pharmacol Sci,2019,23(15):6736-6743. [20] Ren J,Li C,Liu Y,et al.Protective effect of dexmedetomidine against myocardial ischemia-reperfusion injury in rabbits[J].Acta Cir Bras,2018,33(1):22-30. (收稿日期:2020-06-22) (本文編辑:田婧)

