四氯化碳诱导的肝纤维化小鼠肝组织和HSC-T6细胞NOX4基因及其蛋白表达的变化*
彭 婕,李弼民,雷宇鹏
还原型辅酶烟酰胺腺嘌呤二核苷酸磷酸氧化酶家族(nicotinamide adenine dinucleotide phosphate oxidase,NOX)是一类产活性氧簇(reactive oxygen species,ROS)的功能酶,肝组织ROS主要来源于NOX4[1-3]。在肝纤维化的发生发展过程中,ROS可介导HSC活化和多种促纤维化因子的激活[4,5]。研究显示, NOX1和NOX4的共同抑制剂GKT137831可减轻肝纤维化大鼠体内ROS生成量和肝纤维化程度,提示NOX4可能参与了肝纤维化的发生发展过程[6]。本研究观察了不同肝组织NOX4水平情况,同时利用siRNA技术构建了低表达NOX4的HSC-T6细胞,探讨了NOX4对HSC-T6细胞增殖、凋亡和纤维化相关通路的影响。
1 材料与方法
1.1 动物与试剂 SPF级雄性C57BL/6J小鼠,6~8周龄,体质量为18~22 g,购自上海邦耀生物科技有限公司【动物许可证号为SCXK(沪)2019-0050】。鼠系肝星状细胞HSC-T6细胞购自美国ATCC。CCl4(天津泰泽兴业生物),脂质体2000试剂盒(美国Invitrogen),基因序列和siRNA干扰序列(上海美轩生物),抗NOX4、抗α平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、抗I 型胶原(collagen I,Col1a I)、抗组织金属蛋白酶抑制剂1(tissue inhibitor of metalloproteinase-1,TIMP-1)、抗金属蛋白酶2(metalloproteinase -2,MMP-2)、抗转化生长因子β1(transforming growth factor-β1,TGF-β1)、抗Smad2、抗p-Smad2、抗Smad3和抗p-Smad3蛋白(美国Cell Signaling),DCFH-DA荧光探针和MTT粉末(上海恒斐生物),Annexin V-FIFC/PI试剂盒(上海泽叶生物)。
1.2 肝纤维化动物模型的制备 将小鼠随机分为对照组10只和模型组10只,分别给予等体积橄榄油或10% CCl4(CCl4:橄榄油体积比=1∶9)腹腔注射, 2次/w,注射6 w,构建肝纤维化模型。在最后一次注射24 h后,处死动物,迅速取出小鼠肝脏,部分固定于甲醛溶液中,制成组织切片,经脱蜡、切片,常规行HE染色和Masson染色,光镜下观察。将剩余的肝组织冻存于液氮罐中。
1.3 细胞培养、分组与转染 正常培养HSC-T6细胞,待细胞生长至对数生长期时,消化细胞、传代。取生长状态良好的细胞,接种于6孔板,分为对照组、无意义对照组和NOX4-siRNA干预组。在后两组,分别转染无意义序列或NOX4-siRNA,构建低表达NOX4的细胞株。
1.4 肝组织和细胞NOX4 mRNA水平检测 用Trizol试剂提取组织和细胞总RNA,再逆转录合成cDNA模板,采用qRT-PCR法检测NOX4 mRNA水平。NOX4上游引物序列为:CAGGAGG GCTG CTGAAGTATCAA,下游引物序列为:TGACTGGCTTATTGCTCCGGATA;内参GADPH上游引物序列为:ATGTTCCAGTATGACTCCACTCACG,下游引物序列为:GAAGACACCAGTAGACTCCACGACA[7]。反应参数为94℃预变性5 min、94℃变性60 s、68℃退火60 s、72℃延伸60 s,共30个循环。以GADPH为内参,采用2-△△CT法计算样品NOX4 mRNA相对水平。
1.5 肝组织和细胞NOX4 表达检测 采用Western blot法检测,采用RIPA法提取组织和细胞蛋白,检测蛋白浓度后,取蛋白50~100 μg,行凝胶电泳分离,待标记物移动至底部前终止电泳。将凝胶切成适宜大小、转膜,再行免疫反应,最后进行ECL显影。采集蛋白条带图片,应用Image J软件行灰度分析,以β-actin为内参,计算NOX4、α-SMA、Col1a I、TIMP-1、MMP-2、TGF-β1、Smad2、p-Smad2、Smad3和p-Smad3相对表达量。
1.6 细胞ROS含量检测 将各组细胞接种于6孔板,培养24 h,用无糖培养基饥饿细胞12 h,加入DCFH-DA荧光探针,继续孵育30 min,于荧光酶标仪检测细胞荧光量。
1.7 细胞增殖检测 采用MTT法,取各组细胞1×105/mL,接种于96孔板,培养24 h、48 h、72 h,分别加入含10%MTT的PBS缓冲液,继续孵育4 h,再加入DMSO 150 μL,于570 nm处检测各孔吸光度值(OD值)。
1.8 细胞周期和凋亡检测 制备细胞悬液,经预冷的PBS清洗后,在70%乙醇中固定1 h,加入PI染液重悬细胞,上流式细胞仪(美国BD)检测细胞周期的变化;加入Annexin V避光下孵育细胞15 min,上流式细胞仪检测细胞凋亡情况。
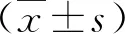
2 结果
2.1 两组小鼠肝组织NOX4 mRNA水平比较 与对照组比,模型组小鼠肝组织NOX4 mRNA和蛋白水平均显著上升(P<0.05,图1)。
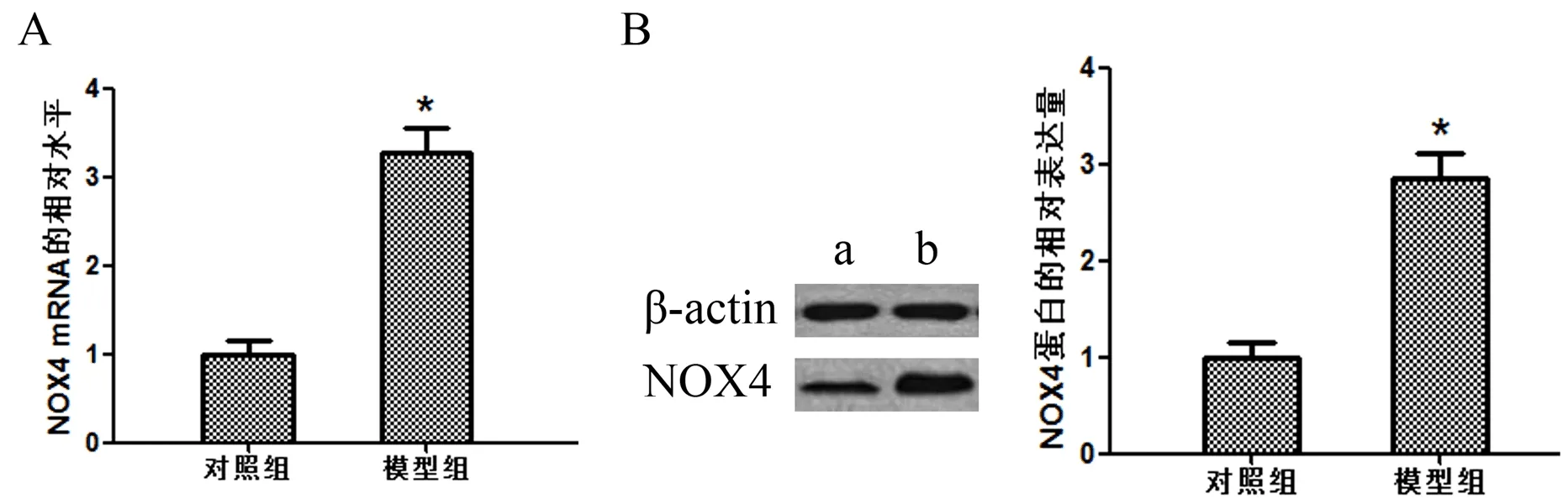
图1 两组小鼠肝组织NOX4水平变化
2.2 三组HSC-T6细胞NOX4和ROS水平比较 NOX4-siRNA处理组NOX4 mRNA及其蛋白和ROS水平显著低于对照组(P<0.05),但对照组与无意对照组NOX4 mRNA及其蛋白和ROS水平比较,差异无统计学意义(P>0.05,图2)。
图2 三组HSC-T6细胞NOX4和ROS水平比较
2.3 三组HSC-T6细胞增殖能力比较 NOX4-siRNA干预组细胞增殖活性和S期细胞比例显著低于对照组,而G0/G1期细胞比例显著高于对照组(P<0.05);对照组与无意组细胞增殖活性和各周期细胞比例比较,差异无统计学意义(P>0.05,图3)。

图3 三组HSC-T6细胞增殖能力比较
2.4 三组HSC-T6细胞凋亡水平比较 NOX4-siRNA处理组细胞凋亡率显著高于对照组(P<0.05),但对照组与无意组细胞凋亡率比较,差异无统计学意义(P>0.05,图4)。
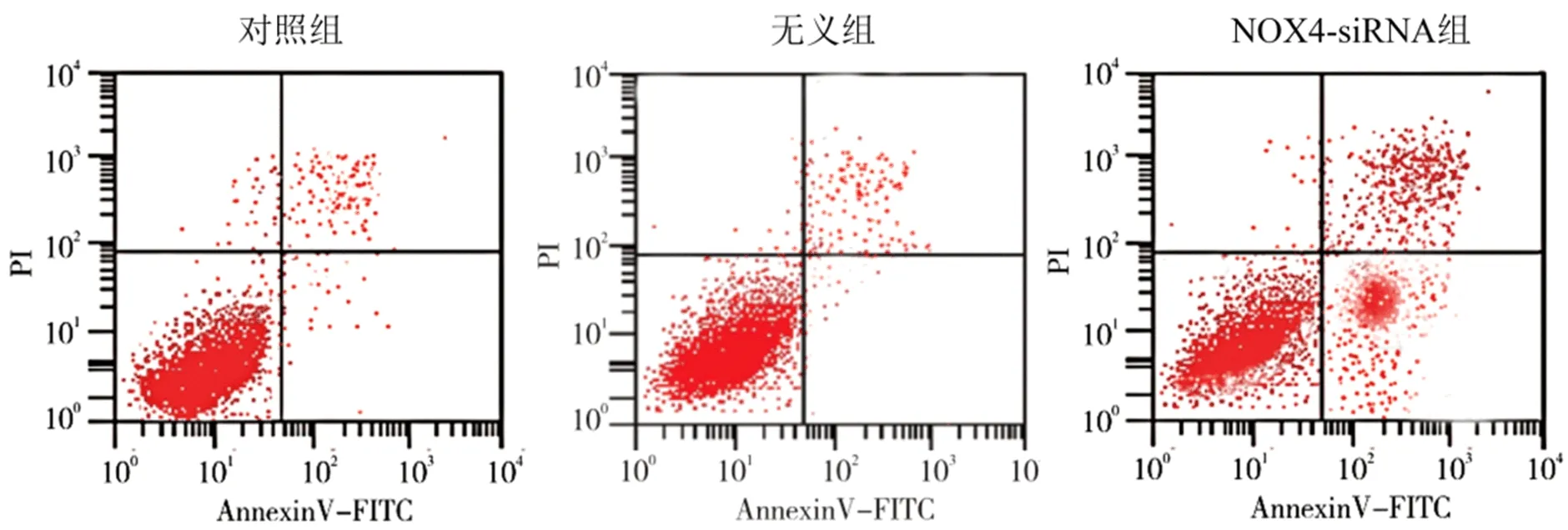
图4 三组HSC-T6细胞凋亡水平比较
2.5 三组HSC-T6细胞纤维化相关蛋白表达量比较 NOX4-siRNA处理组α-SMA、Col1a I、TIMP-1、MMP-2、TGF-β1、p-Smad2/Smad2、p-Smad3/Smad3表达水平显著低于对照组(P<0.05),而对照组与无意组上述蛋白表达量比较,差异无统计学意义(P>0.05,图5)。
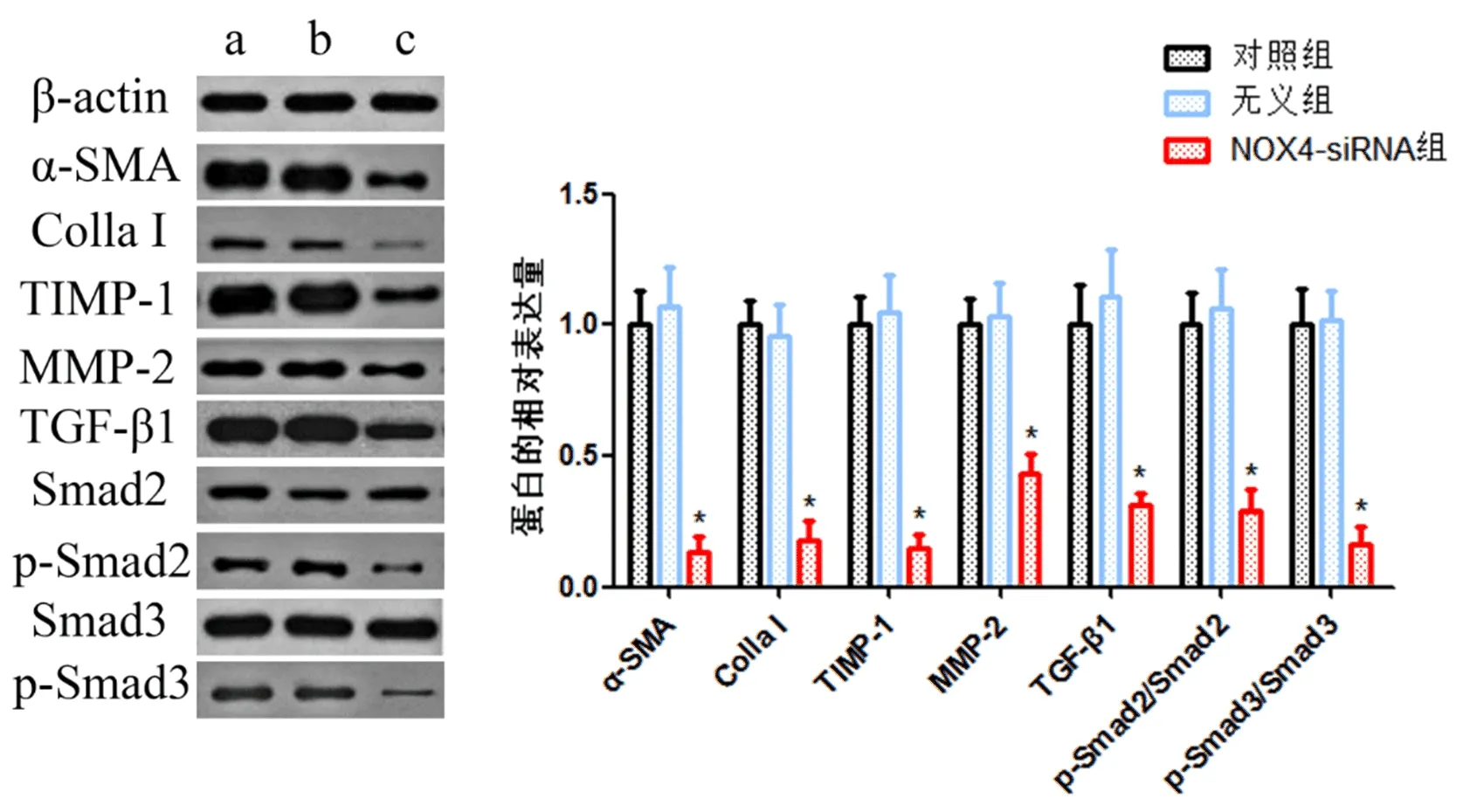
图5 三组HSC-T6细胞纤维化相关分子表达水平比较
3 讨论
在肝细胞受到损伤刺激时,NOX能诱导ROS促进HSC的活化,从而导致肝损伤及肝纤维化。同时,ROS水平上升也提高了机体氧化应激水平,进一步损伤肝细胞结构和功能[8]。另外,大量数据显示,NOX4生成的ROS能间接损伤蛋白质、DNA、类脂等物质,从而调节细胞增殖和凋亡[9,10]。研究指出, HSC胞内NOX4呈高水平,且高于NOX家族其他酶类,提示NOX4可能具有特异性功能,参与HSC的激活过程[11]。因此,有人推测NOX4在肝纤维化发生发展过程有重要的作用,可能作为控制肝纤维化的新靶点。
本研究组织病理学观察结果显示,模型小鼠肝组织出现明显的病理学损伤,且沉积有大量胶原纤维,符合肝纤维化的病理学特征,提示肝纤维化模型制备成功。同时,肝组织NOX4水平的检测结果显示,肝纤维化组织NOX4 mRNA及其蛋白水平均升高,提示NOX4在肝纤维化发生发展进程中有重要的作用,与有关研究[12]结果相符。
近年来研究发现,肝硬化是可以逆转的,而HSC的凋亡在逆转过程中有重要作用[13]。在正常生理状况下,HSC为静止状态。当受到外界因素刺激后会激活HSC,生成大量的纤维组织成分,增加细胞外基质。在肝纤维化恢复阶段,HSC活化水平下降,且大量凋亡[14,15]。本研究结果显示,沉默HSC-T6细胞NOX4表达,HSC-T6细胞的增殖受到明显的抑制,大量细胞停滞于G0/G1期,且细胞凋亡率明显增加,提示下调NOX4能抑制HSC-T6细胞增殖,促进其凋亡,从而抑制肝纤维化发展。所以,可以反推因为NOX活化,合成大量的ROS,能促进HSCs的异常增殖,从而产生大量的胶原物质并沉积,促进肝纤维化的形成。
此外,在肝纤维化过程中有多种细胞、蛋白及其细胞因子的参与。α-SMA、Col1a I和TIMP-1是重要的促纤维化因子[16,17]。本研究显示,下调NOX4的HSC-T6细胞α-SMA、Col1a I和TIMP-1水平显著降低,提示NOX4可能调控上述促纤维化因子的生成,从而参与肝纤维化的发生发展。研究证实,TGF-β /Smad通路在肝纤维化形成过程中有重要的调控作用,TGF-β1与细胞膜受体结合后活化,诱导Smad3等因子进入细胞核进行基因调控。本研究发现,下调NOX4的HSC-T6细胞TGF-β1、Smad2 和Smad3 磷酸化水平显著下降,表明HSC-T6细胞NOX4可以激活TGF-β /Smad信号通路,可能是NOX4参与肝纤维化的发生机制之一。

