支气管肺发育不良诊断标准的研究进展
李睿雯综述 史 源审校
重庆医科大学附属儿童医院新生儿科/儿科研究所 儿童发育疾病研究教育部重点实验室国家儿童健康与疾病临床医学研究中心 儿童发育重大疾病国家国际科技合作基地儿科学重庆市重点实验室(重庆 400014)
支气管肺发育不良(bronchopulmonary dysplasia,BPD)是早产儿常见的呼吸系统疾病,是由多种因素、多种机制引起的慢性肺疾病。近30 年来,随着围生医学的发展,极早产儿及超早产儿存活率显著提高,BPD发病率有上升趋势。由于BPD患儿需要长期氧疗,住院时间长,易出现反复感染、喂养困难及生长发育迟缓等问题,其生活质量及远期预后均不理想[1]。而由于现有的BPD 诊断标准无法可靠地确定以及评估BPD的严重程度,致BPD的临床诊疗无明显进展。本文阐述BPD诊断标准的发展历史及研究进展。
1 “经典型”BPD及其诊断标准
BPD 是1967 年由 Northway 等[2]首次报道并命名的一种具有独特的临床、组织学及影像学特征的早产儿常见的慢性呼吸系统疾病,又称新生儿慢性肺病。在20 世纪70 年代,Northway 等提出最早的BPD 诊断标准,即有机械通气史,持续氧依赖至生后28~30 天,胸片可见囊泡影,出现肺不张、肺气肿等异常[2]。其特点总结为:①发生于极早产儿或超早产儿;②出生即有严重呼吸窘迫综合征(respiratory distress syndrome,RDS);③经过积极机械通气治疗、暴露于高浓度氧中;④持续辅助用氧超过28 天;⑤胸部X 片提示存在慢性肺损伤。这种 BPD 又称为“经典型”或“旧”BPD[3],其标准可以体现肺发育不成熟、急性肺损伤以及损伤之后的异常修复等BPD发病的关键机制。在Northwayd 的基础上,1979 年Tooely 等[4]提出了BPD 临床诊断的定义:生后30 天时仍有氧依赖,并存在:①吸入氧浓度(fraction of inspired oxygen,FiO2)>21%;②胸片提示有肺损伤;③血气分析出现二氧化碳分压(partial pressure of carbon dioxide,PaCO2)<60 mmHg 或PaCO2>45 mmHg;以上3 项出现任意1 项即可诊断为BPD。同年,Bancalari等[5]提出更为严格的BPD定义:生后第1 周需机械通气>3 天且给氧>28 天;有慢性肺损伤的临床表现及存在肺影像学的持续病变。60~70年代BPD 诊断主要强调临床及影像学证据提示存在的氧依赖以及肺损伤,具有一定的临床诊断实用意义,在当时被广泛使用。但这些标准建立在RDS 发病基础上,是单一的诊断框架,不能体现对病情严重程度及远期预后的评估。1988年Shennan等[6]为对BPD远期预后进行更好评估,将诊断标准修正为:校正胎龄(postmenstrual age,PMA)36周仍需要持续氧依赖并伴有胸片异常。但是以上这些标准都没有对BPD严重程度进行分级。
2 “新型”BPD出现
近半个世纪,随着围生医学技术的不断发展,尤其是产前激素、生后表面活性物质的应用,和机械通气等技术的进步,极早产儿及超早产儿的生存率显著提升,此时 BPD 的定义及流行病学特征也发生了改变,出现“新型”BPD[7],其临床特征可概括为:①与早期BPD 患儿相比,体质量更低,胎龄多<29 周;②可继发于多种早产儿呼吸系统疾病,不再以RDS为主;③当存在原发疾病时,BPD 患儿的早期症状通常会被原发疾病掩盖或者难以区分,出生时部分患儿无需给氧或仅需要低浓度氧,后逐渐出现氧依赖,PMA>36 周后仍不能停氧;④病理上与“经典型”BPD有本质区别,主要表现为肺泡数目减少及肺部微血管发育不良,严重病例可出现血管及气道重构,而肺泡及气道损伤相对轻,肺纤维化程度低;⑤影像学检查特征不典型,既往经典型 BPD 早期无特殊变化,仅仅出现肺气肿及肺部纹理毛玻璃样改变,胸部 CT 有多发间质性病变和肺气肿、气储留的表现[8-9]。极早产儿存活率的提升、技术手段的革新如新生儿护理和高流量鼻导管等的发展及“新型”BPD 的出现使既往的BPD诊断不再适用,临床需要更新标准以对BPD严重程度及远期预后进行评估。
3 NICHD标准及分度
2000年美国国家儿童和人类发展研究所(National Institute of Child Health and Human Development,NICHD)等机构共同主办了研讨会,形成了对BPD的新共识。2001 年,NICHD 发表共识对BPD 标准进行了进一步更新,用“BPD”代替“CLD”,并提出BPD的严重程度分级标准。新定义为任何氧依赖[吸入氧浓度(fraction of inspired oxygen,FiO2)>21%]>28天的新生儿均可诊断为BPD,而胸部X片不再作为病情严重程度的评估标准;并且基于氧依赖的判断和不同类型的呼吸支持措施,BPD被分为轻、中、重3个程度[10]:吸氧至少28 d,对于出生胎龄<32 周者,在PMA 36周或出院时进行评估;出生胎龄≥32周者生后56天或出院时评估:①不需吸氧者为轻度;②需吸氧,FiO2<0.30为中度;③需吸氧,FiO2≥0.30或需正压通气者为重度,2001 NICHD 诊断标准到目前仍被广泛使用。
其后,针对BPD 的诊断及分级的讨论从未中断,2003 年Walsh 还提出了BPD 的“生理学定义”,补充了对氧依赖的进一步界定:FiO2>30%时可以确定为BPD,而对FiO2<30%作为不确定BPD。对于后者应做“空气挑战测试”,通过空气吸入维持基本的血氧饱和度(oxygen saturation,SaO2)指标,若维持时间<60分钟,可诊断为BPD[11]。2015 年,Poindexter 一项大型、多中心的PROP观察性队列研究[12],采用了1988 Shennan、2001 NICHD以及2004“生理学定义”对765例早产儿进行分组评估,三个标准下早产儿BPD发生率分别为40.8%、58.6%和32.0%,差异显著,对肺发育远期结局的预测价值均不高[13],而不依赖影像学诊断,则会出现与其他呼吸系统疾病难以鉴别,对远期结局预测缺乏特异性[14-15];采用PMA 36周进行评估,但36周并非肺完全成熟的时期,在广泛高流量鼻导管吸氧的基础上,采用40周PMA与36周PMA的结果差异同样颇大[16-17]。因此现有的BPD 标准仍不能对早产儿进行充分分类,以此为基础进行BPD 研究,不论是发病机制还是治疗,都无法得到有效提升。
4 Rosemary标准
2018 年Rosemary 等修改并更新了2001 NICHD标准,提出了新的BPD 诊断及分级框架,诊断标准为:出生胎龄<32周的早产儿在PMA 36周时仍依赖不同程度的FiO2和呼吸支持手段≥3天,并且有影像学资料证实存在肺间质病变,即可诊断为BPD。此标准考虑到了肺组织病理改变,加入了影像学诊断,在BPD分级时,根据用氧方式及吸氧浓度的不同,用Ⅰ、Ⅱ、Ⅲ级代替之前的轻、中、重度BPD:Ⅰ级为低用氧浓度(<30%)的头罩吸氧、经鼻持续气道正压通气(nasal continuous positive airway pressure,NCPAP),经鼻间歇正压通气(nasal intermittent positive pressure ventilation,NIPPV)或鼻导管吸氧;Ⅱ级为更高用氧浓度的无创通气模式及低用氧浓度(<21%)的有创正压通气模式;Ⅲ级为高用氧浓度(≥21%)的有创正压通气模式及NCPAP、NIPPV ≥3L/min的或鼻导管吸氧模式。以此细分确保临床医师讨论病情或与家属沟通时能采用更客观的分级表达[18](表1)。
2018 Rosemary 的标准的评估时间统一设定为PMA 36 周,增加新的无创辅助通气模式,并将通气方式与不同氧浓度需求紧密联系,将分类细化。2020年,浙江大学一项回顾性研究,将157 例早产儿按照2001 NICHD 标准及2018 Rosemary 标准进行分组比较其差异性,发现符合2018 标准Ⅱ级分度的早产儿总用氧时间、正压通气、气管插管持续时间均明显长于符合2001 NICHD 标准中度分级BPD 患儿,2018 Rosemary标准下的Ⅱ、Ⅲ级BPD患儿的病死率也明显高于符合2001NICHD标准下的中重度BPD患儿,在并发症上,2018 Rosemary 标准下的Ⅲ及ⅢA 度患儿肺动脉高压的发生率又明显高于2001NICHD标准下的重度BPD患儿。考虑2001NICHD标准未纳入的一部分早期因呼吸系统疾病死亡的早产儿可能是其重度BPD的一部分,提出2001NICHD标准存在中重度BPD患儿的漏诊或分度不准确,重度BPD患儿的病死率及并发症率被低估。而2018 Rosemary标准在分度标准能在上述方面弥补2001NICHD标准的不足和局限性[19]。但2018 Rosemary标准的定义中提出了纳入影像学改变,分类时却依然使用氧依赖标准,并未按照影像学指标进行划分,且通气方式分类较多,使用上不够方便简洁。
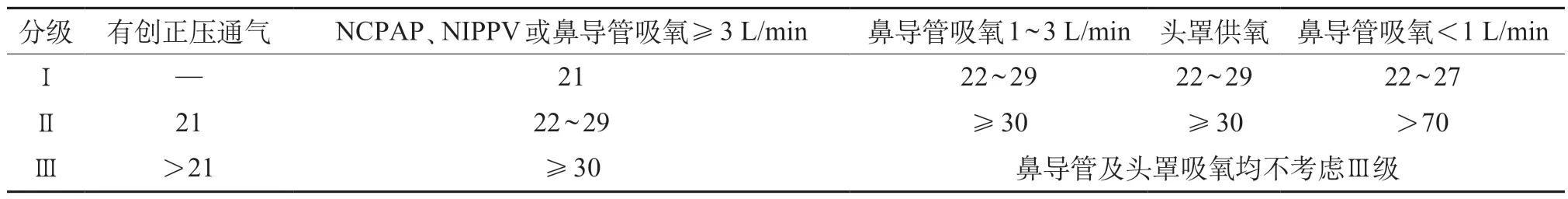
表1 BPD分级2018年Rosemary标准
5 Jensen标准
2019 年,Jensen 等[20]对2001 年NICHD 标准进行修正,通过多中心的2 677 例早产儿分组评估,对不同流量的鼻导管吸氧、有创机械通气和PMA 36 周已停氧等情况定义为不同的BPD 分级,比较18 种修正后的BPD 诊断和分级标准对早产儿远期呼吸结局的预测能力。研究发现,最佳的BDP 分级标准为:不考虑用氧浓度的情况下,如果没有呼吸支持则为无BPD,鼻导管吸氧氧流量≤2 L/min为Ⅰ级BPD,鼻导管吸氧氧流量>2 L/min或无创机械通气支持为Ⅱ级BPD,有创机械通气支持为Ⅲ级BPD。该标准能够预测81%的早产儿死亡和严重呼吸系统并发症的发生(表2)。至今未见2019Jensen标准下远期预后的相关研究。
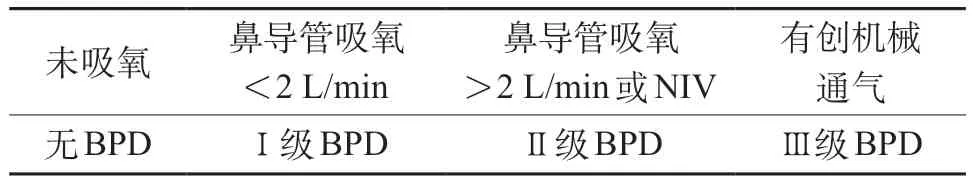
表2 BPD分级2019年Jensen标准
6 优势与不足
经过20 世纪60~80 年代的基础归纳,逐步形成21 世纪以来系统的BPD 诊断标准,现初步总结归纳上述诊断标准,以胎龄<32 周早产儿生后氧依赖第28 天及PMA 36 周为节点进行评估(表3),比较分析2001 NICHD标准、2018 Rosemary标准及2019 Jensen标准的优势及不足。
目前2001NICHD标准仍然是最广泛使用的诊断及分级标准,国内目前的BPD指南也是以2001NICHD标准为标准,其优势为诊断节点早,分型简单、快速,适合国内各地区医疗水平差距较大的现实,可以早期对BPD 患儿进行呼吸管理及药物治疗,但其分型简单,对于用氧浓度及呼吸支持模式划分的欠缺使其对BPD患儿远期结局预测缺乏特异性,对BPD机制及治疗的研究提升有较大的阻碍。2018 Rosemary 标准与2019 Jensen标准与均是在2001NICHD标准之上进行补充和发散,以PMA36周作为诊断及分类的节点,适合统筹研究,且二者均将通气方式与氧浓度结合进行细分,2018 Rosemary 标准强调了机械通气与中重度BPD 患儿之间的关系,并将PMA 36 周内因呼吸衰竭死亡者纳入中重度分类,扩大了BPD 患儿纳入数量,能够弥补2001NICHD标准在中重度BPD患儿分类上的不足和局限性,有利于BPD研究及流行病学数据的完整,但2018标准中呼吸模式及用氧浓度分级维度较多,使用较复杂,在国内,部分发达地区开始使用2018标准,以期更好地进行科研及统计,且2018标准中提出了影像学评估,但标准中未体现影像学分度,属于全面性上的不足。2019Jensen标准在2018标准的基础上放弃使用影像学评估,在呼吸模式的分类上较2018标准更精简,但就流行病学的意义 2018 Rosemary更强,就目前为止,国内临床诊断及流行病学研究,均倾向于应用2018 Rosemar标准[21]。最后,由于此两项标准的应用较2001标准少,相关研究仍然缺乏,其对于BPD 患儿远期预后的评估价值尚需更多随访性资料来检验。

表3 BPD诊断标准比较
在新生儿呼吸支持时,应用无创呼吸支持可以有效减少气管插管和机械通气的发生率以及BPD 发病率已得到广泛共识[22-23]。2018标准将高流量鼻导管吸氧和其他无创通气治疗并列一起,但两者之间在早期治疗早产儿呼吸困难和减少拔管失败的有效性差异上仍存有争议[24-27]。此外,在其他无创通气方式上,1971年开始应用的NCPAP已在世界范围内得到广泛应用。而无创的NIPPV在NCPAP的基础上增加了呼吸支持的力度,减少了呼吸肌疲劳,能达到良好的气体交换,降低发生二氧化碳潴留的风险,结合NCPAP和同步间歇指令通气的特点,被认为是NCPAP 的增强版本。迄今为止,有许多关于NIPPV 和NCPAP 疗效比较的临床随机对照研究和meta分析,主要集中在RDS研究方向。在BPD发生率方面,2013年一项大型多中心随机对照研究表明:与NCPAP相比较,NIPPV并没有有效降低插管率和BPD 发生率[28],但仍存在一些微妙但是重要的差异性,NCPAP 和NIPPV 降低新生儿BPD 发生率是否具有差异性依然有待于进一步的阐明。不同无创通气模式在BPD严重程度上可能存在一定差异性,因此,针对BPD的诊断及分级标准仍需在不断的临床与实验研究中改进与完善。
综上,BPD的诊断和分级标准,均是以BPD患儿给氧模式及用氧浓度为基础,进行严重程度及预后的评估,随着临床诊疗及科研的发展,原有的标准无法满足当前的临床诊疗及科研需要,新提出的标准也有各自的局限性,例如在2018 Rosemary标准中有涉及影像学诊断的标准,却未能就此进行分级描述。因此,针对BPD的诊断及分级标准,其发展方向应在氧浓度分类的基础上,结合如影像学、病理学等多方面的判断标准,形成综合的分级体系。

