介孔二氧化硅用于口服药物增溶的研究进展
吕晓洁,董玉*(1.内蒙古医科大学药学院,呼和浩特 010110;2.内蒙古蒙药药效物质与质量控制工程技术研究中心,呼和浩特 010110)
现代制药技术的主要挑战之一是寻找在作用部位可达有效浓度且方便使用的制剂。口服给药便捷、成本低,最易被患者接受。口服剂型的候选药物最重要的特性是溶解性和肠道透过性,但市场上有40%的药物溶解度很低,新的化学分子更是如此,预计70%~90%的候选药物溶解度较低[1]。在药物传递系统的研究中,难溶性药物的递送一直是个难题,通常采用减小粒径、选择合适晶型、制成前药、成盐、加入表面活性剂、增加在胃肠道中滞留时间和抑制外排及代谢、用亲水性好的辅料包裹(如环糊精、脂质体)或制成固体分散体等方法来增加药物的溶解度或加快药物的溶出速度。近年来,介孔二氧化硅因可有效地改善药物溶解度被重视起来。非晶态二氧化硅由纯无定型二氧化硅组成,被美国食品药品监督管理局(FDA)认为是安全的,可作为口服胶囊,混悬剂,片剂,透皮、直肠和阴道制剂等剂型的赋形剂[2]。Vialpando 等[3]在用几种不同材料制备药物-载体复合物的研究中发现,以介孔二氧化硅为载体的固体分散体表现出了良好的稳定性、较低的水解产物和较高的血药浓度峰值。Bukara 等[4]通过在12 位受试者身上进行的交叉研究观察到,与市售非诺贝特相比,二氧化硅包载的非诺贝特胶囊在人体中吸收速率和程度均大大提高,这成为介孔二氧化硅增加药物溶解度的一个里程碑式成果。
因此,本篇综述对近年来介孔二氧化硅在药物增溶方面的研究进行了归纳分析,涉及材料简介、载药方法、载体性质及其在口服药物增溶中的应用几个方面。
1 介孔二氧化硅材料
介孔硅材料于1992年由Mobil 公司首次合成,是一种孔径介于2 ~50 nm 的多孔材料,由于其结构特殊,在吸附、化学催化、药物递送等方面备受关注。它可以将药物限制在纳米级的尺寸内,抑制药物晶型转化,使药物保持相对易溶的无定型或亚稳定状态,且在相对较高的温度和湿度下保存较长时间仍可以稳定维持[5];其较大的比表面积增加了药物与溶出介质的接触,利于载药体系吸附在胃肠黏膜表面并滞留,促进了药物吸收;较快的溶出使药物在胃肠道中浓度增高,可能使代谢药物的酶饱和,降低药物降解比例,利于药物扩散吸收;硅羟基本身有一定的亲水性,能与-OH、-NH 等末端基团的分子形成分子内氢键,改善药物润湿性,减小接触角,增加溶出速率。此外,硅材料有良好的耐热性、耐pH、耐机械应力和耐水解的能力,口服被认为是无毒和生物相容的,据报道,当口服给药浓度达到5000 mg·kg-1时,仍没有观察到死亡现象[6]。表1列举了常用的介孔硅材料型号及其物理参数,有些已经作为商品上市。
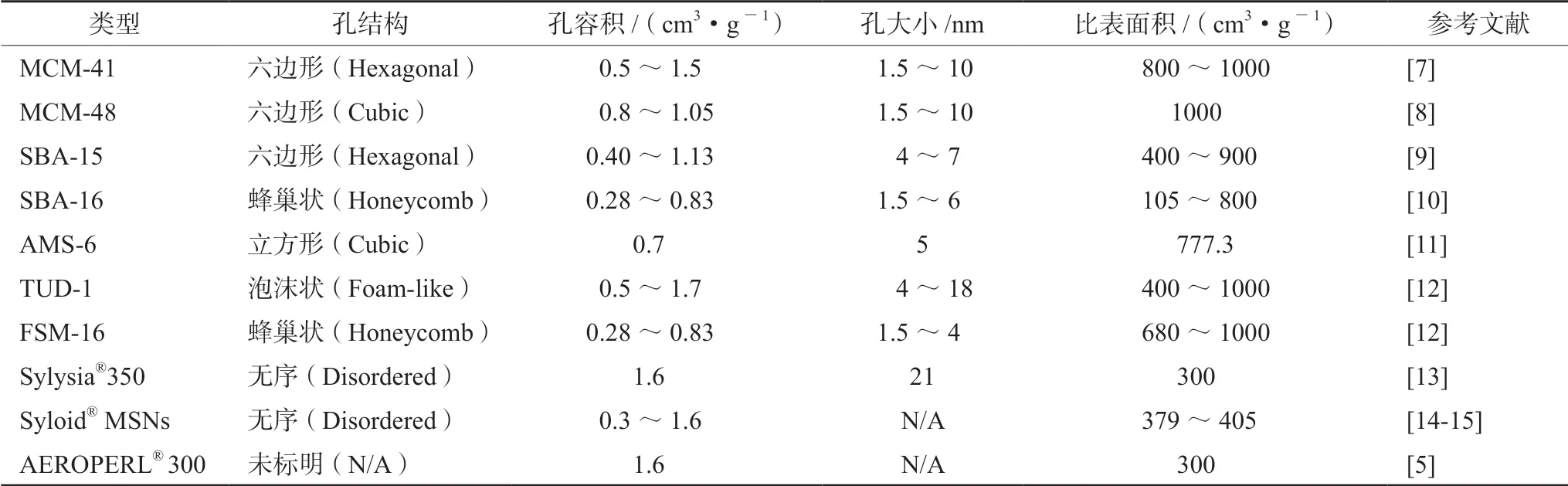
表1 用于增加药物溶解度的介孔硅材料型号及物理参数Tab 1 Type and physical parameter of mesoporous silica materials used to increase solubility
2 常用载药方法及其对药物溶解的影响
将药物负载到介孔二氧化硅材料中的原理都是通过毛细管作用将无定型的药物纳入介孔材料的中孔。载药方法包括溶剂浸渍法、熔融法、超临界流体载药法等,其中溶剂浸渍法最常用。
2.1 溶剂浸渍法
将药物溶于少量溶剂后加入至分散的介孔二氧化硅载体材料中,搅拌充分平衡后,药物进入到二氧化硅中孔或吸附在二氧化硅表面,与二氧化硅共同形成沉淀。在加入药物之前,介孔二氧化硅材料也可以先在真空下搅拌,去除孔道内空气[16]。这一步骤可以反复操作,帮助药物进入更深的孔道而减少表面沉积,达到更高的载药量。分离沉淀可以通过旋转蒸发、直接加热蒸发、烘箱干燥、喷雾干燥或离心等方法来实现。其中,旋转蒸发可以使药物缓慢沉积在载体中,载药量大,耗时短,较常用。喷雾干燥可以迅速蒸发溶剂。一项将非诺贝特负载到介孔二氧化硅上的研究结果表明,喷雾干燥工艺的载药量比溶剂浸渍法更大,且相同的载药量下,制剂的体外溶出也明显优于其他去除溶剂的方法。但也存在溶剂瞬间蒸发药物重新聚集结晶的风险,易造成药物的溶出度不理想[9]。因此最终需要通过实验来确定最适的溶剂去除方法。
使用溶剂浸渍法需要考虑以下几个问题:
第一,载药前需确定溶剂中的最佳药物浓度,如果浓度太高,药物分子会迅速吸附到表面并阻塞中孔,减少载体装载药物的潜在表面积。
第二,要选择合适的溶剂,当药物和溶剂之间有较好的相互作用时,其溶解度较大,载药量高,但须注意溶剂和多孔材料之间的药物亲和力竞争会影响载药量[17]。Soltys 等[18]通过介孔二氧化硅负载一组10 种原料药与6 种不同溶剂在不同浓度范围内组合的研究表明,非极性溶剂通常比极性溶剂的负载效率更高,与药物活性成分(active pharmaceutical ingredients,API)本身性质无关,API 在不同溶剂中的溶解度可以作为载药效率的粗略指标。在极性较高的溶剂中溶解良好的分子需要更高的溶液浓度才能达到与非极性溶剂相当程度的负载。
第三,要考虑溶解的API 在溶剂中的稳定性,避免在装载过程中降解。另外,增溶的原因是非晶化的API 与溶液介质接触面增加的结果,硅羟基吸湿性很强,载药前后需注意空气湿度的影响,只用重量的变化来确定载药量不够可靠,需用更加严格的化学分析方法,用于区分水和原料药对于加载样品重量的贡献。
2.2 熔融法
针对溶剂浸渍法可能带来的药物重结晶、降解或溶剂残留的问题,熔融法是一种较好的替代方法,即将一定比例的药物和载体置于加热系统中,样品被加热到略高于药物的熔化温度,保持一段时间后冷却至室温即可。加热源对固体分散体的性能也有一定影响。Hussain 等[15]用微波加热,将非诺贝特和一系列有序/无序的介孔二氧化硅用熔融法制成固体分散体,观察到药物的体外溶出度显著提高。但该法需将药物加热到高温,这可能会导致活性化合物的热降解,不适用于热敏性药物。
2.3 超临界流体法
超临界二氧化碳具有较低的黏度和较高的扩散系数,有很好的溶剂化效果,且惰性、经济、安全、易得,可用于加工不耐热的药物。二氧化碳超临界流体载药方法也被用于制备介孔二氧化硅的药物模型中[19-20],与传统的溶剂浸渍蒸发法相比,该法取得了可预测的、均匀的药物含量,残留溶剂少、稳定性高,并改善了药物的溶解度和溶出行为。
2.4 其他方法
用流化床法制备的白藜芦醇-介孔硅微粒固体分散体,比用重结晶法制备的固体分散体载药量、溶解度更高,溶出更完全[21]。
布洛芬用共研磨的方式装载于SBA-15 中,该方式对载体结构无明显损伤,载药量可达近40%(wt%)[22],也有研究者尝试用共研磨的方法将芒果苷、蒿甲醚与介孔二氧化硅共载,证实药物通过这样的载药方法也可达无定型[23-24]。但共研磨的方法改变了颗粒的大小,药物可能没有完全进入到载体的中孔道内。
通过电流体雾化技术(EHDA)将一种具有抗肿瘤活性的新型查尔酮(KAZ3)负载到介孔硅的材料中的研究表明,该技术可以在二氧化硅颗粒的孔隙中以完全无定型的形式负载KAZ3,其载药量、保证药物的无定型状态及增加药物溶出的效果均优于溶剂浸渍法[25]。
3 载体性质对药物溶解及释放的影响
3.1 载体大小及形状对药物的影响
Juere 等[26]用不同大小的MCM-48(90、150、300 nm)封装白藜芦醇,评估了载体内孔径(3.5和7 nm)对于药物溶解的影响,结果表明纳米载体的饱和溶解度不仅与载体内孔径有关,还与载体本身大小有关,小尺寸介孔二氧化硅纳米颗粒更有应用潜力。
纳米形状的调整对药物的释放也有影响。Zheng 等[27]制备了具有不同纵横比但表面化学性质相同的介孔二氧化硅纳米球(MSNSs)和介孔二氧化硅纳米棒(MSNRs),结果表明MSNRs表现出较高的细胞摄取比,具有更高的给药效率,纳米颗粒形状的调整可以影响其体内过程。在棒状和球形介孔二氧化硅纳米粒负载吲哚美辛的研究中也发现,棒状介孔二氧化硅纳米粒较大的比表面积和螺旋孔结构使得其负载的药物溶解速度更快,不容易被黏液的网状结构捕获,改善药物口服吸收的效果更好,生物利用度是药物溶液的4.0 倍,是球型介孔材料的2.0 倍[28]。
3.2 载体内孔对药物的影响
载体内孔径大小是影响药物装载与释放的重要因素,但影响因素复杂,根据开尔文方程,较大的孔隙更容易被加载流体接触,较小的孔隙则表现出更强的毛细管作用。内孔径太小限制了药物的进入,进入之后释放也较慢;内孔径太大药物的装载和释放能力均增加,但过大的孔容易使药物在其中重新生成结晶物质。当分子被释放时,吸附的第一个单分子层由于作用力更强,更难解吸,会导致一部分药物残留在载体中[5]。
载体内孔的大小和形状也影响材料的比表面积,大的比表面积是介孔硅成为难溶性药物潜在载体的一个关键特性,增加比表面积可以提高载药量和溶出度[29]。然而,比表面积存在一个阈值,超过这个值,增加比表面积并不会导致药物释放速率的线性增加。
Adrover 等[10]通过对药物分子排列,结合结晶化特征、分子大小、玻璃转换温度、封装药物行为及其释放动力学的描述。研究了MCM-41、MCM-48 和SBA-15 负载不同浓度的阿苯达唑、吲哚美辛和氢化可的松,也证实了载体中孔尺寸确实会限制药物的溶解行为。通过研究不同中孔尺寸、孔容和比表面积的材料负载阿伏苯宗发现,为了使产品在工业上可行,50%的孔体积比较合适。过大(>17 和25 nm)和过小(<3 nm)的孔径易产生结晶,6 ~10 nm 的孔径被认为是理想的。但制剂存在药物与载体分子间作用力较强,药物无法100%释放的现象,需要过量药物补偿不可释放的部分[30]。
Valetti 等[2]通过4种不同粒径、 不同形貌、不通孔径、不同比表面积的颗粒(ASP277、ASP734、NFM-1 和SBA-15)对氯法齐明的装载和溶解研究发现,5 ~20 μm 的颗粒是胃肠道药物释放载体的最佳尺寸,全身摄取和分布的风险最小。该研究显示,溶出动力学随所用载体颗粒不同而明显不同,中等孔径和高比表面积的ASP734 的溶解动力学最快,其次是中等孔径和中等比表面积的SBA-15,较小孔径的NFM-1 或较大孔径的ASP-277 会导致动力学释放较慢。
孔的充填程度,即载药量也是增加溶解度的决定因素。Pardhi 等[31]通过研究不同孔径、孔隙体积和比表面积的多孔硅对氯硝柳胺的增溶发现,所有硅基均能提高药物溶解度,1∶2 载药的溶出度被最大增强。低载药溶出更好,这可能是由于药物在中孔外的再结晶、比表面积和孔体积饱和所致。因此,并不是载药量越大越好,在保证给药量足够的前提下,应寻找最合适的载药量。
3.3 载体表面性质对药物的影响
药物与材料表面硅烷醇基之间的氢键是载药的动力,但材料高表面自由能和表面硅烷醇分子的高反应活性也导致了药物的释放不完全[32]。刘曈等[33]合成了具有均一介孔孔道的载体,用溶剂挥干法载药,根据体外释放结果及数学模型的构建,初步研究了氢键结合受体、载药量与药物释放的关系,得出氢键数目受体、载药量与药物释放的快慢和释放程度相关。这可能是由于载药量较低时,药物分子与载体之间的相互作用力弱,氢键结合差;当载药量增大时,药物分子与载体之间的相互作用力增强,氢键结合力紧密,释放减少,但这一理论还需直接论证证据的支持。
此外,通过调节载体表面亲水/疏水性,可以在不影响载药过程和药物在孔隙中分布的前提下改变药物的释放,增加介孔二氧化硅颗粒的疏水性,可以减少或控制药物的释放量。如氯法齐明分别用亲水性和疏水性介孔二氧化硅装载,发现载体疏水性越强,药物释放越缓慢[34]。
对载体表面进行功能化修饰可以改变药物与二氧化硅之间的吸引力,功能化的方法可以是共缩聚或后嫁接,不同的方法影响官能团所处的位置。
表面功能化通过以下几个方面影响药物的装载和释放:首先,表面功能化可以改变电荷,通过静电作用或者氢键改善药物与载体之间的作用。如利多卡因用于经皮给药时,由于带正电荷的药物和带负电荷的皮肤膜细胞之间的静电作用,氨基功能化的药物释放和皮肤通透性更高[35];其次,通过表面修饰可控制药物释放部位,这一方法在介孔硅靶向给药方面使用广泛。此外,不同种类键的键能不同,造成材料和药物的稳定性不同[36]。
一般认为,氨丙基的存在可以延长药物释放,增加药物的溶解度和生物利用度。介孔二氧化硅材料氨丙基功能化后用聚丙烯酸树脂(Eudradit L100-55)包裹,装载缬沙坦,修饰后的材料在酸性条件下释放量少,可以在胃肠道中提供时滞,之后可达到脉冲释放、长时间持续释放[37]。这一理论在雷洛昔芬[38]、蓓萨罗丁[39]、依托泊苷[40]、吡罗昔康[41]、伏立诺他[42]等药物中也得到了证实。对于吲哚美辛来说,氨基修饰的材料除了有较高的溶出度和生物学效应外,还可减少药物毒副作用[43]。但用MCM-41 与氨丙基功能化的MCM-41 装载双氯芬酸铵在胃肠介质中的释放没有显著性差异[41]。
4 介孔二氧化硅在口服药物增溶中的应用
4.1 介孔硅材料用于化学药物增溶的研究
生物药剂学分类系统(biopharmaceutics classification system,BCS)根据溶解性、渗透性对药物进行了分类,用于指导药物的研发和使用。对于药物增溶的研究多数集中在低溶解、高渗透性的BCSⅡ类药物和低溶解、低渗透性的BCSⅣ类药物。对已上市的产品,低溶解性造成其使用效率非常低,需要较高的给药剂量才能达到有效治疗浓度,这将会引起不必要的不良反应并降低患者的依从性。
很多化学药物作为模型药被用于介孔硅材料的增溶研究,其中多数属于BCS Ⅱ类。有研究分别用SBA-15、MCM-41 装载非诺贝特[9,44],与参考药物晶体相比,SBA-15 修饰的药时曲线下面积(AUC)增加了1.4 倍,生物利用度提高了40%。不同载体对塞来昔布增溶的研究结果显示,与市售药物比较,SBA-15 修饰的药物缓释,硼酸改性的SBA-15 观察到了药物突释。MSN 装载的药物体外溶解度增加了15 倍,体内溶解度增加了1.35 倍[45-46]。布洛芬是常用的BCS Ⅱ类模型药物,将其装载于氨基官能化的介孔二氧化硅纳米棒中载药量更高,表现出了更好的抗炎作用,生物利用度可达203%,这得益于材料在改善布洛芬的溶解性和控制药物释放行为方面的巨大优势[47]。
同属于BCS Ⅱ类药物的尼莫地平用球形手性介孔二氧化硅颗粒负载之后,药物的晶体状态发生了转化,载药后药物溶出度明显提高,比纯的药物释放量提高6.8 倍,相对生物利用度达到386.22%[48]。
一些抗菌药物也被用于介孔二氧化硅的增溶研究中,如溶解度和渗透性均较差的BCS Ⅳ类药物环丙沙星,用SBA-15 装载后溶解度提高了10倍[49]。用MCM-41 和MCM-48 包载氟喹诺酮类抗菌药物诺氟沙星,也观察到了增强其体外溶解度的现象,这对于在给药后需要高的初始药物浓度的应用很有优势[50]。
4.2 介孔硅材料用于中药增溶的研究
将介孔硅作为增溶载体的模型药研究不仅包括化学药,也涉及到中药。对于BCSⅡ类中药单体白藜芦醇的研究显示,用MCM-48 装载提高了药物的饱和溶解度,在体内表现出更强的抗炎活性[26,51]。芹菜素在用MSN 装载后,溶解度提高,生物利用度是原药的8.32 倍[52]。也可以将两种药物共载入同一载体起协同作用,如将青蒿素和甲氯喹用SBA-15 共载,药物表现出溶出增强和过饱和增强作用[53]。
中药单体中有一些疗效较好,但溶解性和渗透性均较差的BCS Ⅳ类药物,如紫杉醇,介孔硅在此类药物中也表现出了较好的溶解、溶出增强作用。紫杉醇用MSN 装载后,AUC是口服药物的7.8 倍[54],用pH 敏感的材料包裹载体,还可以控制药物的释放部位[55]。
用Benzene-MSN-PEG、MSN-NH2、Hydrophobic- MSN 分别装载姜黄素,发现药物在水中浓度增加,小鼠体内溶解、释放和口服生物利用度均增加,生物相容性提高,抗氧化活性提高[56-58]。丹参酮 ⅡA 用MSN 装载时溶解度远高于游离药,AUC是游离药物的2.19 倍[59];用Bio-LB-MSNs 装载时表观原位渗透系数比原药增加了2.5 倍,大鼠口服AUC增加了3.4 倍,体外抗白血病活性增强[60]。
此外,也有用MSN 装载灯盏花素[19]、用SBA-15、Syloid® XDP 3050 silica 装载芒果苷[23,61]及用高度分散的二氧化硅Syloid 244、Syloid AL1提升蒿甲醚[24]等中药单体的溶解度、生物利用度和稳定性的报道。这些研究为BCS Ⅳ类中药单体的进一步应用提供了思路。
4.3 介孔硅材料用于口服制剂增溶的研究
除了上述将药物直接装载于不同种类、不同修饰的介孔二氧化硅中,还有一些研究将介孔硅作为中间体,再进一步制备成可供临床方便使用的剂型,也取得了较好的效果,其中片剂的研究较多。如雷洛昔芬,与原药及已经上市的片剂相比,其累积释放百分比分别增加4.4 和1.6 倍[8]。此外,将芦丁、阿托伐他汀、缬沙坦、水飞蓟宾等用不同型号介孔二氧化硅装载后再制成片剂,溶解度均有明显提高[5,37,62-63]。
将非诺贝特-介孔二氧化硅复合物进一步制成渗透泵型片剂及胶囊,与参比制剂相比,片剂和胶囊生物利用度均显著提高,体内外实验均证实介孔硅材料有良好的增溶效果[64-66]。
将单分散介孔二氧化硅微球作为难溶性药物泼尼松龙的载体,再将其制备成口腔分散膜(ODF),介孔二氧化硅不仅能够改善药物在ODF中的包封率,还有助于调整药物的释放[67]。将帕利哌酮装入二氧化硅中,然后将整个体系进一步以微球的形式封装成聚乳酸和聚乳酸-羟基乙酸共聚物,可以提高药物的体外溶出,延长释放时间。这些研究可以进一步提升该材料商业化前景[68]。
将药物限制在非晶体的状态是介孔硅材料增加药物溶解度的一个重要机制,药物以非晶态存在时,溶解度升高,但在其固有亚稳性的驱动下会再结晶,过饱和的溶液在热力学上是不稳定的,当玻璃固体被引入到水介质中时,由于热力引发沉淀,通常会立即产生瞬间过饱和状态,随后浓度急剧下降,这样可能无法带来生物利用度的增加。因此,一些研究中尝试加入了沉淀抑制剂,如羟丙基醋酸丁二酸甲基纤维素(HPMCAS)[46,69]、聚乙烯己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物[46],这有助于药物溶解后依然保持过饱和状态,维持增加的浓度,确保胃肠道的充分吸收。以药物聚合物混合焓为参数,可以帮助选择最有效的沉淀抑制剂。研究发现,双嘧达莫、非诺贝特和格列苯脲这3 种不同的BCS 分类药物在没有沉淀抑制剂的介孔二氧化硅中沉淀明显,加入不同的沉淀剂表现出向好效果,不同混合焓与整体处方性能之间存在很强的正相关[69]。
5 问题及展望
本课题组近年来进行了介孔二氧化硅的表面修饰、载药及释放、药效等方面的研究,也开展了载体增溶的研究及不同给药方式体内过程的探索。认识到,深入探究介孔二氧化硅药物制剂在体内外的性质和行为,还有很多工作要做。首先,大多数的报道都有药物释放不完全的问题[32],这可能由于介孔二氧化硅材料的可逆性吸附、药物与表面官能团的强烈作用及较小的内孔径导致。其次,制剂的大规模生产存在挑战,如粉末的流动性不好,过度压缩可能堵塞孔径,从而带来药物释放的问题。再次,胃肠道对于口服纳米载体的要求非常苛刻,仍需采用多种方法来促进黏液渗透和跨上皮运输,来克服黏膜和上皮障碍[70]。最后,介孔二氧化硅材料与难溶药物之间的相互关系并不明确,大多数的研究对于药物和材料的选择比较随意,因此在关键材料参数和释放行为之间如何建立可靠的关系仍较困难。难溶性药物在介孔二氧化硅材料载体选择方面还有一定的盲目性。
在过去的十年中,药物-介孔二氧化硅体系在提高药物溶出度和口服生物利用度方面显示出巨大潜力,一方面很多药物用不同的方法与介孔二氧化硅材料制备的剂型,在体内外均观察到了药物溶解和释放的增加,这说明该载体可以作为疏水性药物载体的一种可行方案;另一方面,在重视新型药物传递系统提高难溶性药物溶解度和治疗指数的同时,需要以临床工作为重点,不可忽视其在提高药效和减少毒副作用方面的平衡,该材料在生物相容性及口服毒副作用方面有一定优势。但一项新的技术成为临床可用的药物输送系统,需要长期测试、修改和优化,做到能够精准设计、定位释放、无毒降解,这值得我们进一步探究。

