开颅动脉瘤夹闭术治疗老年颅内破裂动脉瘤预后不良因素分析
孙振武,谢满意,王 强,李中林
(徐州医科大学附属医院神经外科,江苏 徐州 221000)
老年患者动脉瘤性蛛网膜下腔出血(aneurysmal subarachnoid hemorrhage,aSAH)的发生率呈逐年上升趋势[1]。开颅动脉瘤夹闭术曾是治疗动脉瘤的唯一手段。上世纪末,血管内介入治疗兴起,并成为老年aSAH患者的主要治疗方式,但并非所有破裂的动脉瘤都能通过血管内途径治疗[2]。近年来,有研究显示,随访5年后血管内介入治疗和开颅动脉瘤夹闭术的疗效差异并不明显[3],且开颅动脉瘤夹闭术易于到达特殊的血管部位,尤其是对于大脑中动脉M2段动脉瘤合并颅内血肿的患者,开颅动脉瘤夹闭术优于血管内介入治疗。手术器械种类的不断增加以及显微外科技术的不断进步,为外科手术提供了有利的条件,提高了手术质量,传统的外科开颅手术在aSAH治疗中的地位也得到提高[1]。由于介入手术费用相对昂贵,大部分患者更倾向于选择开颅手术,可见开颅动脉瘤夹闭术仍然是颅内破裂动脉瘤常见的治疗手段之一。老年人在不同的国家定义不同,大多数西方发达国家将65岁及以上人群视为老年人[4],我国目前尚无明确限定。老年颅内破裂动脉瘤患者有其自身的特点:①常患有各种慢性基础疾病,如高血压、糖尿病、冠心病等;②发病后病情迅速加重;③常伴有脑动脉粥样硬化狭窄和动脉瘤迂曲复杂;④在动脉瘤急性期易并发大量脑出血,使脑水肿加重,颅内压增高,手术视野不清。因此,老年患者颅内破裂动脉瘤术后的治疗效果往往不理想,需要长时间住院治疗,而术后长期卧床可引起肺部感染、脑梗死或心肌梗死等一系列并发症,给其家庭和社会带来沉重负担[5],且老年患者开颅动脉瘤夹闭术后预后不良直接影响其生活质量。目前国内外对介入栓塞术后不良因素的研究报道相对较多,但尚缺乏对老年颅内破裂动脉瘤开颅夹闭术预后不良影响因素的报道。本研究通过分析65岁以上颅内破裂动脉瘤患者接受开颅动脉瘤夹闭术预后不良的影响因素,以期减少术后并发症发生,改善患者预后,提高其生活质量。
1 资料与方法
1.1 临床资料
回顾性分析2018年9月至2020年3月于徐州医科大学附属医院行开颅动脉瘤夹闭术治疗的92例老年颅内破裂动脉瘤患者的临床资料。其中男23例,女69例;年龄65~86岁,平均(70.48±4.51)岁;动脉瘤直径1.2~11.7 mm,平均(5.02±2.27)mm;术前Hunt-Hess分级Ⅰ级10例,Ⅱ级20例,Ⅲ级36例,Ⅳ级 21例,Ⅴ级5例;术前CT改良Fisher分级0级3例,1级12例,2级38例,3级23例,4级16例;患者合并高血压64例、脑动脉粥样硬化64例、冠心病21例、糖尿病7例。92例患者中共有动脉瘤110个,其中位于颈内动脉35个,大脑中动脉25个,前交通动脉18个,后交通动脉22个,大脑前动脉6个,其他位置4个。
纳入标准:①符合颅内破裂动脉瘤临床诊断标准,且经头颅CTA、MRA、DSA等检查明确诊断后行开颅夹闭手术;②年龄≥65岁;③临床资料完整。排除标准:①诊断为假性动脉瘤、非动脉瘤性蛛网膜下腔出血等其他脑血管疾病;②合并心、肝、肾等重要脏器损伤或恶性肿瘤,预计生存时间<3个月;③不能耐受手术治疗;④合并精神疾病。患者及其家属签署手术知情同意书。
1.2 观察指标及研究方法
根据术中显微镜下吲哚菁绿造影观察动脉瘤夹闭程度,以及术后复查CTA或DSA显示的夹闭程度来判断开颅动脉瘤夹闭术治疗颅内破裂动脉瘤的效果。疗效标准:完全夹闭,夹闭程度100%;大部分夹闭,夹闭程度≥95%;部分夹闭,夹闭程度<95%。术后6个月采用视频电话或门诊复查的方式随访,根据改良Rankin量表(modified Rankin scale,mRS)评分评价患者预后情况,将患者分为预后良好组(mRS 0~2级)和预后不良组(mRS 3~6级)。mRS评价标准:0级,患者无症状;1级,存在轻微症状,但无明显功能障碍,能进行日常活动及工作;2级,不能完成病前所有活动,但能独立照顾自己;3级,日常生活需要一些帮助,但能独立行走;4级,日常生活需要帮助,且不能独立行走;5级,卧床、失禁;6级,死亡。
收集可能影响患者预后的相关因素:性别、年龄;基础疾病,包括高血压、糖尿病、冠心病、脑动脉粥样硬化;动脉瘤相关因素,包括多发性动脉瘤、动脉瘤多次破裂、动脉瘤位置、动脉瘤直径、动脉瘤颈宽度、术前Hunt-Hess分级、术前CT改良Fisher分级等;手术相关因素,包括术中夹闭程度、术后常见并发症(脑梗死、脑积水)、术后低蛋白血症、低钠血症、低钾血症等。采用单因素分析影响患者开颅动脉瘤夹闭术治疗后预后不良的相关因素,多因素Logistic回归分析影响患者开颅动脉瘤夹闭术治疗后预后不良的危险因素。
1.3 统计学方法
采用SPSS 23.0统计软件进行数据分析。计数资料以率(%)表示,组间比较使用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 开颅动脉瘤夹闭术后的临床预后情况
本研究共92例患者,术后6个月发生预后不良46例,预后不良率为50%。110个动脉瘤中,完全夹闭97个(88.18%),大部分夹闭12个(10.91%),部分夹闭1个(0.91%)。可见开颅手术夹闭颅内破裂动脉瘤效果尚好。
2.2 单因素分析影响患者预后不良的相关因素
单因素分析结果显示,2组患者性别、年龄、合并脑动脉粥样硬化、高血压、冠心病、术前Hunt-Hess分级、术前CT改良Fisher分级、术后低蛋白血症、术后脑梗死、术后脑积水比较,差异有统计学意义(P<0.05);2组患者合并糖尿病、动脉瘤位置(除后交通动脉瘤)、动脉瘤直径、动脉瘤颈宽度、多发性动脉瘤、动脉瘤多次破裂、术后低钾血症、术后低钠血症比较,差异无统计学意义(P>0.05),见表1。
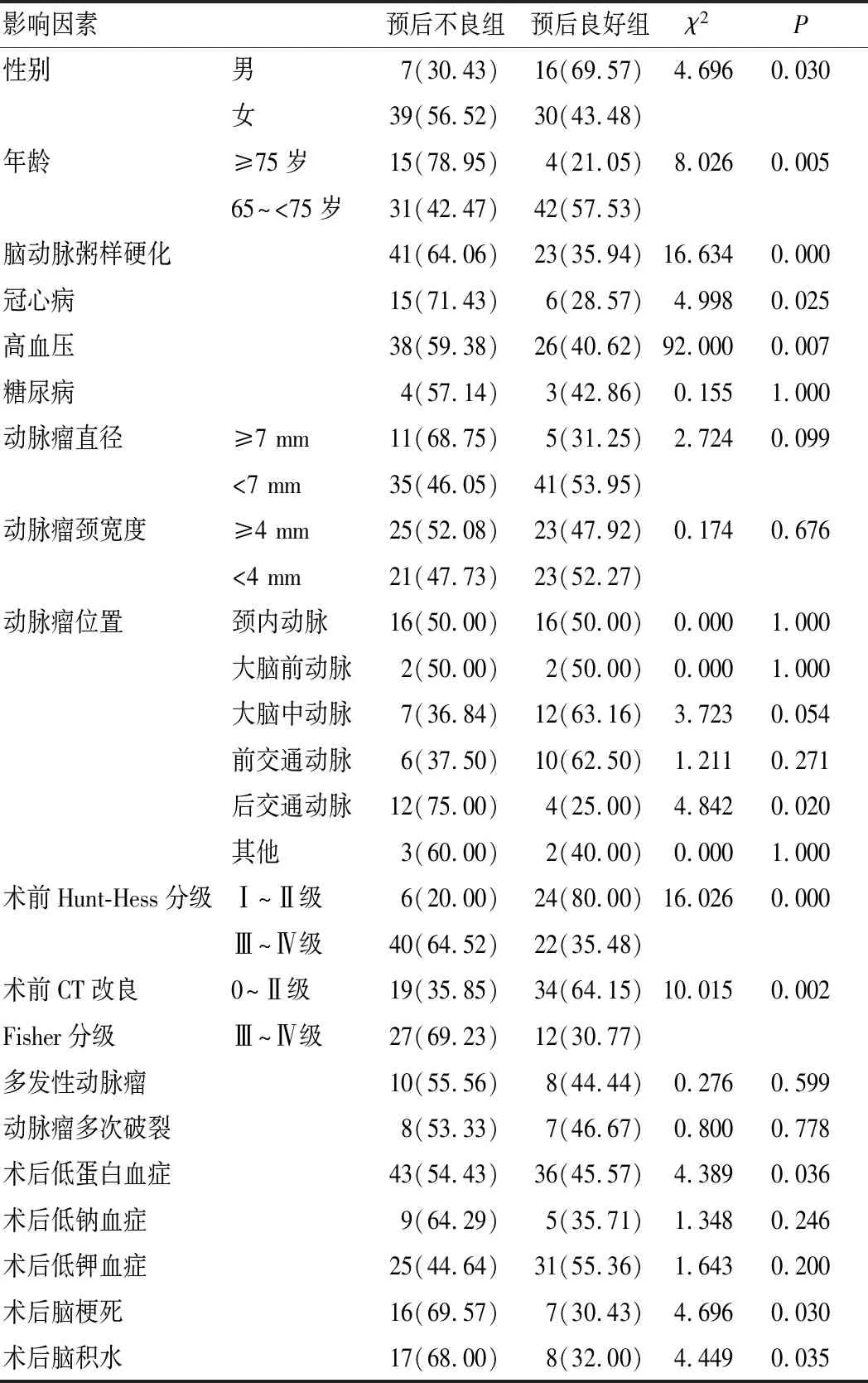
表1 患者预后不良的单因素分析[n=46,例(%)]
2.3 多因素Logistic回归分析影响患者预后不良的危险因素
将单因素分析差异有统计学意义的指标纳入多因素Logistic回归分析,结果显示:合并脑动脉粥样硬化、术前Hunt-Hess分级Ⅲ~Ⅳ级、术后脑梗死是影响老年患者开颅动脉瘤夹闭术后发生预后不良的独立危险因素(P<0.05),见表2。
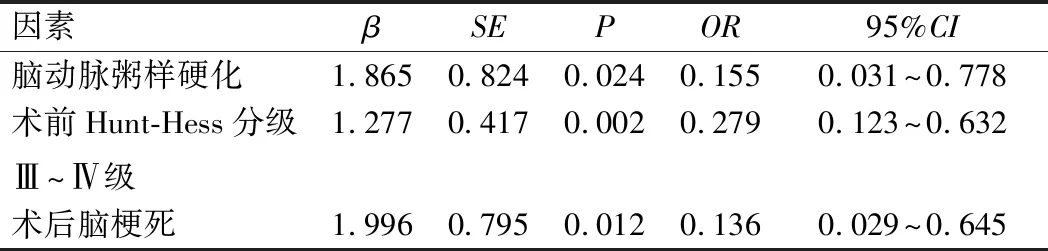
表2 多因素Logistic回归分析结果
3 讨论
颅内动脉瘤是颅内动脉管壁异常隆起形成的血管性囊性包块,其破裂后的致残率及致死率均较高[6]。有研究显示,颅内动脉瘤破裂出血后24~48 h,约10%的患者会出现动脉瘤再次破裂出血,手术治疗后患者病死率约为5.3%[7]。因此,颅内动脉瘤一旦破裂出血可能危及患者生命,早期诊断,采取合适的方法治疗颅内破裂动脉瘤极为重要。开颅动脉瘤夹闭术是治疗颅内破裂动脉瘤的传统手段,尤其适用于动脉瘤破裂合并颅内较大血肿(占位效应)且瘤体较大的患者,以及存在多发性动脉瘤且载瘤动脉解剖位置复杂、介入栓塞手术无法到达位置的患者。术前可根据动脉瘤位置、指向、直径等影像学表现选择恰当的手术入路,术中应在显微镜下清晰辨认载瘤动脉、动脉瘤体及其附近神经纤维结构,提高手术操作的精确性[8-9]。术中对动脉瘤瘤区分离时,应避免过度牵拉脑组织,尽可能减少对脑血管的刺激,以减少术后脑血管痉挛、脑梗死的发生。本研究共110个动脉瘤,完全夹闭97个,大部分夹闭12个,部分夹闭1个。部分夹闭的患者由于动脉瘤位于右侧后交通动脉起始处,位置特殊,手术夹闭困难,未能完全夹闭,采用人工硬脑膜包裹治疗;完全夹闭和大部分夹闭的动脉瘤患者中,大多数仅使用1枚动脉瘤夹,部分患者使用2~3枚动脉瘤夹,实现了动脉瘤瘤颈完全夹闭或大部分夹闭。
老年患者常合并脑动脉粥样硬化、高血压、糖尿病等基础疾病,血管条件较差,钙化严重,加大了术中临时阻断载瘤动脉的难度,增加了术中动脉瘤再次破裂出血的风险。脑动脉粥样硬化的程度由狭窄或闭塞的脑动脉数量及其程度决定[10]。有研究显示,载瘤动脉狭窄程度及狭窄距离是颅内动脉瘤破裂预后不良的危险因素[11]。本研究结果显示,合并脑动脉粥样硬化是老年颅内破裂动脉瘤夹闭术患者近期预后不良的独立危险因素。
长期慢性高血压会引起血管硬化、钙化,增加手术夹闭动脉瘤的难度和风险,围术期血压控制不稳易引起动脉瘤破裂[12]。有研究显示,患者年龄大、合并高血压、术前Hunt-Hess分级Ⅲ~Ⅳ级是影响患者近期预后的独立危险因素[13]。本研究单因素分析结果显示,2组年龄大、合并高血压具有统计学差异,而多因素Logistic分析显示年龄、高血压病史并不是患者近期预后不良的独立危险因素。其原因可能是本研究样本容量太小,且是单中心回顾性病例对照研究,需扩大样本量行多中心、前瞻性研究,验证其可靠性;同时,入院患者大部分意识不清,无法提供详细病史及服药史,导致病历信息记录可能存在偏倚。aSAH病情进展程度与术前Hunt-Hess分级呈正相关,术前Hunt-Hess分级越高的患者,手术疗效及其预后越差,老年颅内动脉瘤患者急性期手术致残、致死的风险也越高,且术后易伴发脑梗死、脑积水等并发症,也更容易出现继发性脑损伤[14-15]。有研究显示,脑梗死是aSAH患者预后不良的独立危险因素,aSAH合并脑梗死发生率为17.6%~58.9%[16],脑梗死患者中有70%是由脑血管痉挛高峰期脑缺血导致[17],脑血管痉挛收缩,使血管管腔狭窄,脑血流量减少,导致脑组织缺氧,增加了脑梗死形成的风险[18]。本研究结果显示,术后脑梗死同样是动脉瘤夹闭术后近期预后不良的独立危险因素,且患者术后合并脑梗死发生率达25%,与之前研究结果类似。为防止术后脑血管痉挛后脑梗死发生,在术中分离载瘤动脉、夹闭动脉瘤时,应操作轻柔,以减少对血管的刺激和不必要的牵拉;保护穿支血管完整,保证引流静脉回流通畅;术野血管予以盐酸罂粟碱稀释液浸泡,减轻血管痉挛;术后给予尼莫地平注射液静脉泵入维持2周后改口服尼莫地平片来缓解血管痉挛。脑梗死对患者预后转归情况影响重大,故应把脑梗死作为老年颅内破裂动脉瘤开颅夹闭术后临床预后转归的重要评估指标之一。
有研究显示,动脉瘤的发生与性别相关,其中女性患者动脉瘤发生率为73%,12%的患者有颅内动脉瘤家族史[19]。本研究结果显示,老年颅内破裂动脉瘤患者中女性患者发病率高于男性,考虑与老年女性患者雌激素水平下降相关。雌激素可影响血管壁中粘多糖的代谢,使血管的通透性降低、脆性增加,雌激素减少则会增加出血风险,雌激素这一特性对脑血管疾病的预防大有好处。雌激素水平下降,脑血管的保护作用减弱,加重了患者脑动脉粥样硬化的进展,但性别因素对患者预后的影响并不明显[20-21]。
有研究显示,颅内动脉瘤接受手术夹闭的患者比接受血管内介入治疗的患者更容易出现分流依赖性脑积水,且恢复更差[22]。患者出现脑积水的原因是动脉瘤破裂出血后蛛网膜下腔中大量血液积聚,血液刺激血管增加了血管痉挛的风险。另外,迟发性的血管痉挛会损害大脑的微循环,导致慢性脑积水发生[23]。本研究单因素分析显示2组脑积水有统计学差异,但脑积水不是老年动脉瘤开颅夹闭术后近期预后不良的独立危险因素,考虑与脑积水患者实施了脑室—腹腔分流术相关。本研究中术后脑积水患者共25例,其中10例患者进行了脑室—腹腔分流术,术后病情较术前明显好转。因此,建议动脉瘤术后合并脑积水患者,应早期实施脑室—腹腔分流术,以改善预后,提高其生活质量。
有研究显示,aSAH患者手术治疗后预后不良与其年龄较大、入院时WFNS评分较差、CT-Fisher分级较高(包括脑室出血和脑出血)、动脉瘤较大、有症状的血管痉挛等因素有关[21]。普遍认为Fisher分级越高,预后越差。本研究单因素分析显示2组CT改良Fisher分级具有统计学差异,但CT改良Fisher分级不是患者近期预后不良的独立危险因素,考虑为样本量小导致结果偏倚。
有研究显示,人血白蛋白是具有脑保护作用的多功能蛋白之一,其脑组织保护机制包括诱发血管内皮细胞释放舒张因子和促进NO合成,抑制中性粒细胞附壁,改善脑损伤区域血液循环,减轻炎症反应,减少微血栓的形成,解除血管痉挛;同时,可减轻脑损伤患者的脑水肿,改善微循环,从而降低患者预后不良的发生率[24]。对重型颅脑外伤的研究结果显示,血清白蛋白水平<25 g/L可明显增加患者的病死率,早期纠正患者的血清白蛋白水平可降低患者脑梗死的发生率及住院期间的病死率[25]。白蛋白可以通过降低脑血管痉挛的发生率从而减少脑梗死的发生,改善患者预后。因此,术后低蛋白血症可能是影响aSAH患者术后脑梗死发生的一项独立危险因素,尚需大量临床研究来证实。
有研究显示,冠状动脉钙化水平与女性颅内动脉瘤高发病率相关,且这种差异仅在老年患者中存在,而在50岁以下的患者中不存在[26]。本研究显示冠心病可能是影响患者预后不良的因素,其原因可能是绝大部分冠心病患者口服抗血小板药物以抑制血小板聚集及凝血过程,导致术中止血困难,增加术后再出血的风险,从而影响预后。
综上所述,合并脑动脉粥样硬化、术前Hunt-Hess分级高、术后脑梗死是影响老年颅内破裂动脉瘤患者开颅夹闭术后近期预后不良的独立危险因素。为改善患者的预后及提高其生活质量,术中操作应轻柔,尽可能减少对血管的刺激,减少术后脑血管痉挛、脑梗死的发生。影响老年颅内破裂动脉瘤患者手术预后不良的因素多且复杂,未来迫切需要多中心随机对照临床研究进一步探讨。

