常规超声联合超声造影检测卵巢甲状腺肿
李海英, 甘 玲, 谢丽君, 刘新秀, 陈 玲, 陈 芳
卵巢甲状腺肿(struma ovarii,SO)是一种少见的单胚层高度特异的卵巢畸胎瘤,约占卵巢畸胎瘤的3%,占卵巢生殖细胞肿瘤的2%,占卵巢肿瘤的0.5%。约5%的SO可发生恶变[1]。研究发现,SO的临床症状及超声表现缺乏特异性[2],术前诊断困难。笔者结合临床病理特征,回顾性分析33例SO的常规超声及其中10例的超声造影(contrast-enhanced ultrasound, CEUS),旨在为临床诊断提供参考。
1 对象与方法
1.1对象 收集2009年10月—2020年1月在笔者医院经病理诊断确诊为SO的患者33例,年龄(45.4±13.4)岁(21~76岁)。纳入标准:经病理检查证实为SO的患者。排除标准:(1)术前未在笔者科室行超声检查;(2)术前未检验血液甲状腺功能水平;(3)术前未检测血液中癌胚抗原(carcinoembryonic antigen,CEA)、甲胎蛋白(alpha fetoprotein,AFP)、糖类抗原199(carbohydrate antigen199,CA199)、糖类抗原125(carbohydrate antigen125,CA125)、人附睾蛋白4(humanepididymisprotein4,HE-4)水平。其中10例患者接受CEUS检查。本研究已通过医院伦理委员会审批,患者均签署接受CEUS检查知情同意书。
1.2仪器与造影剂 彩色多普勒超声诊断仪(iU22型,荷兰Philips公司),具有实时对比脉冲序列造影成像技术,凸阵探头(C5-1,1~5 MHz),腔内探头(3D9-3v,3~9 MHz)。超声造影剂采用声诺维(意大利Bracco公司),用5 mL生理盐水稀释,振荡摇匀制成混悬液,经肘静脉以快速团注法注入声诺维混悬液1.5 mL,继以5 mL生理盐水冲管。
1.3检查方法 首先采用常规超声经腹部或经阴道超声检查,记录病灶的位置、大小、边界,周边关系、内部回声特点(如结节为囊实性,以实性部分与肌层比较判断回声高低),内部血流情况及盆腹腔积液情况。根据病灶回声特点将其分型为单房囊性、多房囊性、囊性为主囊实性(最大切面实性区所占比例<50%)、实性为主囊实性(最大切面实性区所占比例≥50%)和完全实性。少量腹水为仅盆腔内可见无回声区;大量腹水为肝脾周围,盆腔、肠管周围均可见无回声区。CEUS时选取最佳的观察切面,可同时显示部分正常子宫肌层。若因肿块太大无法同时显示子宫切面,其造影剂分两次注射对比观察,连续实时扫查120 s,实时动态观察病灶内造影剂灌注的开始增强时间、增强均匀性和强度等造影增强模式并存留动态图。由2位有多年诊断经验的超声医师反复回放分析病灶造影剂的增强模式并作出诊断。以正常子宫肌层增强回声水平作参考,分为高、等、低增强和无增强。以正常子宫肌层开始增强时间作参考,分为早、同步和迟增强。应用QLAB软件(version 9.1)绘制时间-强度曲线,记录定量参数资料。
1.4国际卵巢肿瘤分析组织(international ovarian tumor analysis,IOTA) IOTA提出简单的标准诊断卵巢良恶性肿瘤[3],根据此规则将纳入组分为良性、恶性和不确定类型。

2 结 果
2.1临床特点 33例中,发现盆腔肿物27例(27/33,81.82%),腹痛3例[3/33(9.09%),1例合并蒂扭转],阴道不规则出血2例(2/33,6.06%),腹胀1例(1/33,3.03%)。单侧发病32例,其中左侧18例,右侧14例,1例为双侧发病,共34个病灶。病理证实SO 33个(其中5个伴囊性变),SO伴滤泡上皮增生活跃1个;单纯型SO 13个、混合型21个。肿瘤指标:仅CA125升高4例,仅CA199升高2例,仅CA125和CA199升高1例,全部指标均阴性26例。血甲状腺功能检查正常30例,仅TSH轻度升高或降低3例。少量腹水12例,大量腹水1例,无腹水20例。
2.2常规超声声像图特征 34个病灶的最长径(7.74±3.90)cm(1.20~19.71 cm)。单房囊性 2个(2/34,5.88%);多房囊性8个(8/34,23.53%);囊性为主囊实性18个(18/34,52.94%,图1,图2A,B);实性为主囊实性5个(5/34,14.71%,图2C);完全实性1个(1/34,2.94%,图3A,B)。病灶超声表现见表1。
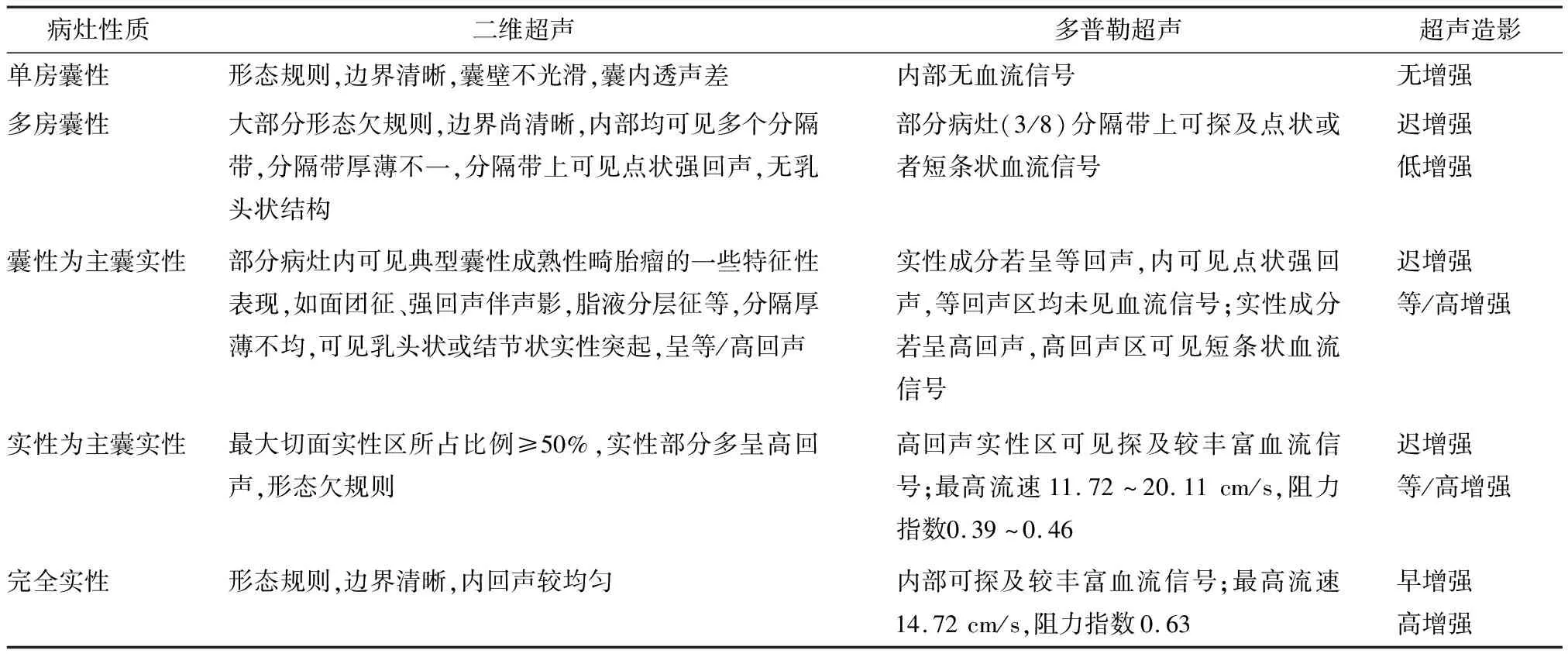
表1 卵巢甲状腺肿的超声表现
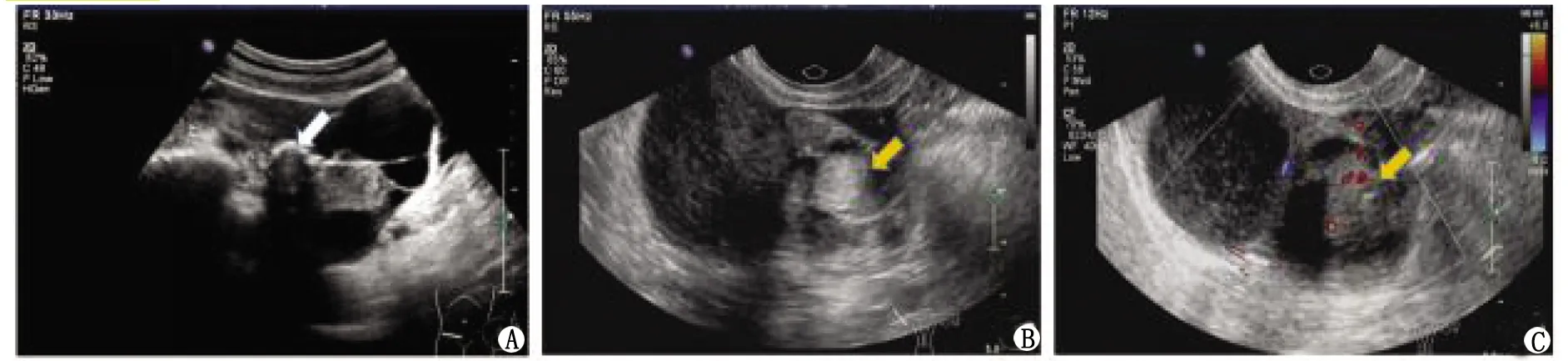
A:病灶可见强回声伴声影(白色箭头);B:病灶内见脂液分层征以及高回声区呈面团征;C:高回声区内有血流信号(黄色箭头:病灶内高回声区)。
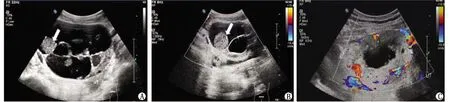
SO:卵巢甲状腺肿。A:左附件多房囊实性占位,分隔带厚薄不均,实性部分呈等回声,分隔带及等回声区可见点状强回声; B:等回声区及分隔带均未见血流信号; C:肿块周边为宽大环状高回声区,CDFI示高回声区可见稍丰富血流信号(白色箭头:病灶实性部分呈等回声; UT:子宫)。
2.3IOTA简易标准判断 34个病灶中,良性11个,不确定型17个,恶性6个,误诊率67.65%。
2.4CEUS增强方式、造影参数 10个病灶(多房囊性1个,囊实性8个,完全实性1个)进行CEUS检查,参照正常子宫肌层开始增强时间:迟增强9个(9/10,90.00%)、早增强1个(1/10,10.00%);参照正常子宫肌层增强强度:低增强2个(2/10,20.00%)、等增强4个(4/10,40.00%)、高增强4个(4/10,40.00%),7个呈不均匀性增强、3例呈均匀性增强。囊性区域均呈无增强;囊实性病灶内等回声实性结构,造影显示全部无增强(图3C);囊实性病灶内高回声实性结构,造影显示呈迟增强,增强强度为等或高增强(图4A,B);囊壁及分隔带呈低增强;完全实性病灶为高回声,造影显示早增强,高增强。经典成熟性畸胎瘤的CEUS模式:始终无增强(图4C)。病灶及子宫肌层造影参数均值比较,差别无统计学意义(表2)。
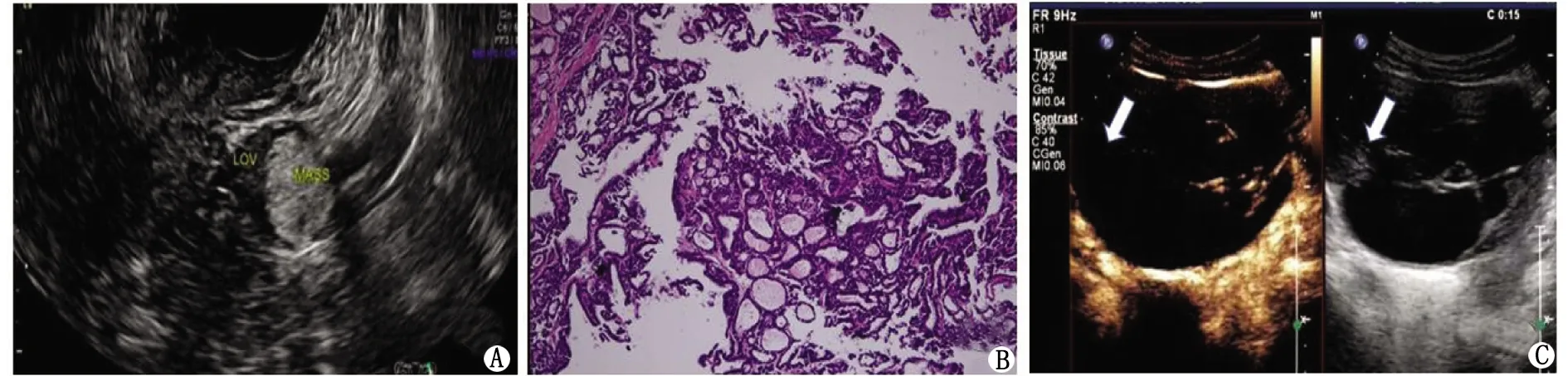
SO:卵巢甲状腺肿。A:完全实性SO的二维超声上呈高回声; B:病理证实高回声结节为甲状腺组织(HE染色,×200); C:CEUS分隔带见低增强,等回声区无增强(白色箭头:病灶实性部分呈等回声; LOV:左侧卵巢; MASS:病灶; UT:子宫)。
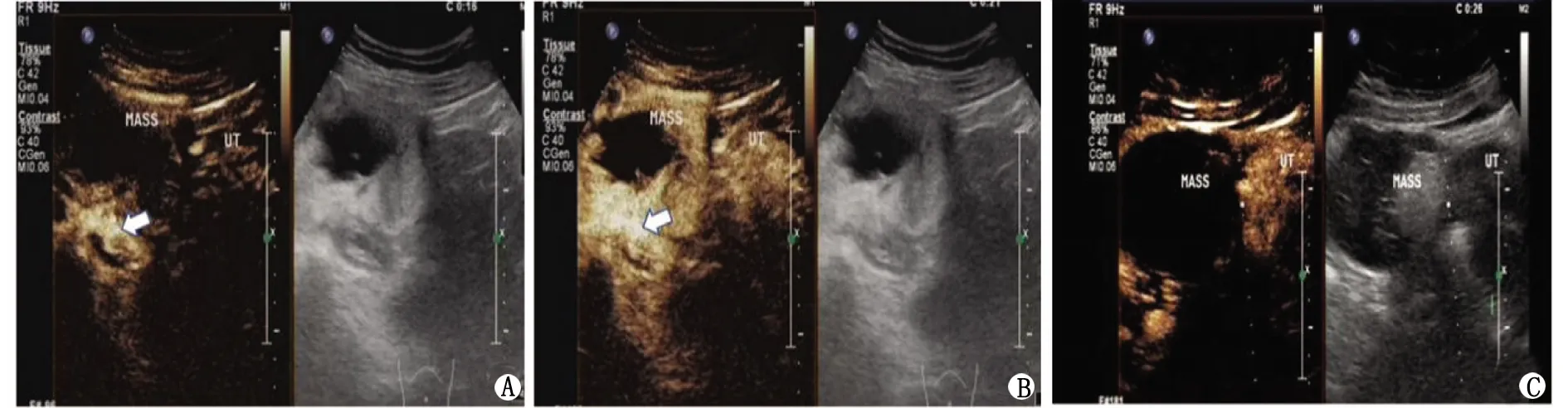
SO:卵巢甲状腺肿。A: CEUS显示高回声区较子宫壁迟增强; B:CEUS显示高回声区与子宫壁呈等增强; C: 经典成熟性畸胎瘤超声造影增强模式:始终无增强(白色箭头:髂血管; UT:子宫; MASS: 病灶)。

表2 卵巢甲状腺肿病灶与子宫肌层TIC定量参数比较
3 讨 论
SO患者的临床症状不明显[2,4-5]。本研究中,27例以发现盆腔肿物就诊;腹痛3例中有1例肿物并发蒂扭转;阴道出血2例均合并子宫内膜病变,腹胀1例。既往报道显示,大部分SO患者无甲亢症状[2,5-6]。本研究中,30例患者甲状腺功能正常,仅3例TSH轻度升高或降低。但有文献报道,甲亢患者常规治疗后,甲状腺激素水平仍升高;SO术后患者甲状腺激素水平降至正常[7-9]。因此,难治性的甲亢应考虑SO的可能。另一方面,SO患者应该接受甲状腺检查,尤其是怀疑有SO恶变者[10]。
本研究中,33例患者均接受血液CEA,AFP,CA199,CA125及HE-4检查。4例CA125升高,其中3例轻度升高,1例明显升高(716.90 U/mL)合并大量腹水;2例CA199轻度升高;1例CA125和CA199轻度升高;余指标均呈阴性。大部分SO患者肿瘤指标正常或仅1~2项轻度异常,偶见单项明显异常。这与既往报道相符[2,4]。假性梅格斯综合征指除卵巢纤维瘤以外的卵巢良性肿瘤合并胸腔和(或)腹腔积液,如子宫平滑肌瘤、SO和成熟畸胎瘤等。文献报道,SO患者中5%~33%出现假性梅格斯综合征,易误诊为卵巢恶性肿瘤[11-12]。本组中,无腹水20例,少量腹水12例,大量腹水1例(合并CA125明显升高),39.39%出现假性梅格斯综合征。
SO是指肿瘤完全或主要由甲状腺组织构成(>50%),分为单纯型(几乎完全由甲状腺组织构成)和混合型(与成熟性畸胎瘤混合存在);肿瘤大体改变为包膜完整,表面呈结节状,切面常呈多房囊性或囊实性,囊内呈胶冻状或充满淡黄色透明液体,实性区域为深棕色或棕红色的肉样组织,混合型中可见毛发、牙齿等组织[13-14]。本研究中,34个病灶大部分呈多房囊性或囊实性,肿物内透声差,分隔带厚薄不一,壁上可见乳头状或结节状突起,可呈高或等回声,高回声区及分隔带可见血流信号,混合型SO声像图中若存在典型的成熟性畸胎瘤表现,如面团征、强回声伴声影及脂液分层征,即使肿块内同时存在较丰富血供的高回声乳头状结构,也要考虑该病的可能。单房囊性、多房囊性及囊实性的常规超声表现可能与SO内的甲状腺组织易发生出血坏死囊性变有关,通过与病理结果进行对照,SO的高回声实性结构为分化较好的甲状腺组织,囊实性病灶中的等回声实性结构可能为浓缩的脂质成分。
卵巢肿物良恶性的鉴别是诊断的难点和重点[15,18]。IOTA简易标准是超声对卵巢肿瘤进行良恶性分类的标准,适用于临床[16]。根据IOTA简易标准判断,本研究34个病灶中良性11个,不确定型17个,恶性6个,误诊率67.65%。因此,SO是良性病变,根据常规超声表现却易误诊为交界性或者恶性肿瘤[6,17]。超声造影剂声诺维具有良好的稳定性和声学特性,可实时动态显示肿瘤内微循环的血流灌注情况,是一种真正的血池造影剂。不同于脂肪、毛发、骨骼等其他卵巢畸胎瘤常见成分的乏血管性质,分化较好的甲状腺组织内可见较丰富的血供[1,18],CEUS在含有大量甲状腺肿成分的卵巢肿物的血供显示更具有明显的优势。本研究10个病灶行CEUS检查,参照正常子宫肌层开始增强时间及增强强度:囊性区域均呈无增强;囊壁及分隔带呈迟增强,低增强;囊实性病灶中实性部分若为等回声,造影显示全部无增强,可能为浓缩无血供的脂质成分;囊实性病灶中实性部分若为高回声,造影模式呈迟于子宫肌层的等/高增强,这与高回声实性结构为甲状腺组织血供较丰富有关。不同于卵巢恶性肿瘤的早增强、高增强的CEUS灌注模式[15],本研究中的10个病灶中9个呈迟增强,病理提示为SO;1例呈早增强,病理提示为SO伴滤泡上皮增生活跃,具有恶性潜能。通过定量参数的分析,病灶上升时间、达峰时间、峰值强度、曲线下面积、内洗斜率的均值与正常子宫肌层比较,二者差别无统计学意义,符合CEUS在良性肿瘤的表现特征[14]。因此,通过CEUS以及结合常规超声图像特征、临床表现及肿瘤指标综合判定,良性病灶9个,恶性1个,良恶性诊断符合率为90.00%。
综上所述,SO临床症状无特异性,绝大部分的SO患者肿瘤指标正常或仅1~2项轻度异常,偶见CA125明显异常,约1/3患者出现假性梅格斯综合征。笔者认为,腹水可能是肿瘤的间质水肿或淋巴管、静脉受压引起。常规超声表现多样,SO的CEUS增强模式符合卵巢良性肿瘤的表现。因此,CEUS在SO与卵巢恶性肿瘤的鉴别诊断上具有重要的价值。

