腹腔镜关闭盆底腹膜的腹会阴联合切除术治疗低位直肠癌患者的效果和安全性
丁保锋
(佳木斯市中心医院肿瘤外二科, 黑龙江省佳木斯市 154002)
直肠癌是消化道常见恶性肿瘤,我国70%直肠癌患者为低位直肠癌,发病位置多位于盆底腹膜折返以下[1]。低位直肠癌即肿瘤距肛缘小于5 cm,受操作空间限制,该疾病手术成功率低。随着医疗技术的提升和患者对术后生活质量的要求越来越高,目前临床上治疗低位直肠癌既要保留患者肛门,又要保证患者的正常排便功能[2-3]。手术切除是临床治疗该疾病的主要手段,特别是伴随微创技术的推广,腹腔镜辅助腹会阴联合切除术(abdominoperineal resection,APR)被广泛应用于临床,且经前瞻性随机对照研究证实,其远期疗效、肿瘤根治性、可行性和安全性均较高[4]。但腹腔镜下盆底腹膜缝合操作困难,手术过程费时费力,加之对盆底腹膜重建的重要性认识不足,对于是否关闭盆底腹膜存在争议。因此,本文选择46例患者展开研究,以探讨腹腔镜关闭盆底腹膜的APR治疗低位直肠癌患者的疗效和安全性。现报告如下。
1 资料与方法
1.1 临床资料 纳入标准:经结肠镜检查和术后病理等确诊;符合低位直肠癌诊断标准[5];肛门功能正常;盆腔MRI、胸部及腹部增强CT检查均未见远处转移;血液系统和免疫系统无严重障碍;患者及家属知情并同意本项研究。排除标准:术前肛门狭窄症状明显;曾有肛门手术史;合并全身各系统疾病。根据纳入和排除标准,选取2018年5月至2019年5月我院诊治的46例低位直肠癌患者进行研究,根据随机数字表法将其分为对照组和观察组,每组23例。对照组男女比例13/10;年龄43~71(53.13±4.25)岁;肿瘤直径3.3~6.1(4.20±0.71)cm;肿瘤距肛缘2.0~4.5(3.02±0.71)cm。观察组男女比例12/11;年龄44~70(54.02±4.03)岁;肿瘤直径3.2~6.3(4.18±0.65)cm;肿瘤距肛缘2.1~4.3(3.06±0.65)cm。两组患者一般资料对比差异无统计学意义(均P>0.05),具有可比性。本研究已获得我院医学伦理委员会批准。
1.2 治疗方法 对照组行传统腹腔镜APR治疗,观察组行腹腔镜关闭盆底腹膜的APR治疗。两组患者均实施气管插管全麻后,在医护人员的帮助下保持脚高头低截石位。依据四孔法将10 mm trocar置入脐下缘,建立气腹,置入腹腔镜。探查肿瘤位置、大小和淋巴结等情况,查看肝脏、盆腔等是否存在病灶转移。于右侧根部将乙状结肠系膜分离,游离肠系膜下动、静脉根部并夹闭血管。切开乙状结肠内外侧腹膜,使其充分显露,并注意对左侧输尿管和精索血管的保护。利用超声刀将直肠系膜后壁分离至肛提肌,并用线性切割闭合器将腹腔内的乙状结肠断开。做直径约为3 cm的圆形切口,然后拉出近端乙状结肠。关闭肛门口,做从会阴中间至尾骨尖端的3 cm梭形切口。用电刀切开皮肤和皮下组织,后沿坐骨结节和臀大肌内侧缘进行分离。利用超声刀将左右两侧髂骨尾骨肌、肛门尾骨韧带断开。切开并分离盆筋膜壁层,将远端乙状结肠和直肠拉至腹腔外,切断部分耻骨直肠肌,以便于切除会阴部直肠、肛门和乙状结肠。盆腔和腹腔创面彻底冲洗干净后,进行止血,并用两层缝合法处理伤口。待气腹重建后,对照组患者不关闭盆底腹膜,观察组则采用3-0可吸收缝合线缝合盆腔底部两侧腹膜,将盆底腹膜关闭后,常规放置引流管。术后3 d,开始用骶前放置的引流管行骶前腔隙持续灌洗,预防会阴切口感染。
1.3 观察指标 (1)临床指标:统计两组患者术中出血量、手术时间、骶前引流量、造口所用时间、淋巴结清扫数目、住院时间。(2)肠道功能:采用美国纽约纪念斯隆-凯特林癌症中心肠道功能问卷对患者手术治疗前和治疗后3个月的肠道功能进行评估,该问卷涉及便频便急(9个条目)、排便受饮食影响(4个条目)和排便感觉异常(4个条目)3个方面,采用1~5分的5级评分法,分值与肠道功能呈负相关。(3)并发症:粘连性肠梗阻、放射性肠炎、切口感染、排尿功能障碍。(4)复发情况:随访时间为1年,对随访期间的肿瘤复发情况进行统计。
1.4 统计学方法 采用SPSS 21.0统计学软件对数据进行处理,用均数±标准差(x±s)表示计量资料,组间比较行t检验;用例数和百分率[n(%)]表示计数资料,组间比较行χ2检验。以P<0.05表示差异有统计学意义。
2 结 果
2.1 临床指标比较 两组患者术中出血量、骶前引流量、造口所用时间和淋巴结清扫数目比较,差异无统计学意义(均P>0.05)。与对照组相比,观察组住院时间更短,手术时间延长,差异均有统计学意义(均P<0.05)。见表1。

表1 两组患者临床指标比较 (x±s)
2.2 肠道功能评分比较 治疗前,两组患者便频便急、排便受饮食影响、排便感觉异常3项评分和肠道功能总分差异均无统计学意义(均P>0.05)。治疗后,观察组上述评分均明显下降,且明显低于对照组,差异均有统计学意义(均P<0.05)。见表2。

表2 两组患者肠道功能评分比较 (x±s,分)
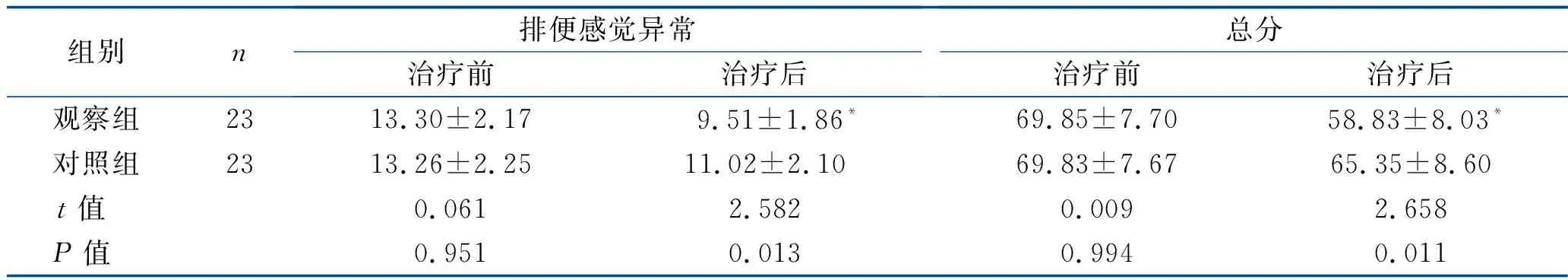
续表2
2.3 并发症和复发情况比较 观察组患者总并发症发生率(4.35%)低于对照组(26.09%),但差异无统计学意义(P>0.05)。两组患者1年复发率比较,差异无统计学意义(P>0.05)。见表3。

表3 两组患者并发症和复发情况比较 [n(%)]
3 讨 论
低位直肠癌是发病率仅次于胃癌和食管癌的消化系统肿瘤。早期开放式切除术切口长、创伤大,患者术后恢复慢,并发症发生率高,不仅给患者带来巨大痛苦,而且损坏患者的免疫系统[6]。随着微创技术的广泛应用,APR自会阴部去除病灶,不需要辅助切口,具有手术切口小、出血量少、术后机体恢复效果好、术后感染风险低等微创优势,被越来越多的低位直肠癌患者接受[7-8]。组织结构方面,低位直肠癌所处位置的手术视野有限,早期开放式切除术盲目性大,主刀医师靠手感分离肿瘤,对直肠系膜和神经造成损伤的风险高。腹腔镜切除术的视野清晰,解剖、分离精准度高,对机体损伤小,保肛概率大[9-10]。
临床治疗直肠癌的开腹手术标准术式为盆底腹膜重建。而腹腔镜辅助下,缝合盆底腹膜对主刀医师操作水平要求高,该操作难度大、耗时长。因此,对于盆底腹膜关闭与否存在较大争议。作为天然屏障的盆底腹膜,关闭后即可隔离腹膜腔和盆底创面,减少肠粘连,降低感染风险,更加彰显腹腔镜的优越性[11]。
本研究结果中,与传统腹腔镜APR相比,行腹腔镜关闭盆底腹膜的APR患者手术时间延长,住院时间缩短(均P<0.05),而在术中出血量、骶前引流量、造口所用时间、淋巴结清扫数目方面差异无统计学意义(均P>0.05)。分析其中的原因,盆腔腹膜化时可能因腹膜缝合而延长时间,在一定程度上增加了手术时间。但关闭盆底腹膜后,避免了腹腔感染,缩短了愈合时间,促进术后康复。有研究显示[12],肛肠手术患者术后排便功能恢复后,会出现便秘、肛门失禁等肠道功能障碍,影响胃肠功能。本研究中,行腹腔镜关闭盆底腹膜的APR患者便频便急、排便受饮食影响、排便感觉异常评分和肠道功能总分均明显下降(均P<0.05),即患者的肠道功能保护良好,有助于术后康复。可能与该术式解剖层次精准,能准确分界盆腔自主神经、解剖间隙,对肠道牵拉刺激小等有关。且该术式创口小,有利于患者尽早下床活动,从而促进胃肠蠕动。分析该术式的安全性,关闭盆底腹膜恢复了其完整性,避免肠管和创面的直接接触,从而避免了各种并发症的发生,但本研究中两组患者并发症总发生率和随访1年的复发率差异无统计学意义(均P>0.05),可能与本研究样本量有限有关,关于盆底腹膜关闭的优劣势仍需要大量临床样本进行随机试验论证。
综上所述,腹腔镜关闭盆底腹膜的APR可缩短低位直肠癌患者住院时间,保护患者肠道功能,且不影响治疗安全性。

