木犀草素含药血清对高糖诱导肾小球系膜细胞AMPK/SIRT-1/PGC-1α信号通路及凋亡的影响
王超超,姜 益,赵润英
(温州市中西医结合医院肾内科·浙江 温州 325000)
糖尿病肾病(diabetic nephropathy,DN)发生率及死亡率逐年升高,严重影响患者的生命健康[1-2]。肾小球系膜细胞(glomerular mesangial cells, GMCs)增殖、细胞外基质沉积、基底膜增厚并导致肾小球硬化是DN发病的主要病理过程,探究GMCs增殖和凋亡机理,是预防和治疗DN的关键[3-4]。单磷酸腺苷活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)/沉默信息调节因子1(silent information regulator 1,SIRT1)/过氧化物酶增殖物激活受体γ共激活因子1α(peroxidase proliferator-activated receptor gamma coactivator 1α,PGC-1α)信号通路参与机体氧化应激、炎症反应、细胞增殖、凋亡、自噬等生理过程,近来研究发现此通路也参与DN的发生发展过程[5-7]。木犀草素(Luteolin)是从木犀草的茎叶中提取的黄酮类化合物,具有抗炎、抗菌、抗肿瘤及心血管保护等多种生物学效应,大量文献研究发现Luteolin对DN肾损伤具有保护作用[8-9],但Luteolin保护DN肾损伤的具体分子生物学机制还不明确。本研究通过体外培养小鼠GMCs,探讨高糖诱导条件下,Luteolin含药血清对GMCs凋亡及AMPK/SIRT-1/PGC-1α通路的影响,以期为临床治疗DN提供理论依据。
1 材料
1.1 实验动物及细胞株 健康雄性SPF清洁级SD大鼠,6~7周龄,体质量 200~220 g,购自于广东省医学实验动物中心,许可证号:SCXK(粤)2018-0002。饲养于本院动物饲养中心,本研究经本院动物伦理委员会批准同意,批号为IACUC-01(20160917)。SV40 MES13型小鼠GMCs:上海康朗生物科技有限公司,货号:KL0194。
1.2 药物 木犀草素(Luteolin):山东临沂艾泽拉斯生物科技有限公司,规格:20 mg;罗格列酮钠片:太极集团重庆涪陵制药厂有限公司,规格: 4mg/片,批号: 15090049。Luteolin及罗格列酮以生理盐水配置为5.00、10.00、20.00 g/L及0.036 g/L的混悬液,
1.3 主要试剂及仪器 四甲基偶氮唑蓝(MTT):购自美国Sigma(货号:M2128);HE染色试剂盒:上海生物公司;Trizol试剂盒:北京麦瑞博;AMPK抗体、pAMPK抗体、SIRT-1抗体、PGC-1α及凋亡相关蛋白脂肪酸合酶(Fas)抗体)、B淋巴细胞瘤-2基因(Bcl-2)抗体:美国abcam公司;DMEM高糖培养基:美国Hyclone公司;BCA蛋白定量试剂盒、胰蛋白酶:美国Pierce公司。Ver1012全自动酶标检测仪:美国Versamax公司;1659001蛋白电泳仪、Trans-Blot SD半干转膜仪:美国Bio-Rad公司。B5-R3-v3型流式细胞仪:美国贝克曼库尔特公司。
2 方法
2.1 含药血清制备 大鼠50只,随机分为正常组,Luteolin低(50 mg/kg)、中(100 mg/kg)、高(200 mg/kg)剂量组,阳性组(罗格列酮[10],0.36 mg/kg),每组10只;各组大鼠均以10 mL/kg的剂量灌胃给药,正常组给予等量生理盐水,各组连续给药7 d,1次/d。末次给药禁食不禁水12 h后,麻醉大鼠,经腹主动脉取血6 mL,静置2 h后,在4 ℃条件下3 000 r/min离心20 min, 取血清装于5 mL青霉素小瓶中,56 ℃灭活、滤过除菌后,置于-80 ℃冰箱保存备用。
2.2 GMCs复苏与培养 将SV40 MES13型GMCs复苏后,接种于含10%胎牛血清(FBS)的高糖DMEM培养基中,置于条件为 37 ℃、5%CO2的恒温培养箱中培养48 h,使细胞融合度达到80%以上后,进行常规传代、计数。
2.3 实验分组及培养 取GMCs细胞,以每孔2×105密度接种于6孔板上,适应性培养24 h后,按以下分组并加入药物继续培养。正常组(10%正常组血清)、高糖模型组(30 moL/L葡萄糖+10%正常组血清)、Luteolin含药血清低(30 moL/L葡萄糖+10%低剂量组含药血清)、中(30 moL/L葡萄糖+10%中剂量组含药血清)、高(30 moL/L葡萄糖+10%高剂量组含药血清)剂量组、阳性含药血清组(30 moL/L葡萄糖+10%罗格列酮组含药血清);每组设置6个复孔,置于37 ℃、5%CO2的恒温培养箱中培养48 h后,收集细胞,以备后续试验。
2.4 观察指标及测定
2.4.1 MTT法测定GMCs存活率 取对数期细胞,按2.3项下各组细胞分组并处理,每组设置6个复孔,向每个孔中加入20 μL MTT溶液(5 g/L),37 ℃下孵育1 h后,加入200 μL二甲基亚砜(DMSO)溶液孵育20 min后,使用自动多孔分光光度计测量490 nm的光密度(OD)值。存活率%=实验组OD值/空白组OD值×100%。
2.4.2 HE染色观察细胞形态 取2.3项下各组细胞,用40 g/L多聚甲醛固定10 min后,HE染色,并置于显微镜下观察细胞形态。
2.4.3 流式细胞仪检测GMCs凋亡率 取2.3项下生长24、48 h的各组细胞,用胰蛋白酶消化后,用Annexin V-FITC细胞凋亡检测试剂盒及流式细胞仪检测细胞凋亡率。
2.4.4 Western Blot检测AMPK、pAMPK、SIRT-1、PGC-1α及凋亡相关蛋白Fas、Bcl-2蛋白表达 取2.3项下各组细胞,加细胞裂解液,离心分离后,取上清液提取蛋白,按BCA 试剂盒说明书检测蛋白浓度,取200 μg蛋白进行电泳、转膜后,置于5%的脱脂奶粉溶液中,37 ℃封闭2 h,加入抗体(AMPK、pAMPK、SIRT-1、PGC-1α,Fas、Bcl-2、β-actin(内参),1∶1 000、1∶1 000、1∶1 000、1∶1 000、1∶1 000、1∶1 000,1∶2 000)并于4 ℃冰箱中孵育过夜,TBST漂洗3次后,加入1∶1 000的羊抗兔二抗溶液,室温孵育2 h,经TBST再次漂洗3次后,采用增强化学发光法显色,以凝胶成像仪观察条带并拍照,并以Image-J软件分析各组蛋白相对表达。

3 结果
3.1 Luteolin含药血清对GMCs存活的影响 见表1。

表1 各组GMCs存活率检测结果
3.2 Luteolin含药血清对GMCs形态学的影响 正常组细胞核形态正常;与正常组相比,模型组细胞密度增高,胞浆内出现大量微丝样结构,细胞核周围有大量小颗粒沉积;与模型组组相比,Luteolin低、中、高剂量组细胞密度、胞浆微丝样结构及核周围小颗粒沉积均有不同程度减弱,且Luteolin各剂量组上述现象呈剂量依赖性降低。阳性组细胞变化与Luteolin高剂量组相似。见图1。
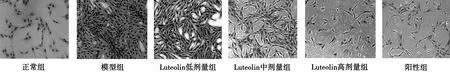
图1 各组细胞HE 染色形态学观察
3.3 Luteolin含药血清对GMCs凋亡的影响 见表2。

表2 各组GMCs凋亡率检测结果
3.4 Luteolin含药血清对GMCs凋亡相关蛋白Bcl-2、Fas相对表达水平的影响 见图1,表3。

表3 各组GMCs Bcl-2、Fas蛋白表达水平
3.5 Luteolin含药血清对GMCs凋亡相关蛋白pAMPK/AMPK、SIRT-1、PGC-1α相对表达水平的影响 见图1,表4。

表4 各组细胞pAMPK/AMPK、SIRT-1、PGC-1α蛋白表达水平

A.正常组;B.模型组;C.Luteolin低剂量组;D.Luteolin中剂量组;E.Luteolin高剂量组;F.阳性对照组
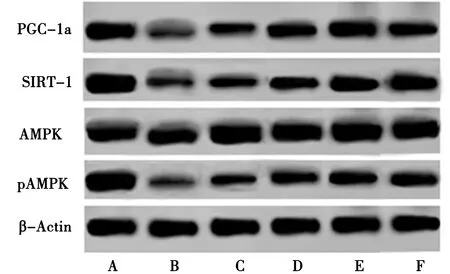
A.正常组;B.模型组;C.Luteolin低剂量组;D.Luteolin中剂量组;E.Luteolin高剂量组;F.阳性对照组
4 讨论
近年来,随着社会的发展、人民生活水平的提高,糖尿病患病率也随之升高,并成为继心血管病、肿瘤之后的第三大非传染性疾病,而DN是威胁糖尿病患者生命的主要原因[10-11]。GMCs异常增生、肥大等病变是DN发展的主要病理过程,而高浓度葡萄糖可促进GMCs增生、肥大及胞外基质产生和积聚,并导致肾损伤[3,10]。体外培养并用高浓度葡萄糖诱导GMCs可模拟DN病理过程[12]。本研究发现,与正常组相比,模型组GMCs细胞密度增高、细胞质内微丝样结构增多、细胞核可见小颗粒沉积等病变,而GMCs存活率升高、凋亡率下降;提示高糖诱导下,GMCs增生严重,凋亡减弱。
文献研究发现Luteolin对肾脏损伤具有较好的改善作用,汪海洋[13]等发现Luteolin可降低单侧输尿管梗塞性大鼠肾脏炎性和纤维化损伤;谭斅[14]等发现Luteolin可降低汞中毒小鼠肾脏损伤;裘儿杰[9]等发现Luteolin可减轻试验性DN大鼠肾脏损伤;然而Luteolin保护肾损伤的具体分子机制还不明确。本研究体外培养并用高浓度葡萄糖诱导GMCs,探究Luteolin含药血清对GMCs增殖及凋亡的影响,发现,与模型组相比,Luteolin含药血清低、中、高剂量组及阳性对照组GMCs细胞密度降低、胞质微丝结构及胞核颗粒沉积等减轻,GMCs存活率降低、凋亡率升高;表明Luteolin含药血清可抑制高糖诱导的GMCs增殖,促进其凋亡。
SIRT1可调节细胞代谢,参与细胞衰老、凋亡、DNA修复等生理过程[15]。AMPK和SIRT1是细胞内的能量感受器,可调节PGC-1α的活性,参与机体能量代谢、线粒体功能、细胞凋亡等过程[5-6,16]。大量文献研究发现,AMPK/SIRT-1/PGC-1α通路参与肾小球病变过程。张笑栩[17]等发现高糖诱导的肾小球系膜细胞免疫炎性损伤的分子机制可能与AMPK通路活化有关;Shat[18]等发现AMPK磷酸化水平降低,可抑制SIRT1活性水平,促进肾小球炎症反应和增生;Liao[19]等发现SIRT1活性水平降低的同时,也可引起PGC-1α水平的降低,并促进线粒体代谢障碍的发生,而加重肾小球病变。但AMPK/SIRT-1/PGC-1α通路在体外培养并用高浓度葡萄糖诱导GMCs中的作用,还未见报道。本研究发现,与正常组相比,模型组GMCs中pAMPK/AMPK、SIRT-1、PGC-1α蛋白表达均降低。另外凋亡相关蛋白Fas、Bcl-2亦参与高糖诱导的GMCs凋亡过程,齐月亮[20]等研究显示下调Bcl-2和上调Fas基因表达,可促进高糖诱导增生的GMCs凋亡。本研究发现,与正常组相比,模型组GMCs中凋亡相关蛋白Fas表达下降、Bcl-2表达升高,提示高糖诱导下,GMCs细胞中pAMPK/AMPK、SIRT-1、PGC-1α蛋白表达下降,细胞凋亡减弱;而用Luteolin含药血清培养GMCs细胞后发现,与模型组相比,Luteolin含药血清低、中、高剂量组及阳性对照组pAMPK/AMPK、SIRT-1、PGC-1α蛋白表达升高,凋亡相关蛋白Fas表达升高、Bcl-2表达下降;表明Luteolin含药血清可能通过激活AMPK/SIRT-1/PGC-1α蛋白表达,促进高糖条件下GMCs凋亡。
综上所述,Luteolin含药血清可能通过激活AMPK/SIRT-1/PGC-1α蛋白表达,抑制高糖诱导下GMCs过度增生,促进其凋亡。为临床Luteolin治疗DN提供一定的理论依据。

