李光杏干制过程护色剂优化及非酶褐变分析
曹家乐,迟岩,孙静瑶,张兵,王馨,杨海燕
(新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)
新疆是世界杏属植物起源中心之一,是我国杏的主产区[1]。李光杏皮光滑无毛,外表光亮鲜美,肉质酸甜多汁,既可以鲜食又可以加工,是新疆主栽品种之一[2]。李光杏由于采收期集中,货架期短,采后易腐且储运性差,因此对李光杏进行干制加工来延长果实的贮藏期。然而,李光杏在脱水干制过程中极易发生褐变,严重影响了李光杏干制品货架期和商品价值。褐变可分为酶促褐变和非酶促褐变。传统鲜杏干制采用硫熏蒸或亚硫酸盐浸泡,抑制鲜杏干制过程中的褐变,但过量使用含硫物质对人类健康具有潜在危害[3]。因此,研究无硫护色技术对提高李光杏干制品食用安全性具有重要意义。
多酚氧化酶(PPO)是果蔬中重要的内源酶,主要促使多酚物质的邻羟基氧化生成邻醌,进一步与多酚或蛋白质发生缩合反应,引起色泽变化。热烫预处理可钝化果蔬中存在的氧化酶,抑制酶促褐变,还可起到灭菌灭虫,进而提高干制品的品质[4,5]。非酶促褐变的主要原因包括抗坏血酸降解反应、多酚类物质氧化聚合反应、美拉德反应以及焦糖化反应等[6,7]。其中,抗坏血酸、总酚、还原糖等关键组分直接或间接参与非酶褐变反应,这些成分的含量和活性决定了非酶促褐变的反应程度和速率。目前,对于李光杏干制过程中非酶褐变相关物质种类和含量变化与褐变关系的研究鲜有报道。
本试验以李光杏为研究试材,探索复配无硫护色剂对李光杏干制过程中褐变的抑制作用,并利用相关性分析其干制过程中引起褐变的主要因素相关程度,为李光杏干制和贮藏过程有效抑制褐变提供一定的参考价值。
1 材料与方法
1.1 材料与试剂
李光杏:2020年7月购于新疆乌鲁木齐市九鼎农产品果蔬批发市场,筛选出成熟度一致、无病虫害、无机械伤、形状均一的果实,置于温度为(4±1) ℃、相对湿度为90%的冷库中备用。
柠檬酸、植酸、L-半胱氨酸(均为食品级),浙江一诺生物科技有限公司;Folin-酚试剂、亮氨酸,北京索莱宝科技有限公司;甲醇、草酸、氢氧化钠、酒石酸钾钠、3,5-二硝基水杨酸等(均为分析纯),天津市大茂化学试剂厂。
1.2 试验仪器与设备
JZ-350色彩色差计,深圳市金准仪器设备有限公司;AL204电子天平,梅特勒-托利多仪器(上海)有限公司;UV-1200紫外可见分光光度计,上海美谱达仪器有限公司;KQ-250DE数控超声波清洗器,昆山市超声仪器有限公司。
1.3 试验方法
1.3.1 工艺流程
鲜杏→分拣→冲洗→漂烫→冷却→护色→沥水→干制→成品→品质测定
1.3.2 操作要点
(1)漂烫、护色:通过预实验筛选出热烫温度为90 ℃、时间3 min;护色液体积为李光杏的2倍,浸渍时间4 h。
(2)沥干:将李光杏置于沥水篮中至无明显液体滴落为止。
(3)干制:采用传统露天干制,直至杏果实质量损失率为80%,在此过程中,质量每损失10%时取样,液氮速冻,置于-40 ℃冰箱保藏,备用。
1.3.3 单因素试验
分别以0.20%、0.40%、0.60%、0.80%、1.00%的柠檬酸,0.02%、0.04%、0.06%、0.08%、0.10%的植酸,0.05%、0.10%、0.20%、0.30%、0.40%的L-半胱氨酸为单因素进行试验,研究各单因素对热烫后的李光杏干制过程中L*值的影响,确定各单因素的最佳范围。
1.3.4 李光杏护色的响应面优化试验
响应面试验基于单因素试验结果,分别选取柠檬酸、植酸、L-半胱氨酸浓度3个影响因素进行考察,以L*值为响应值,设计三因素三水平试验,进行响应面分析,优化李光杏干制防褐变工艺条件,各因素和水平见表1。
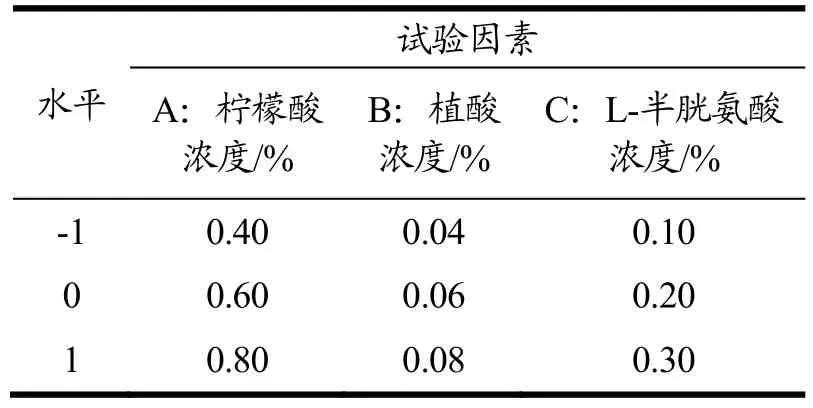
表1 Box-Behnken试验因素水平表Table 1 Level table of Box-Behnken experimental factors
1.3.5 指标测定
1.3.5.1 无硫杏干色泽的测定
参照吴松霞等[8]的方法稍作修改,对李光杏干制品围绕赤道部位取六个点,进行参数L*值的测定,取其平均值。
1.3.5.2 抗坏血酸含量的测定
参照2,6-二氯酚靛酚滴定法测定[9]。
1.3.5.3 还原糖含量的测定
参照 3,5-二硝基水杨酸比色法[10]。由标准曲线y=0.5109x−0.0045(R2=0.9991),计算待测样品还原糖含量,结果以干基表示。
1.3.5.4 总酚含量的测定
参照 Folin-Ciocalteu比色法[11]。根据标准曲线y=0.1199x−0.0094(R2=0.9994),计算待测样品总酚含量,结果以干基表示。
1.3.5.5 游离氨基酸总量的测定
参照茚三酮显色法[12]。并由已建立的标准曲线y=0.0709x+0.0015(R2=0.9996),计算待测样品游离氨基酸总量,结果以干基表示。
1.4 数据统计分析
每个指标平行测定三次,采用Origin 2019软件作图,利用SPSS 22.0软件进行相关性分析和差异显著性分析,p<0.05表示差异显著,并用Design ExPert 10软件对李光杏干制无硫护色参数进行优化。
2 结果与讨论
2.1 单因素试验结果及分析
2.1.1 柠檬酸对李光杏干制品L*值的影响
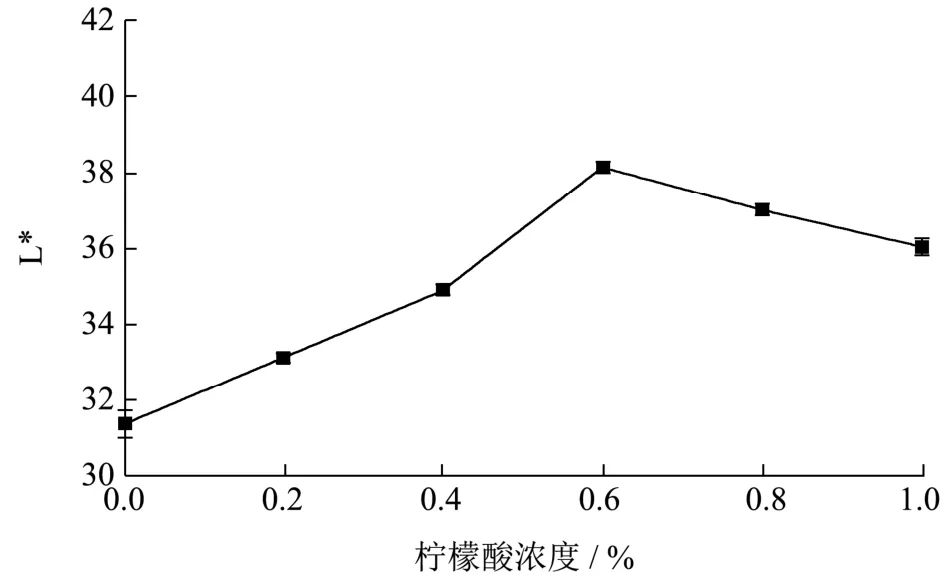
图1 柠檬酸对李光杏干制品L*的影响Fig.1 The effect of citric acid on the L* of dried Liguang apricot products
由图1可知,随着柠檬酸浓度的增大,李光杏干制品L*值呈先上升后下降的趋势。对比CK组(L*值为 31.37),0.60%柠檬酸处理显著抑制了李光杏干制过程中的褐变(p<0.05),其L*值为38.11,李光杏干制品色泽(L*值)升高21.49%。这与张芳[13]等研究结果一致,张芳等的试验结果显示:0.60%柠檬酸可显著降低杏脯色差值,且与CK组相比,下降了11.93%。这可能是由于柠檬酸通过降低pH,使溶液氧气溶解度降低而兼有抗氧化性。Zhou[14]等通过CD光谱证实由于酸性条件下PPO的β-转角和无规则卷曲含量增加,从而使 PPO的构象变化,抑制褐变。Queiroz[15]等研究发现其促进羰氨反应中的缩合物水解,破坏了李光杏干制过程中褐变物质的反应。当柠檬酸浓度高于0.60%时,其L*值显著下降(p<0.05),这可能是因为对金属离子螯合作用减弱。综合考虑,柠檬酸溶液浓度选用0.60%时护色效果最好。
2.1.2 植酸对李光杏干制品L*值的影响
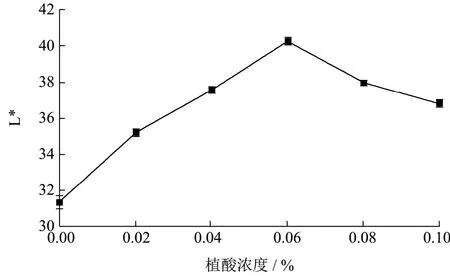
图2 植酸对李光杏干制品L*的影响Fig.2 The effect of phytic acid on the L* of dried Liguang apricot products
由图2可知,随着植酸浓度的增大,李光杏干制品L*值呈先上升后下降的趋势,对比CK组(L*值为31.37),0.06%植酸处理显著抑制了李光杏干制过程中的褐变(p<0.05),其L*值为40.28,李光杏干制品色泽(L*值)升高28.40%。这与李凤霞[16]等研究结果相似,李凤霞等的研究发现:0.12%植酸处理苹果果脯,其感官评价与L*值均显著上升。这可能是由于李光杏中金属离子较少,低浓度植酸基本螯合完全。黄艳斌[17]等研究表明其能够螯合促进氧化作用的微量金属离子,且络合物不能活化氧分子,使双键的加成反应和过氧化物的形成难以实现,以阻断醛、酮等产物。傅释仪等[18]研究发现植酸能够很好抑制抗坏血酸氧化,抑制褐变。当植酸浓度增大到0.08%时,其L*值为37.96,相比浓度为0.04%处(L*值为37.56)差异不显著(p>0.05),可能是因为pH过低,导致细胞膜通透性增加甚至破坏。综合考虑,植酸浓度选用0.06%时护色效果最好。
2.1.3 L-半胱氨酸对李光杏干制品L*值的影响
由图3可知,随着L-半胱氨酸浓度的增大,李光杏干制品L*值呈先上升后下降的趋势,对比CK组(L*值为 31.37),0.20%植酸处理显著抑制了李光杏干制过程中的褐变(p<0.05),其L*值为38.28,李光杏干制品色泽(L*值)升高22.03%,可能是由于L-半胱氨酸阻止了酚类的聚合从而抑制褐变。孔维宝[19]等研究认为L-半胱氨酸直接消除醌与其他物质的反应,来抑制褐变;Ali[20]等研究发现荔枝经过0.25%的L-半胱氨酸处理后,其褐变指数显著降低,并认为产生此变化趋势的原因与相关氧化酶有关;后期可从L-半胱氨酸抑制机理开展试验,进行验证。当L-半胱氨酸浓度高于 0.20%时,其 L*值逐渐下降,0.30%L-半胱氨酸处理组L*值为36.17,与最优处理差异显著(p<0.05),可能有由于其造成李光杏组织破坏,使L*值下降。Ye等[21]研究发现适当浓度 L-半胱氨酸保护莲藕脯的组织,从而使褐变度降低,当浓度大幅度增加,莲藕脯的组织遭到破坏,褐变度增加。综合考虑,L-半胱氨酸浓度选用0.20%时护色效果最好。
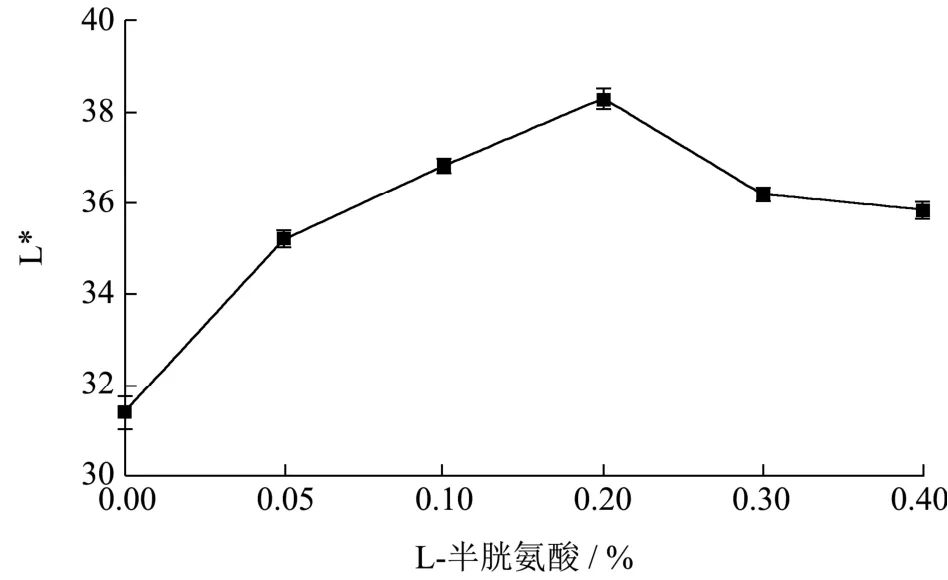
图3 L-半胱氨酸对李光杏干制品L*的影响Fig.3 The effect of L-cysteine on the L* of dried Liguang apricot products
2.2 响应面试验
2.2.1 响应面优化设计及结果
采用Box-Behnken试验设计原理对李光杏复配无硫护色剂进一步优化,整个试验共进行17次,并利用Design-Export 10软件进行数据分析,李光杏复配无硫护色剂优化见表2。
2.2.2 因素与李光杏干制品色泽(L*值)模型的建立
采用Design Export 10软件对表3中的数据进行分析,拟合所得李光杏干制品L*值(Y)与柠檬酸(A)、植酸(B)和L-半胱氨酸(C)的实际回归方程如下:Y=42.13+0.10A+0.78B-0.11C+0.50AB-0.13AC+0.15B C-0.84A2-2.46B2-1.37C2
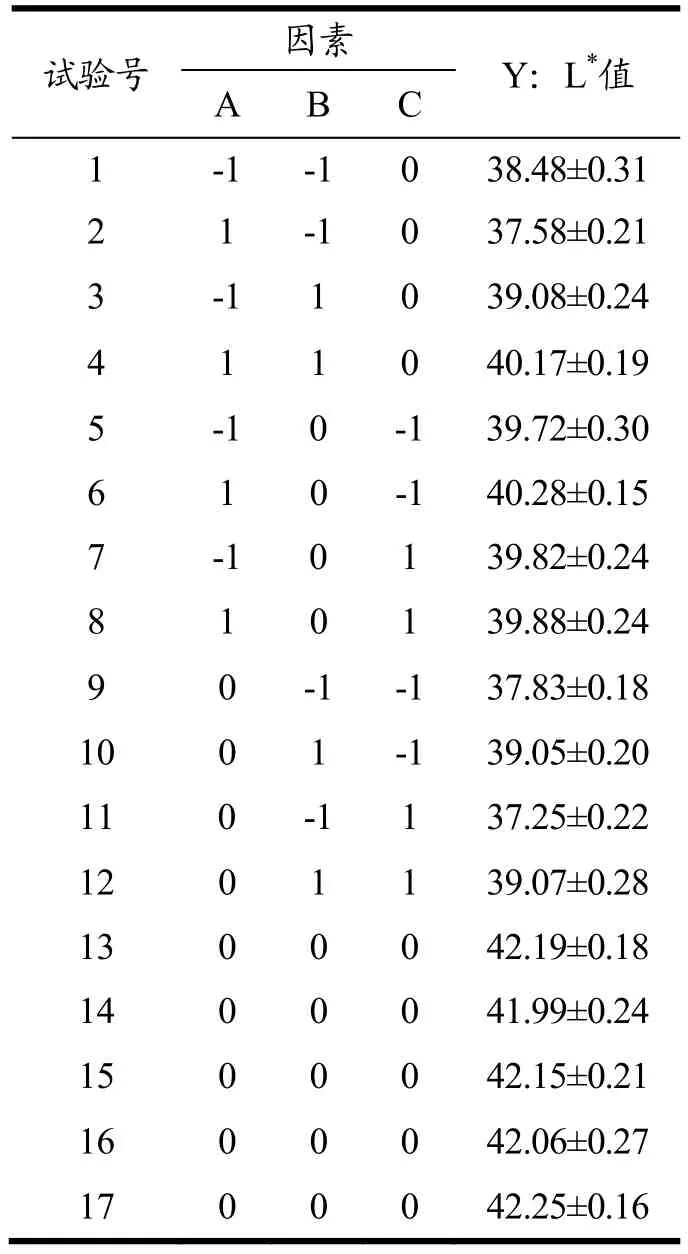
表2 Box-Behnken 试验设计与结果Table 2 Design and results of Box-Behnken experiments
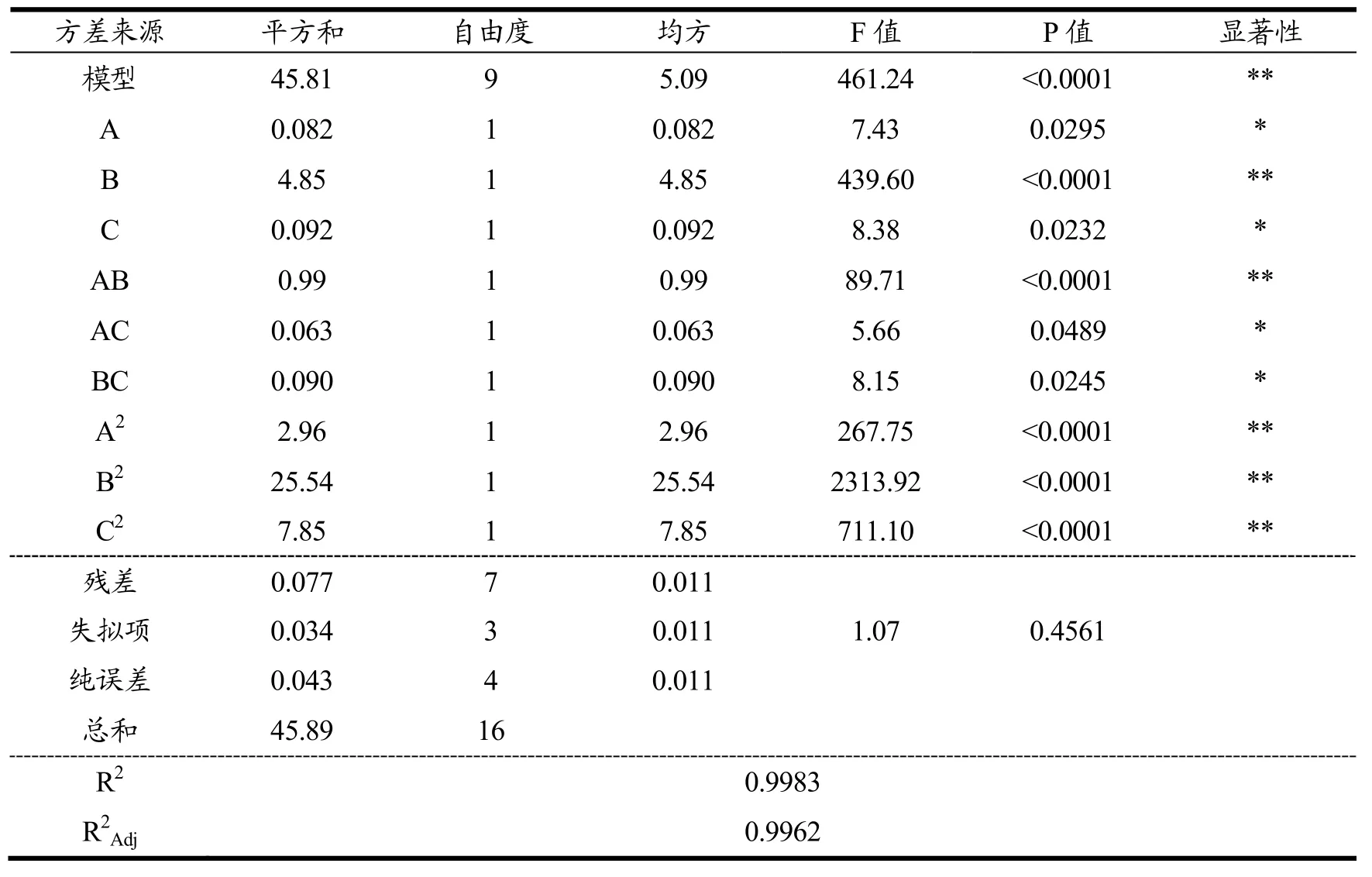
表3 Box-Behnken 试验结果方差分析Table 3 Variance analysis of Box-Behnken test results
由表3分析结果表明,模型p<0.0001,说明该模型差异性极显著;失拟项P=0.4561>0.05,即模型失拟项不显著;相关系数 R2=0.9983,调整相关系数R2Adj=0.9962,说明该模型拟合相关性较好,可用于李光杏干制过程色泽的分析。显著性分析结果表明:B(植酸)、交叉项AB及二次项A2、B2、C2对李光杏干制品色泽影响极显著(p<0.01),A(柠檬酸)、C(L-半胱氨酸)、交叉项AC、BC对试验结果有显著性影响(p<0.05)。交互作用强弱:AB>BC>AC;各因素对李光杏干制品色泽强弱的影响为:B(植酸)>C(L-半胱氨酸)>A(柠檬酸)。
2.2.3 响应面图分析
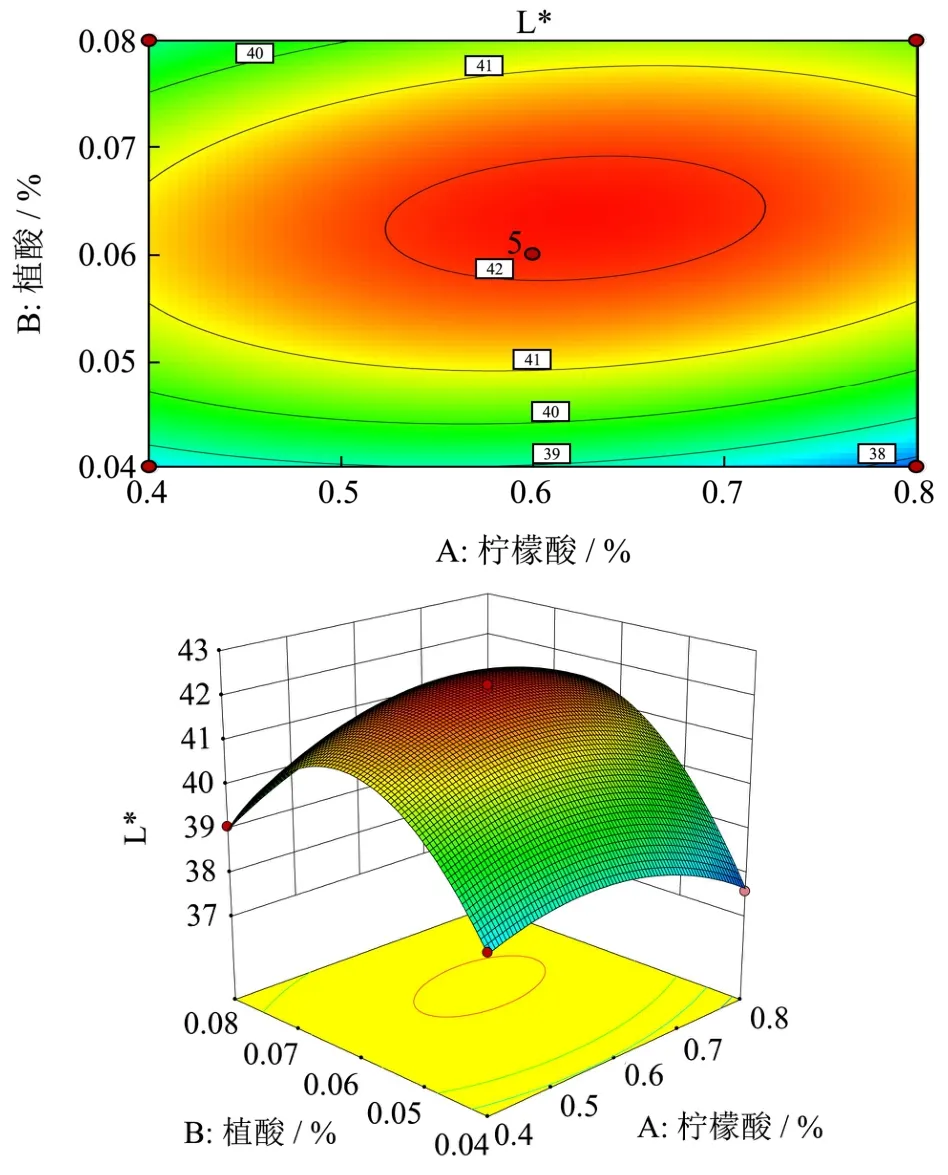
图4 柠檬酸浓度与植酸浓度对李光杏色泽(L*)的响应面图Fig.4 The response surface plot of citric acid concentration and phytic acid concentration on the color of Liguang apricot (L*)
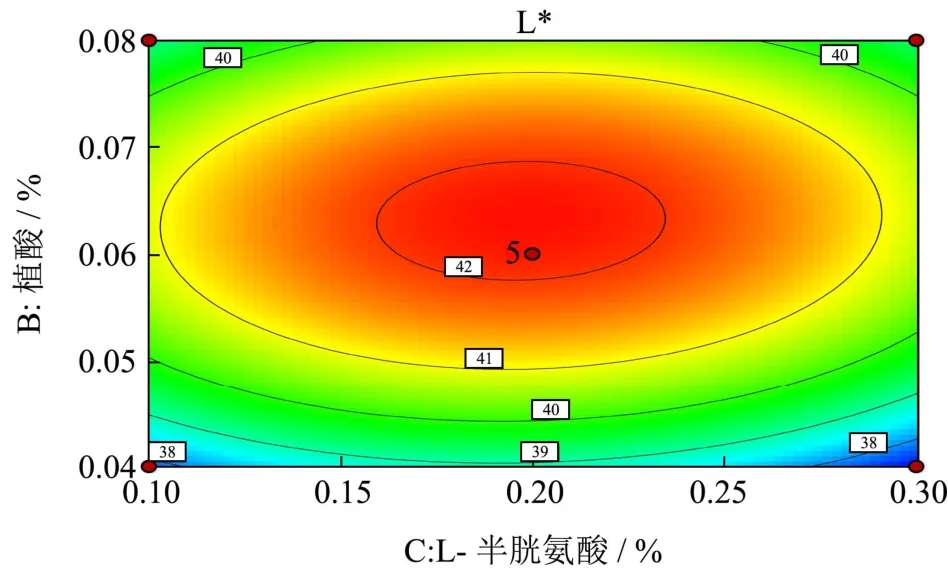
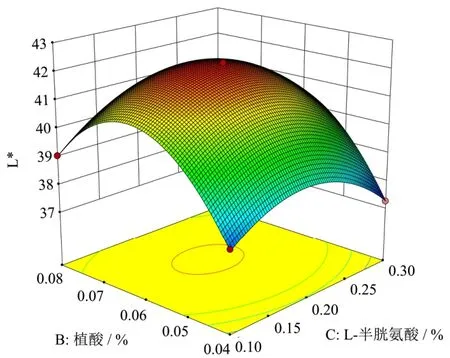
图5 植酸浓度与L-半胱氨酸浓度对李光杏色泽(L*)的响应面图Fig.5 Response surface plot of phytic acid concentration and L-cysteine concentration on the color of Liguang apricot (L*)

图6 柠檬酸浓度与L-半胱氨酸浓度对李光杏色泽(L*)的响应面图Fig.6 Response surface plot of citric acid concentration and L-cysteine concentration on the color of Liguang apricot (L*)
响应面图可以直观反映各因素与响应值之间的关系及因素间的交互作用。图4~6显示柠檬酸(A)、植酸(B)、L-半胱氨酸(C)之间的交互作用对李光杏干制品色泽(L*)的影响。其中图4与图5的曲面相对陡峭,表明因素的交互作用较强,与方差分析结果相同。
2.2.4 最佳工艺验证试验
通过对回归方程进行分析并求解,得到李光杏干制护色的最优工艺:柠檬酸浓度为0.62%,植酸浓度为0.06%,L-半胱氨酸浓为0.20%,预测李光杏L*值为42.20,考虑到实际生产的情况,将各参数修正为:柠檬酸浓度 0.60%,植酸浓度 0.06%,L-半胱氨酸浓0.20%,采用上述条件进行3次重复试验,得到L*值为 42.18±0.22,与预测值接近,可见回归模型能很好地预测李光杏干制后的L*值。
2.3 李光杏干制过程中非酶褐变反应研究
2.3.1 李光杏干制过程色泽(L*)的变化
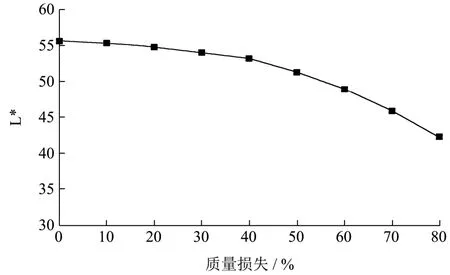
图7 不同质量损失下李光杏L*的变化Fig.7 Changes of Liguang apricot L* under different mass losses
由图7可知,在李光杏干制过程中,其L*值呈现出下降的趋势,至干制结束,其L*值 42.18,相比于鲜杏 L*值 55.57,李光杏在干制过程中 L*下降了24.10%。毕家钰[22]等人用 0.90%植酸、0.30%柠檬酸组成的复合护色液浸渍香蕉片20 min,褐变抑制率达84.40%,与本试验结果不一致,这可能是由于品种不同,护色剂对干制过程中非酶促褐变抑制趋势不一致。Pham[23]等研究认为酸性条件下,抗坏血酸、还原糖分解成糠醛化合物及5-HMF促进褐变;Gao[24]等研究表明多酚物质自身缩合氧化是苹果切片褐变的主要原因;后期可进行李光杏干制过程非酶褐变分析,以进行验证。干制过程中随着质量损失的增大,褐变显著增加,主要是因为干制后期,褐变产物的累计,导致明显的褐变。
2.3.2 李光杏干制过程抗坏血酸的变化
在非酶褐变反应动力学中,抗坏血酸作为其氧化褐变的一种呋喃前体,其含量变化是褐变反应的特定参数之一[25]。因此,分析鲜杏干制过程抗坏血酸含量的变化,对于研究非酶褐变有着重要意义。由图8可知,在李光杏干制过程中,抗坏血酸含量呈下降的趋势,当干制结束时,其抗坏血酸含量为1.39 mg/100 g,相比于鲜杏,其抗坏血酸含量下降了85.68%,王威[26]等人研究发现完熟期赛买提杏晒干后抗坏血酸含量是鲜杏的9.99%,与本试验相似,这可能因为抗坏血酸易被氧化成双羰基化合物,进一步形成有色物质。徐亦秀[27]研究认为抗坏血酸有氧分解进一步生成还原酮,进而参与美拉德反应的中间及最终阶段,无氧分解形成糠醛,形成褐色物质。
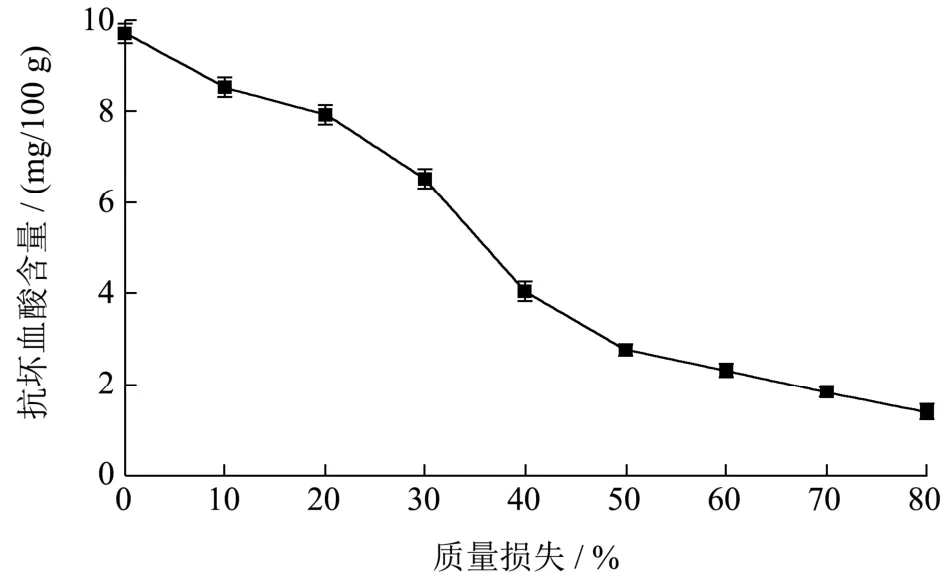
图8 不同质量损失下李光杏抗坏血酸的变化Fig.8 Changes of anti-chemical blood acid of Liguang apricot under different mass losses
2.3.3 李光杏干制过程还原糖的变化
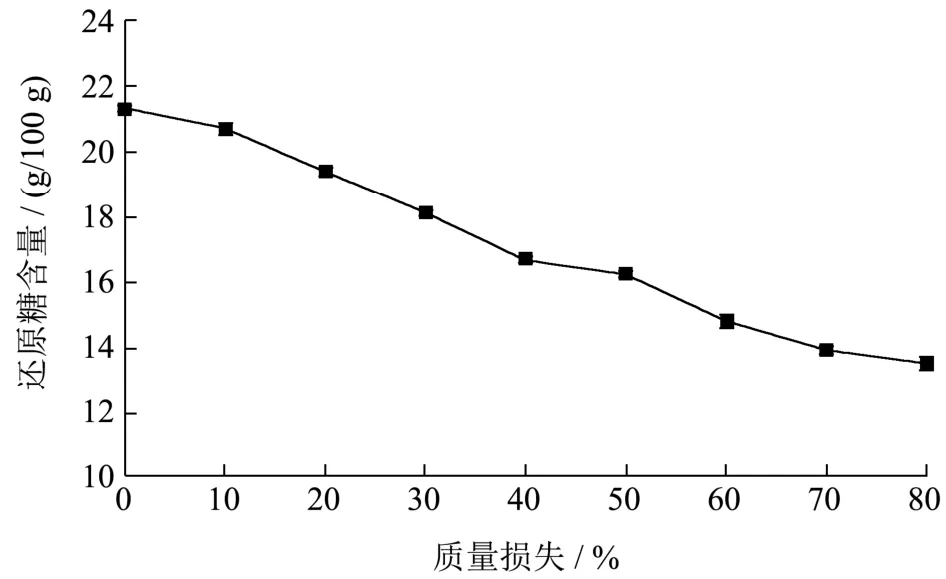
图9 不同质量损失下李光杏还原糖的变化Fig.9 Changes of reducing sugar of Liguang apricot under different mass losses
游离还原糖与游离氨基酸之间的羰氨反应是果蔬加工品非酶褐变的影响因素之一[28,29]。由图9可知,在李光杏干制过程中,还原糖呈现下降的趋势,干制前后,其含量分别为21.30 g/100 g、13.52 g/100 g,降低了 36.53%(p<0.05),在质量损失 40%、50%时,还原糖含量分别为16.67 g/100 g、16.22 g/100 g,变化相对较小,李琼[30]等研究发现鲜杏中还原糖含量为20.10 g/100 g,自然晒制条件下还原糖含量降至11.45 g/100 g,下降幅度42.99%,干制过程一段时间含量变化较为平稳。这可能是由于还原糖在干制过程分解参与美拉德反应,且一段时间内蔗糖水解与美拉德反应处于动态平衡。鲍若晗[31]证实还原糖含量下降可能参与羰氨反应,升高是由多糖在酸性条件下水解所引起的。干制后期,还原糖含量趋于平衡,可能是由于糖类与氨基酸化合物生成糖胺,导致pH降低抑制反应进行。
2.3.4 李光杏干制过程总酚的变化
酚类物质能够有效清除自由基,防止组织发生氧化[32],是果蔬中的次生代谢产物之一。由图10可知,李光杏在脱水干制过程中总酚含量总体呈下降的趋势,干制结束时总酚含量为0.27 mg/g,相比于鲜杏的0.75 mg/g,其下降了64.00%。徐玉娟[33]等用热泵干制龙眼,发现至干制结束,总酚从3.34 mg/g下降至2.54 mg/g,降低了23.94%。这可能是由干制方法和品种不同,进而使酚类物质促进5-HMF的重要前体3-脱氧葡萄糖的形成速率不同。Wilke[34]等证实多酚物质中的原花青素B1易水解为儿茶素与表儿茶素,在美拉德反应中作为促氧剂生成 D-葡萄糖酮,进而引起色泽变化。当质量损失40%、50%时,总酚含量分别为0.36 mg/g、0.42 mg/g,其含量显著增加(p<0.05)。李晓丽[35]等研究发现无核白葡萄脱水过程中质量损失40%~50%阶段总酚突然增加,并开始出现褐变现象,与本研究结果相同。干制后期,总酚含量下降趋势趋于平缓,可能是由多酚物质中多酚氧化缩合的主要物质含量降低。
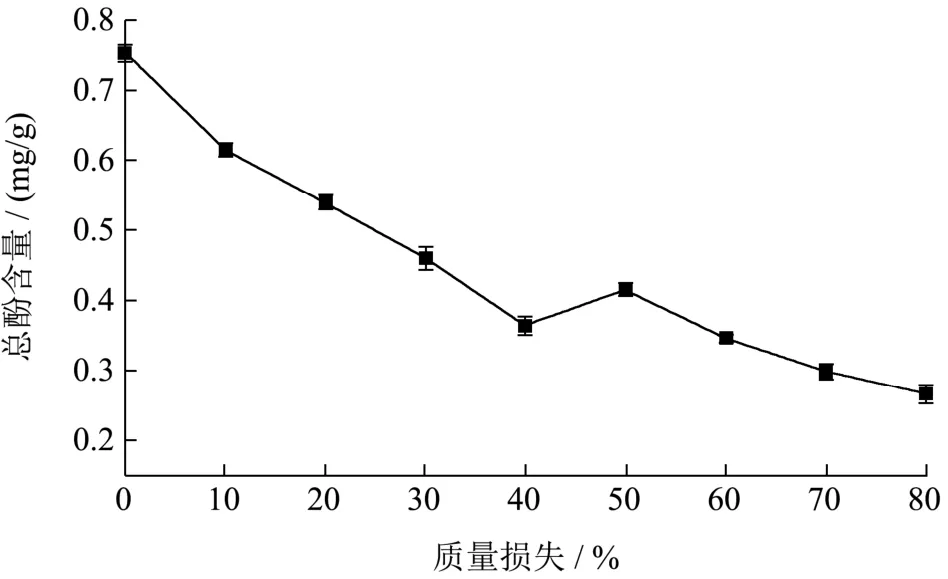
图10 不同质量损失下李光杏总酚含量的变化Fig.10 Changes of total phenolic content of Liguang apricot under different mass losses
2.3.5 李光杏干制过程游离氨基酸的变化
游离氨基酸参与美拉德反应、抗坏血酸的氧化褐变反应以及多酚类物质的缩合反应[36],是探究李光杏干制期间非酶褐变的重要指标。由图11可知,李光杏在干制过程中,游离氨基酸总量呈下降的趋势,至干制结束,李光杏干制品游离氨基酸总量为 39.33 mg/100 g,相比于鲜杏的51.10 mg/100 g,其下降了23.03%。张哲[37]等研究发现新鲜龙眼果肉经热风干制后游离氨基酸的含量显著下降(p<0.05),质量分数从8.70%降到2.52%,下降了71.03%。这可能是由于其参与了美拉德反应。胡云峰[38]等研究也认为游离氨基酸大部分与还原糖发生了美拉德反应。在质量损失40%、50%时,其含量分别为44.75 mg/100 g、41.36 mg/100 g,下降幅度较大,这可能是因为这一阶段蛋白质水解速率减慢。曹一菲[39]等研究水煮藕带非酶褐变时认为抗坏血酸前期的大量消耗,促使了接下来的美拉德反应;后期可进行干制过程游离氨基酸总量变化机理的试验,探究其变化的具体原因。干制后期,游离氨基酸含量趋于平缓,可能是因为大量产物积累,致使反应受阻。

图11 不同质量损失下李光杏游离氨基酸含量的变化Fig.11 Changes of free amino acid content of Liguang apricot apricot under different mass losses
2.4 相关性分析
以X1(抗坏血酸)、X2(还原糖)、X3(总酚)、X4(游离氨基酸)为自变量,以L*值为因变量,对复合护色剂对李光杏干制品褐变的各因素进行相关性分析。

表4 各因素间的相关系数Table 4 Correlation coefficients among various factors
由表4可知,李光杏干制过程中,抗坏血酸(X1)、还原糖(X2)、总酚(X3)、游离氨基酸(X4)含量均与L*值(Y)极显著相关(p<0.01),其中,还原糖(X2)对李光杏干制品的L*值显著性明显高于其他因素,其次是游离氨基酸(X4)、抗坏血酸(X1)、总酚(X3),表明在李光杏干制过程中,美拉德反应和抗坏血酸氧化引起的非酶褐变主要的。这与陈思奇[40]等研究刺梨果糕不同干燥温度条件发生非酶褐变的主要原因是美拉德反应的结果基本一致。
3 结论
通过单因素并结合响应面试验得出李光杏干制过程中无硫护色剂最佳复配条件为0.60%柠檬酸、0.06%植酸、0.20% L-半胱氨酸,植酸对李光杏干制品色泽(L*值)影响最大,其次是L-半胱氨酸、柠檬酸,在此条件下,李光杏干制品预测 L*值 42.20,实际为42.18±0.22,相对误差为0.05%,误差较小,说明该模型能够较好的预测实际值;通过复合无硫护色剂处理,李光杏干制品抗坏血酸含量为1.39 mg/100 g、还原糖含量为13.52 g/100 g、总酚含量为0.27 mg/g、游离氨基酸含量为39.33 mg/100 g,并利用相关性分析得出干制过程中对非酶褐变影响的顺序为还原糖>游离氨基酸>抗坏血酸>总酚。这为今后更有针对性研究无硫护色剂抑制李光杏干制过程中色泽的变化提供一定的理论依据。

