表没食子儿茶素没食子酸酯对小鼠非酒精性脂肪肝的干预作用
沈晶,舒恒,石孟琼,张媛媛,朱丽金,雷乾坤,张继红,贺海波,4,邹坤
(1.三峡大学医学院,湖北宜昌 443002)(2.三峡大学天然产物研究与利用湖北省重点实验室,湖北宜昌 443002)(3.三峡大学中医临床医学院,湖北宜昌 443001)(4.药食同源大健康产品开发利用宜昌市重点实验室,湖北宜昌 443002)
非酒精性脂肪性肝病(NAFLD)被认为是非酒精性肝病全世界慢性肝病最常见的病因是一种病理生理学复杂的多因素疾病,包括肝脏脂肪变性、非酒精性脂肪性肝炎以及随后的纤维化、肝硬化和肝细胞癌[1]。近年来研究显示,NAFLD的发病率及检出率在全球范围内逐年攀升,已成为发达国家及地区,甚至某些发展中国家最常见的肝病之一。由于NAFLD确切的发病机制尚不明确,目前仍没有治疗NAFLD的特效药物[2]。
AMP活化蛋白激酶(AMPK)是一个与肝脏脂质正性调节相关的主要细胞能量代谢开关,活化的AMPK(p-AMPKα)可减少肝脏甘油三酯的积累,增加脂肪酸氧化和代谢率从而改善NAFLD[3]。沉默信息调节因子1(SIRT1)是与机体代谢状态关系密切的另一代谢调节酶,它通过调节组蛋白及相关转录因子、信号转导分子的乙酰化修饰水平而参与调节基因的转录及相关代谢酶的活性[4]。Matsusue等人[5]证实p-AMPK和SIRT1协同抑制过氧化物酶体增殖物激活受体γ(PPARγ)的表达,导致脂质合成受到抑制,从而抑制NAFLD发生发展;Chyau等人[6]进一步研究发现固醇调节元件结合蛋白 1c(SREBP-1c)与 PPARγ关系密切,是NAFLD脂肪酸代谢发生异常的核心酶蛋白,上调 p-AMPKα、SIRT1蛋白表达,下调SREBP-1c、PPARγ蛋白表达可有效缓解NAFLD病理进程。因此,可以推测积极调控AMPK/SIRT1/SREBP-1c/PPARγ信号通路可有效减少NAFLD的发生和发展危险。
表没食子儿茶素没食子酸酯(EGCG)是绿茶和发酵茶中主要的多酚类儿茶素,约占儿茶素含量的50%~80%[7]。尽管EGCG的生物学效应尚未完全了解,研究表明,EGCG可降低肿瘤在不同器官部位的发生率和多样性,并在心血管、神经退行性疾病和代谢综合征(包括肥胖、胰岛素抵抗和血脂异常)中发挥作用[8]。此外,EGCG对不同类型的肝损伤有许多有益的作用,如免疫性肝损伤[9],氟化钠诱导的氧化性肝损伤[10]和慢性酒精性肝损伤[8]。其他研究表明,在 2型糖尿病或NAFLD小鼠中,EGCG通过降低循环胰岛素、改善胰岛素敏感性和减轻胰岛素抵抗来减轻肝损伤的严重程度[11-13],但EGCG防治NAFLD具体作用和机制仍然缺乏。
因此,本研究采用ApoE-/-小鼠配合高脂饲料喂养复制NAFLD模型,观察EGCG对NAFLD干预的效果,以期为深入EGCG抗NAFLD的机制研究提供更多的实验依据。
1 材料与方法
1.1 实验材料
体质量为 20~25 g的雄性 ApoE−/−小鼠(品系C57BL/6J)购置于南京大学模式动物研究所,许可证号为SCXK(苏)2015-0001;体质量为25~30 g的雄性野生型C57BL/6J小鼠购自三峡大学实验动物中心,许可证号SCXK(鄂)2017-0061。本实验通过了三峡大学动物实验伦理委员会审查,并在其指导下进行。
谷氨酸草酰乙酸转氨酶(GOT)、谷氨酸丙酮酸转氨酶(GPT)、甘油三酯(TG)、胆固醇(TC)、游离脂肪酸(FFA)、羟脯氨酸(HYP)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、超氧化物歧化酶(SOD)、葡萄糖(GLU)和尿酸(UA)、胰岛素、瘦素和脂联素试剂盒,南京建成生物工程研究所;实时定量PCR试剂盒、AMPKα、SIRT1、脂肪酸合成酶(FASN)、乙酰辅酶A羧化酶1(ACC-1)、SREBP-1c、硬脂酰辅酶 A 去饱和酶-1(SCD-1)、PPARγ、GAPDH引物合成(引物序列见表1)、TRIzol、DEPC、Prime ScriptTMRT reagent Kit、Taq DNA聚合酶,大连Takara公司;p-AMPKα、AMPKα、SIRT1、FASN、p-ACC-1、ACC-1、p-SREBP-1c、SREBP-1c、SCD-1和PPARγ一抗,美国Cell Signaling Technology公司;β-actin一抗及二抗,武汉博士德生物工程有限公司;蛋白提取及ECL试剂盒,南京碧云天生物技术有限公司;其余试剂为国产分析纯。

表1 实时定量PCR引物序列Table 1 Primer sequences used in quantitative real-time PCR

图1 小鼠NAFLD模型建立及给药Fig.1 Establishment and administration of NAFLD model in mice
1.2 仪器与设备
电子天平,梅特勒-托利多仪器(上海)有限公司;涡旋仪,美国奥然科学技术有限公司;高速冷冻离心机,德国Eppendorf股份公司;血浆生化分析仪,日本富士公司;解剖显微镜,日本Nikon公司;脱水机、显微镜及图像分析系统,德国Leica公司;超薄切片机,奥地利Leica公司;实时定量PCR仪,美国Bio-Rad公司;核酸测定仪,美国Thermo公司;电泳仪,北京六一生物科技有限公司。
1.3 实验方法
1.3.1 NAFLD模型的建立及EGCG治疗
实验动物适应性饲养1周后,将40只ApoE−/−小鼠每天定量给予高脂饲料喂养,另取 10只野生型C57BL/6J小鼠作为正常组,每天定量给予普通饲料喂养[14]。8周后,喂养高脂饲料的40只ApoE−/−小鼠随机分为模型组、奥利司他组、EGCG低剂量组(EGCG-L)、EGCG高剂量组(EGCG-H),每组10只。奥利司他组小鼠按10 mg/kg灌胃给予奥利司他,依据文献报道[1,15,16]并结合我们的前期预实验研究结果EGCG-L和EGCG-H组分别按20、40 mg/kg灌胃给予EGCG,而正常和模型组则灌胃给予同体积的生理盐水,每天1次连续8周,各组的饲料喂养不做改变见图1。
1.3.2 标本收集与处理
各组小鼠在给药8周后禁食不禁水12 h,水合氯醛麻醉后摘除眼球取血,抗凝后分离血浆,保存于-80 ℃备生化指标检测;取肝脏称肝脏质量,用预冷生理盐水漂洗后剪取相同部位的肝组织用 4%多聚甲醛固定,用于组织形态学分析;余下的肝组织保存于-80 ℃用着氧化应激指标和分子生物学检测。
1.3.3 血液生化分析
取血浆,按试剂盒说明书介绍的方法检测血液中GOT、GPT、TG、TC、FFA、HDL-C、LDL-C和UA的活性及含量。
1.3.4 血液GLU、胰岛素、瘦素和脂联素水平测定
取血浆,按试剂盒说明书介绍的方法检测血液中GLU、胰岛素、瘦素和脂联素含量。
1.3.5 肝组织脂质水平和氧化应激指标测定
取肝组织,用生理盐水制成10%匀浆后,离心,取上清液,检测肝组织中FFA、TG、TC、HYP、HDL-C、LDL-C、MDA、SOD、GSH-Px和CAT含量及活性。具体方法按照试剂盒说明书进行。
1.3.6 肝形态学分析
取用 4%多聚甲醛中固定后的肝组织、用乙醇梯度脱水、石蜡包埋后,切片,H&E染色后光镜下观察;余下肝组织用着分子生物学检测。
1.3.7 实时定量 PCR检测小鼠肝组织AMPK/SIRT1/SREBP-1c/PPARγ信号通路信号通路mRNA表达量检测
取肝组织,按照试剂盒说明书介绍的方法提取RNA,测定其纯度和浓度;在 42 ℃ 2 min、37 ℃ 15 min和85 ℃ 5 s条件下逆转录成cDNA后,在25 μL体系中,按照95 ℃预变性30 s、95 ℃变性5 s、58 ℃退火30 s和72 ℃延伸30 s,40个循环条件下进行AMPKα、SIRT1、FASN、ACC-1、SREBP-1c、SCD-1、PPARγmRNA表达分析。
1.3.8 Western blotting检测小鼠肝组织AMPK/SIRT1/SREBP-1c/PPARγ信号通路信号通路蛋白表达量检测
取肝组织,提取总蛋白,测定蛋白浓度后,取等量蛋白进行Western blotting检测p-AMPKα、AMPKα、SIRT1、FASN、p-ACC-1、ACC-1、p-SREBP-1c、SREBP-1c、SCD-1和PPARγ蛋白表达。
1.4 统计学分析
实验结果用均数±标准差(±s)表示,在SPSS 21.0和Graph Pad Prism 6.01软件上进行数据分析;组间比较用 T-test,多组间比较用单因素方差分析;p<0.05被认为组间具有统计学差异。
2 结果与讨论
2.1 EGCG对NAFLD小鼠体质量、肝质量和肝质量指数的影响
饮食结构和遗传因素,尤其是长期高脂饮食,它不仅可以引起体质量上升、肝质量和肝质量指数增加,引起肝脂肪变性,进而导致 NAFLD的发生[1]。本实验通过高脂饮食建立NAFLD ApoE-/-小鼠模型,模拟NAFLD的发生发展过程,其结果接近临床上成人NAFLD的病理生理改变。由图2可知,NAFLD模型组小鼠的体质量、肝质量和肝质量指数均明显增加,与正常组比较具有显著性差异(p<0.05或p<0.01);用EGCG治疗8周后,小鼠体质量、肝质量、肝质量指数较模型组显著降低至 110.98%、115.01%,115.64%、136.48%和 104.20%、118.70%,与模型组比较,具有统计学意义(p<0.01);其中 EGCG-H 作用效果强于奥利司他(p<0.05或p<0.01)。上述结果提示,对NAFLD模型组小鼠使用EGCG干预后,可较好地降低体质量、肝质量和肝质量指数,进而防治肝脂肪变性和NAFLD的发生。

图2 EGCG对NAFLD小鼠体质量、肝质量和肝质量指数的影响Fig.2 Effects of EGCG on body weight, liver mass and liver mass index in NAFLD mice
2.2 EGCG对NAFLD小鼠肝功能的影响
GOT、GPT、UA和HYP等是评估肝损伤的重要的生物标志物,它们在血液或肝组织中活性或含量升高是临床医生分析NAFLD发展与演变过程的重要依据,同时也是 NAFLD重要的临床诊断指标之一[6]。在本研究中,我们观察到模型小鼠血液中GOT、GPT活性、UA含量和肝组织中HYP含量升高了153.11%、168.81%、166.58%和207.78%,与正常组比较均具有显著性差异(p<0.01),实验结果表明NAFLD模型小鼠出现了肝功能不全;而用EGCG(20、40 mg/kg)治疗后,GOT、GPT活性和UA、HYP含量分别降低至116.71%、129.66%,115.34%、136.85%,112.45%、133.31%和114.94%、153.36%,与模型组比较具有显著性差异(p<0.05或p<0.01)。研究证实EGCG可有效降低肝损伤GOT、GPT、UA和HYP生物标志物,表明 NAFLD小鼠经 EGCG治疗后肝功能得到改善(表2)。此研究与熊海容等[17]研究结果相似。

表2 EGCG对NAFLD小鼠脂和糖代谢及生化指标的影响Table 2 Effects of EGCG on lipid, glycid metabolisms and biochemical indexes of NAFLD mice
2.3 EGCG对NAFLD小鼠脂质代谢的影响
虽然目前NAFLD的发病机制并未完全明确,但已有研究表明,当某种原因引起胰岛素抵抗导致脂代谢异常时,肝脏中FFA大量储积,LDL-C合成与分泌发生障碍,从而导致肝脏中TG、TC增加,肝细胞发生脂肪变性,导致NAFLD的启动;同时FFA浓度升高可以刺激高活性反应分子性氧簇和活性氮簇生成增多,从而启动氧化应激机制,进一步促进NAFLD发展,因此 FFA诱导下的脂代谢异常(如 TG、TC、LDL-C、FFA水平升高,HDL-C降低)被认为是导致肝脂肪变性的重要促发因素[18,19]。基于此,我们分别检测了血液和肝匀浆中的脂质水平(表2)。与正常组比较,模型组血液和肝匀浆TG水平升高165.41%和275.89%、TC水平升高273.32%和621.92%、FFA水平升高254.85%和371.89%、LDL-C水平升高167.52%和 441.73%、LDL-C/HDL-C比值升高 380.04%和1499.24%,HDL-C水平降低 227.03%和 333.29%(p<0.01),与Gan 等[1]研究结果相似;用EGCG(20、40 mg/kg)治疗后,血液和肝匀浆 TG水平下降112.08%、138.14%和116.28%、183.54%,TC水平下降114.78%、177.74%和113.09%、182.56%,FFA水平下降 116.12%、161.73%和 122.68%、172.48%,LDL-C水平下降 113.53%、133.93%和 116.42%、177.27%,LDL-C/HDL-C比值下降139.92%、233.64%和135.28%、400.78%,HDL-C水平升高123.69%、174.34%和114.78%、222.19%,与模型组比较具有显著性差异(p<0.05或p<0.01);其中EGCG-H作用效果明显强于奥利司他(p<0.05或p<0.01)。结果表明,EGCG对NAFLD小鼠血液或肝匀浆中的TG、TC、FFA、LDL-C、HDL-C及LDL-C/HDL-C比值均具有较好改善作用。
2.4 EGCG对NAFLD小鼠糖代谢的影响
众所周知NAFLD的发病被认为是胰岛素抵抗相关性代谢综合征在肝脏的表现[20]。NAFLD患者由于脂代谢异常,导致血液中瘦素持续升高,使瘦素受体敏感性降低,出现正常脂肪-胰岛素轴正常的反馈机制破坏,引起胰岛β细胞持续去极化、胰岛素分泌增加,导致高瘦素和胰岛素血症;由于脂联素是参与调控胰岛素分泌的重要信号途径,其分泌的减少会使肝脏氧化分解和摄取 GLU能力减弱,导致血液中 GLU和FFA含量升高。由此可见,NAFLD患者的高血脂是导致高瘦素、低脂联素血症的重要诱因,而高胰岛素血症又加速了这一进程,从而形成脂质和糖代谢彼此相互侵扰,进而参与脂肪肝的形成,脂肪肝本身又能加剧胰岛素抵抗、促进胰岛素的分泌,形成了恶性循环[21]。如表2所示,模型组血液中瘦素、胰岛素和GLU含量升高到320.60%、147.00%和154.37%,脂联素降低至 316.79%,与正常组比较均具有显著性差异(p<0.01);用EGCG(20、40 mg/kg)治疗后,血液中瘦素、胰岛素和GLU含量分别降低了23.20%、139.69%,48.14%、76.52%和32.39%、61.10%,脂联素升高了11.85%、43.78%,与模型组比较具有显著性差异(p<0.05或p<0.01)。此研究也与 Gan等人[1]报道相一致。
2.5 EGCG对NAFLD小鼠肝组织中内源性抗氧化酶活性的影响
氧化应激是NAFLD发生发展的主要因素,过多的氧自由基可加重脂肪变性,促进炎症反应及造成肝细胞凋亡,导致肝损伤。因此,肝细胞的氧化损伤被认为是诱发NAFLD的重要因素之一[22]。内源性抗氧化酶SOD、GSH-Px、CAT可促进H2O2转化为H2O和O2,使O2-·、H2O2、OH·等自由基经过歧化而被清除,使机体免受自由基的损伤,从而减少脂质过氧化产物 MDA的生成及对肝细胞膜的脂质过氧化损伤,因此肝组织MDA含量可间接反映肝细胞受自由基攻击的严重程度[23,24]。在实验中,我们发现模型组小鼠肝组织中SOD、GSH-Px、CAT活性下降了109.11%、125.77%、146.49%,MDA含量升高了703.8%,与正常组比较均具有显著性差异(p<0.01);与Chen等[14]研究结果相似,用EGCG(20、40 mg/kg)治疗后,SOD、GSH-Px、CAT活性升高了 17.49%、69.41%,12.62%、35.44%和17.98%、54.82%,MDA含量降低了20.65%、86.06%,与模型组比较具有显著性差异(p<0.05或p<0.01);有趣的是EGCG-L和EGCG-H作用效果均强于阳性药奥利司他(p<0.05或p<0.01)。结果提示增强内源性抗氧化系统功能是其防治NAFLD的重要特征之一(图3)。

图3 EGCG对NAFLD小鼠肝组织中内源性抗氧化酶活性的影响Fig.3 Effect of EGCG on endogenous antioxidant enzyme activity of liver tissue in NAFLD mice
2.6 EGCG对NAFLD小鼠肝组织形态学的影响
NAFLD是一种病变主体在肝小叶,以肝细胞脂肪变性和脂肪储积为病理特征但无过量饮酒史的临床综合征,其发病由包括脂代谢异常、氧化应激、炎症等在内的多种因素所致,上述病理在肝脏形态学中均有所体现[25]。在实验中,苏木精-伊红(H&E)染色显示的结果显示与正常组相比,模型组小鼠肝组织可见肝细胞脂肪变性、气球样变性、小叶炎症、点状局灶性坏死及大量的大脂肪滴积聚,这与Chyau等人[6]报道的结果相一致。肝组织形态学结果分析显示,ApoE-/-小鼠 NAFLD 模型成功建立。EGCG(20、40 mg/kg)治疗后肝细胞脂肪变性、脂肪空泡和炎性细胞浸润得到了显著的改善,而奥利司他仅可部分缓解这些病变(图4)。
2.7 EGCG对NAFLD小鼠肝组织AMPK/SIRT1/SREBP-1c/PPARγ信号通路mRNA和蛋白表达的影响
AMPK是能量代谢调控的关键分子,在细胞内蛋白激酶等作用下,其α亚基第172位苏氨酸被磷酸化(p-AMPKα)来抑制各种合成代谢途径,减少细胞内ATP的消耗;同时也可刺激分解代谢途径,增加胞内ATP产生,以恢复能量的稳态[26]。此外,p-AMPKα还可通过增加细胞内 NAD+水平来增强 SIRT1的活性,进一步导致其下游靶分子/底物,如过氧化物酶体增殖物激活受体γ-辅活化因子-1α、ACC-1等磷酸化和失活,来调控葡萄糖代谢、脂肪酸氧化及减少氧化应激和炎症反应[27]。近年来 AMPK/SIRT1通路在NAFLD发病中的作用也逐渐引起重视。研究表明AMPK作为调节细胞能量代谢的感受器,可以增强胰岛素的敏感性,减少肝糖的输出、并以磷酸化的形式抑制脂肪酸的合成和增强线粒体对脂肪酸的利用和氧化,来实现对下游基因转录的调节功能[27,28],SIRT1是一种依赖于 NAD+的去乙酰化酶,可促使多种蛋白质的赖氨酸残基发生去乙酰化,促进体内脂类物质的动员,并参与肝脏糖异生,同时影响着胰岛素的分泌功能[27,29]。由此可见,AMPK/SIRT1通路在糖脂质代谢中起着重要作用。在本研究中,与正常组比较NAFLD模型小鼠肝组织中AMPKα、SIRT1 mRNA表达及p-AMPKα、SIRT1蛋白表达和p-AMPKα/AMPKα比率明显分别降低了178.42%、196.38%,742.85%、234.34%和 704.69%(p<0.01);与 Chyau等[6]研究结果相似;用EGCG(20、40 mg/kg)治疗后,AMPKα、SIRT1 mRNA表达及p-AMPKα、SIRT1蛋白表达和p-AMPKα/AMPKα比率分别升高了14.97%、64.81%,13.21%、68.78%,40.24%、75.82%,16.18%、67.40%和 39.20%、78.18%,与模型组比较具有显著性差异(p<0.05或p<0.01);其中EGCG治疗效果明显强于奥利司他(p<0.05 或p<0.01)(图5a~b 和图6a~d)。
SREBP-1c属于“碱性螺旋-环-螺旋-亮氨酸拉链”超家族的一员,主要在肝细胞和脂肪细胞表达,是参与脂肪合成基因的主要转录调节因子,主要与脂肪酸和糖代谢有关,它调节的靶基因包括FASN、ACC-1、SCD-1等。在NAFLD时,失活AMPK降低了胰岛素的敏感性,使得肝糖的输出增加,导致SREBP-1c表达异常增高,进而上调多个FASN生成相关酶,比如ACC-1、FASN、SCD-1的基因表达,从而使FFA和TG的合成增加,导致肝脏内脂质合成增加、脂质蓄积[30]。PPARγ是脂肪细胞基因表达和胰岛素细胞信号间传递的主要调节者,它对脂肪细胞的增生和分化起着正向调节作用;此外它还在介导脂肪酸氧化及脂质代谢中起重要的作用[31]。当肝细胞由于脂类沉积诱发脂肪变性后,肝脏中的PPARγ表达便会显著升高,大量PPARγ表达促使脂质合成基因的激活,导致肝脏更多脂质的沉积[32]。类似的证据也表明,在患有NAFLD的肥胖患者的肝脏中上调 SREBP-1c表达及其激活FASN、ACC-1、SCD-1在PPARγ作用下,促进参与脂肪酸吸收、结合和转运的基因参与脂质代谢,增加从头脂肪酸生物合成、触发肝脏脂肪变性,从而导致NAFLD发生发展[33-35]。我们的结果发现NAFLD模型小鼠肝组织中 FASN、ACC-1、SREBP-1c、SCD-1、PPARγmRNA表达及FASN、p-ACC-1、p-SREBP-1c、SCD-1、PPARγ蛋白表达和 p-ACC-1/ACC-1、p-SREBP-1c/SREBP-1c比率升高了72.89%、73.78%、72.83%、69.19%、73.37%及62.13%、79.72%、73.54%、76.52%、73.50%及 80.30%、74.71%,与正常组比较具有显著性差异(p<0.01),与Chyau等[6]研究结果相似;用EGCG(20、40 mg/kg)治疗后,FASN、ACC-1、SREBP-1c、SCD-1、PPARγmRNA 表达及 FASN、p-ACC-1、p-SREBP-1c、SCD-1、PPARγ蛋白表达和p-ACC-1/ACC-1、p-SREBP-1c/SREBP-1c比率明显降低,与模型组比较具有显著性差异(p<0.05或p<0.01);其中 EGCG治疗效果明显强于奥利司他(p<0.05或p<0.01)(图5c~g 和图6e~k)。
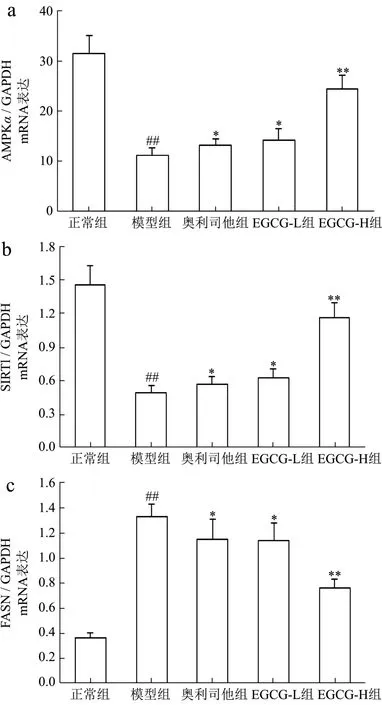

图5 EGCG对NAFLD小鼠肝组织AMPK/SIRT1/SREBP-1c/PPARγ信号通路mRNA表达的影响Fig.5 Effect of EGCG on the mRNA expressions of AMPK/SIRT1/SREBP-1c/PPARγ signaling pathway of liver tissue in NAFLD mice
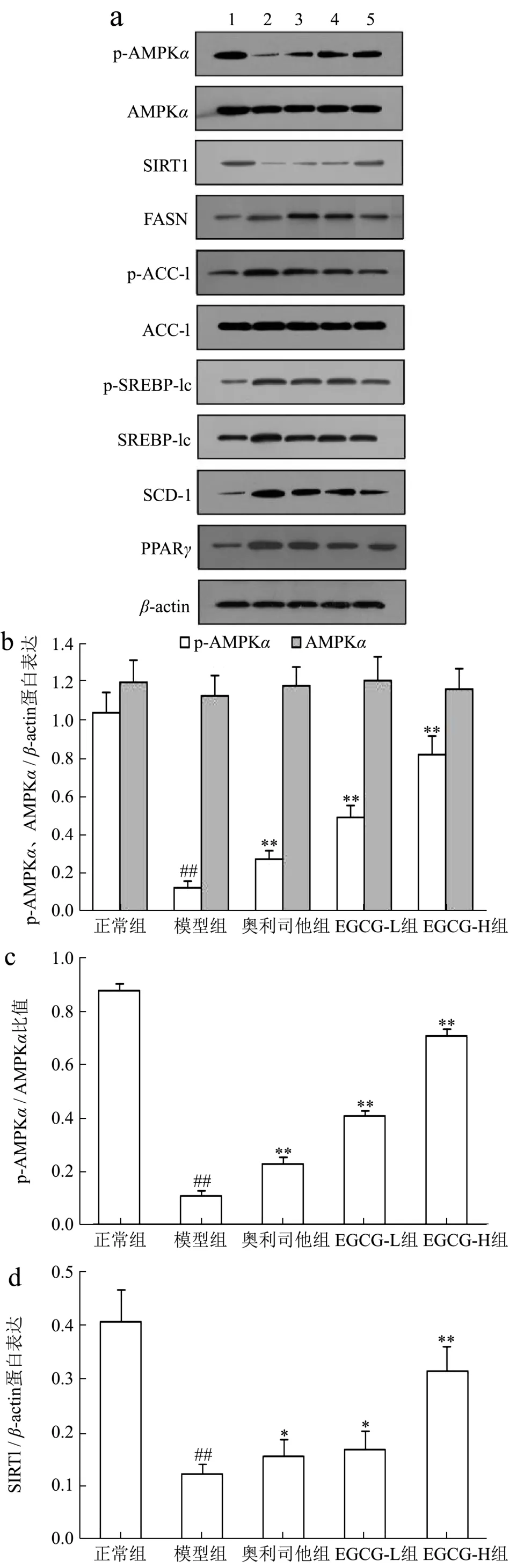
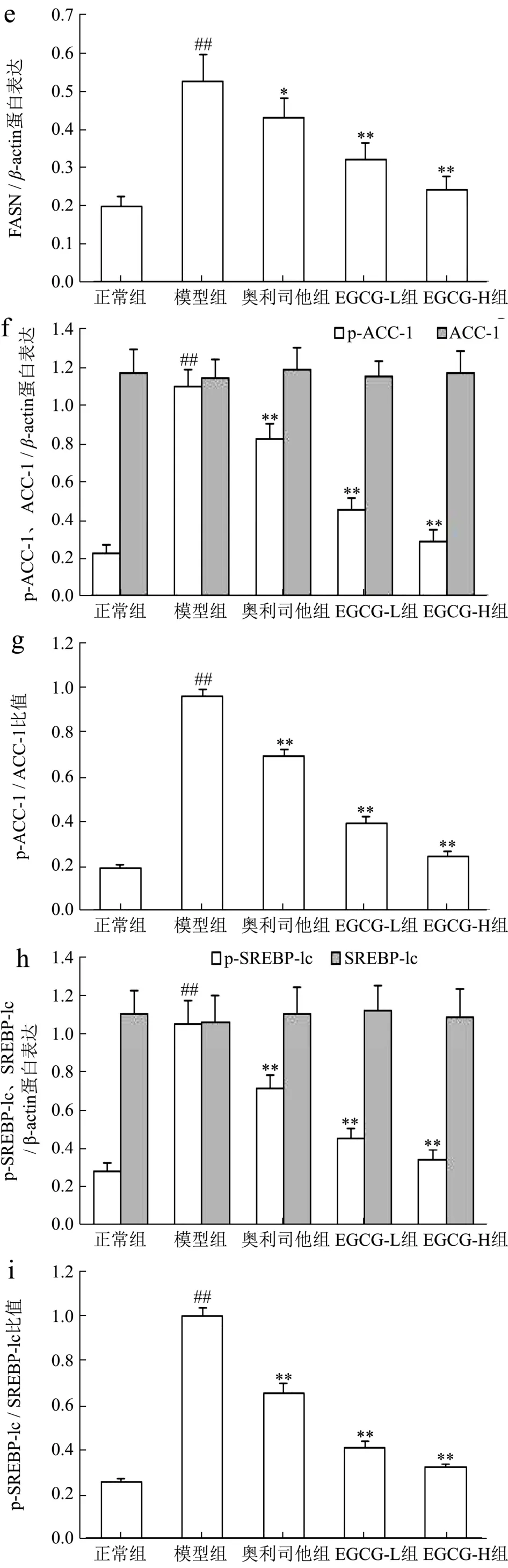

图6 EGCG对NAFLD小鼠肝组织AMPK/SIRT1/SREBP-1c/PPARγ信号通路蛋白表达的影响Fig.6 Effect of EGCG on the protein expressions of AMPK/SIRT1/SREBP-1c/PPARγ signaling pathway of liver tissue in NAFLD mice
3 结论
NAFLD已经成为世界范围内的第一大肝病,其危害不仅可以进展为非酒精性脂肪肝炎、肝硬化、肝细胞癌,而且是代谢综合征的重要组分和与心脑血管疾病密切相关,患者常常伴随血脂异常、糖脂代谢紊乱、炎症和氧化应激。本研究发现NAFLD模型组的小鼠体质量、肝质量、肝质量指数、血液中 GOT、GPT、TG、TC、LDL-C、FFA、GLU、瘦素、胰岛素水平和肝组织中UA、HYP、MDA水平均明显高于正常组,血液中HDL-C、脂联素水平和肝组织中SOD、GSH-Px、CAT活性均明显低于正常组;H&E染色发现NAFLD模型小鼠肝组织出现肝细胞脂肪变性、气球样变性、小叶炎症、点状局灶性坏死及大量的大脂肪滴积聚,实验提示NAFLD模型成功建立。EGCG治疗后上述异常的血脂、紊乱的糖脂代谢和肝脏组织病理学变化均得到了明显改善;实时定量 PCR和Western blotting检测结果进一步表明EGCG可通过调控AMPK/SIRT1/SREBP-1c/PPARγ信号通路相关基因的表达来调节参与脂肪酸和葡萄糖吸收、结合和转运的基因参与糖脂代谢、脂肪酸氧化,抑制从头脂肪酸生物合成、减少氧化应激和炎症反应,从而遏制NAFLD发生发展。本研究为EGCG防治NAFLD提供了新的实验依据与防治思路。

