基于SHIME研究橘皮汤对肠道菌群结构的影响
罗玉霜,伍静仪,刘世锋,康信聪,王蕾,张志旭,4,刘东波,4,5
(1.湖南农业大学园艺学院,湖南长沙 410128)(2.国家中医药管理局亚健康干预技术实验室,湖南长沙 410128)(3.长沙能峰生物科技有限公司,湖南长沙 410128)(4.植物功能成分利用省部共建协同创新中心,湖南长沙410128)(5.湖南作物种质创新与资源利用重点实验室,湖南长沙 410128)
肠道是人体巨大的微生态系统,定植于肠道的微生物集合统称为肠道菌群[1]。正常情况下,肠道各菌属组成及数量处于健康的平衡状态,形成与人体密不可分的互利共生关系,从而维持宿主正常的营养物质转化、能量代谢、免疫功能等。若菌群结构改变或失调,即肠道内益生菌减少、致病菌增加,即引起机体代谢紊乱,导致糖尿病等多种疾病的发生[2]。目前国内外对药物与肠道菌群的相互作用研究已成为热点。橘皮汤首载于《金匮要略》,由陈皮、生姜组成,其主要成分为橙皮苷、川陈皮素及6-姜酚,常用于治疗胃中寒冷、呕吐恶心、呃逆嗳气[3]。杨志宏等[4]发现橘皮汤可对抗化疗后所致的恶心与呕吐。姜明旭等[5]发现服用橘皮汤配以针刺对治疗颅脑术后顽固性呃逆有显著疗效。现代医学研究认为,胃肠道消化系统与呕吐、呃逆、嗳气等症状直接相关。而目前对橘皮汤的研究主要集中在生姜、陈皮及其组方的药物动力学及临床降逆止呕功能方面,对橘皮汤作为药食同源的中药食材在胃肠道中影响的研究较少。
SHIME[6-8](Simulator of human intestinal microbial ecosystem)系统是比利时根特大学设计的人体肠道微生态系统模拟装置,是一种人体体外胃肠道微生态模拟系统,包括模拟消化系统、蠕动泵系统、温度控制系统、pH调节系统。由于能够有效模拟人体的消化及肠道微生态环境,从而受到越来越多研究者的关注,如Katia Sivieri利用SHIME评估新鲜橙汁和巴氏杀菌橙汁对肠道菌群及短链脂肪酸的影响[9];Ana M.Rovalino-Córdova利用SHIME研究豆类结构对微生物群利用植物营养素的影响[8];Lei Liu利用SHIME研究万古霉素对肠道菌群的致病作用[10]等。肠道菌群影响机体的主要方式之一是产生短链脂肪酸,短链脂肪酸是肠道菌群发酵膳食纤维的终产物,是碳原子数为1~6溶于水的游离脂肪酸,是微生物自身及宿主肠上皮细胞的能量来源,促进细胞生长,抑制有害菌的生长[11]。本研究基于SHIME系统,通过16S rRNA高通量测序技术分析橘皮汤对肠道菌群的影响,通过气相色谱技术分析橘皮汤对肠道菌群代谢产物短链脂肪酸的影响。为橘皮汤的食疗功能提供有效的数据支持,及其保健品的开发提供参考。
1 材料与方法
1.1 仪器与试剂
1.1.1 仪器
XS205十万分之一分析天平,德国 METTLER TOLEDO公司;QL-901 Vortex涡混仪,海门市其林贝尔仪器制造有限公司;2-16R高速冷冻离心机,湖南恒诺仪器设备有限公司;GC-2010气相色谱仪,日本岛津公司;LDZX-75KBS立式压力蒸汽灭菌器,上海申安医疗器械厂;PL403分析天平,METTLER TOLEDO;双列六孔水浴锅与SHIME系统,北京佳德精密科技有限公司。
1.1.2 试剂
阿拉伯半乳聚糖、木聚糖、胰蛋白酶、生物素、泛酸盐、烟酰胺、硫胺、甲萘醌、对-氨基苯甲酸,上海源叶生物科技有限公司;淀粉、葡萄糖、半胱氨酸、碳酸氢钠、吐温80、氯化钠、磷酸氢二钾、氯化钙、七水硫酸镁、一水硫酸锰、七水硫酸铁、七水硫酸钴、七水硫酸锌、五水硫酸铜、硫酸铝钾、硼酸、钼酸钠、氯化镍、亚硒酸钠、维生素B12、氯化钠、胃蛋白酶、36.5%浓盐酸、氢氧化钠、碳酸氢钠,国药集团化学试剂有限公司;酵母浸出粉,上海盛思生化科技有限公司;细菌学蛋白胨,广东环凯微生物科技有限公司;果胶,河南三化生物科技有限公司;血红素、PBS固体粉末(BOMEI),猪胆盐,麦克林。
标准品:乙酸(批号:J1811168)、丙酸(批号:G1827115)、正丁酸(批号:50504)、异丁酸(批号:D1713230)、正戊酸(批号:H1822061)、异戊酸(批号:K1813199)、己酸(批号:E1811088)、2-乙基丁酸(批号:C10506873)、共计8个,正丁酸,上海源叶生物科技有限公司;乙酸、丙酸、异丁酸、正戊酸、异戊酸、己酸、2-乙基丁酸,上海阿拉丁生化科技股份有限公司。
1.2 食材
生姜,长沙滨湖大市场;陈皮,养天和大药房。
1.3 方法
1.3.1 橘皮汤的制备
称取生姜10 g,陈皮5 g,以6倍量的蒸馏水,加热回流提取2 h,趁热过滤;药渣再以6倍量的蒸馏水加热回流提取2 h。合并提取液,置4 ℃冰箱保存备用。
1.3.2 模拟消化方法
系统模拟实验方法包括:系统时间、速度及其他参数设定,粪便接种液制备,肠道微生态的增值和稳定,胃和小肠消化液、营养液制备,以及模拟消化步骤[12,13]。
消化液及食物营养液制备:消化液的制备为胃液和胰液的配置与储存。胃液的配置方法:准确称取2.0 g NaCl、3.2 g胃蛋白酶以及7 mL 36.5%浓盐酸,无菌蒸馏水定容至 100 mL。胰液的配置方法:准确称取6.0 g胆汁盐、0.9 g胰蛋白酶、12.5 g碳酸氢钠,无菌蒸馏水定容至1000 mL。配置好的消化液贴好标签置于4 ℃冰箱保存。
食物营养液的制备为基础营养液、微量元素液、维生素液的配置与储存。基础营养液配置方法:称取3.0 g淀粉、0.4 g葡萄糖、2.0 g果胶、1.0 g阿拉伯半乳聚糖、1.0 g木聚糖、3.0 g酵母提取物、0.4 g碳酸氢钠、4.0 g蛋白胨、0.5 g半胱氨酸、1 mL吐温80,无菌蒸馏水定容至1000 mL。微量元素①液配置方法称:取1.0 g磷酸氢二钾、0.125 g血红素、2.0 g氯化钠、0.2 g氯化钙、0.2 g七水合硫酸镁,无菌蒸馏水定容至250 mL。微量元素②液配置方法:称取0.1 g硼酸、0.1 g亚硒酸钠、5.0 g二水合硫酸锰、1.0 g硫酸钴、0.1 g钼酸钠、1.0 g六水合氯化镍、0.1 g硫酸铝、0.1 g五水合硫酸铜、1.0 g硫酸锌、1.0 g七水合硫酸铁,无菌蒸馏水定容至100 mL。维生素液配置方法:称取0.25 g烟酰胺、0.2 g硫胺、0.25 g对-氨基苯甲酸、0.025 g维生素B12、0.5 g泛盐酸、0.05 g甲萘醌、0.1 g生物素,无菌蒸馏水定容至50 mL。配置好的食物营养液贴好标签置于4 ℃冰箱保存待用。基础营养液与微量元素液以及维生素液按照体积比 1000:10:10:1混合成食物营养液。
粪便接种液的制备:采集1名年龄在20~35岁,并且在过去半年未使用抗生素药物的健康宿主。称取新鲜粪便50 g加入250 mL接种液(无菌PBS缓冲液0.1 M,pH=7.4),涡混仪上混匀5 s,静置10 min取上层液在冷冻离心机中于 4 ℃、1000 r/min离心 10 min,取离心后的上层液置于50 mL离心管中,贴好标签后置于-80 ℃冰箱保存。
肠道微生物的定植:在SHIME系统模型的升结肠、横结肠、降结肠中分别加入540 mL、864 mL、540 mL的食物营养液及60 mL、96 mL、60 mL的粪便接种液,在 37 ℃恒温水浴、磁力搅拌器搅拌下厌氧培养36 h,并用盐酸(0.05 mol/L)和氢氧化钠(0.1 mol/L)将升结肠、横结肠、降结肠模拟罐的pH值分别保持在 5.5~6.0,6.0~6.4,6.5~6.9之间。培养期间每6 h,通氮气10 min,保证定植过程的厌氧环境。
SHIME系统模拟消化步骤:定植成功后,模拟东方人进食习惯分别在每天9:00、15:00、21:00进料,每次加入食物营养液的量为260 mL(干预期时为早上9:00进食以140 mL混合营养液与120 mL的橘皮汤共260 mL混合后再加入),进料完毕后立即泵入10 mL左右胃液,使胃模拟罐的pH稳定于2.0~2.3之间。料液和胃液混合并在胃模拟罐中反应2 h后全部泵入小肠模拟罐,同时开启控制胰液蠕动泵泵入120 mL胰液,使小肠模拟罐pH保持在6.6~7.0之间,4 h后小肠模拟罐到升结肠模拟罐的蠕动泵开启,料液全部泵入升结肠模拟罐,用盐酸(0.05 mol/L)和氢氧化钠(0.1 mol/L)调节pH在5.5~6.0之间,发酵6 h后升结肠模拟罐蠕动泵开启,泵出400 mL消化液至横结肠,用盐酸(0.05 mol/L)和氢氧化钠(0.1 mol/L)调节pH在6.0~6.4之间,消化液在横结肠发酵6 h后将其蠕动泵开启,泵出400 mL消化液至降结肠,用盐酸(0.05 mol/L)和氢氧化钠(0.1 mol/L)调节pH在 6.5~6.9之间,再发酵6 h后将其蠕动泵开启,泵出400 mL废液至废液桶。每个模拟罐中放入磁力搅拌子,经磁力搅拌器驱动搅拌子旋转来模拟胃肠道的蠕动;每次进食后向模拟罐中通入 10 min氮气来模拟实现胃肠道中的无氧环境,氮气由外部氮气罐经由导管通过密封盖上的微孔进入胃模拟管,再经由降结肠模拟罐排出废液的导管排出。
SHIME系统模拟包括三个时期,为肠道菌群定植稳定期、橘皮汤干预期、橘皮汤干预后的维持期。稳定期与维持期每餐进料只有食物营养液,持续5 d;干预期每天早上进料含有食物营养液与橘皮汤,中午与晚上喂食只有食物营养液,持续3 d。
样品:取稳定期、干预期、维持期最后一天升结肠、横结肠、降结肠模拟罐消化前后消化液为样品。
1.3.3 16 S rRNA高通量测序技术分析消化液样品中微生物的多样性
采用Nanodrop对总DNA进行定量,样品上样量为5 μL,电泳时间为20 min,并通过1.2%琼脂糖凝胶电泳检测DNA的质量。使用紫外分光光度检测测得 OD260/OD280(即核酸吸收的最高峰/蛋白吸收的最高峰)在2.0左右,纯度符合要求。PCR扩增对样品DNA的16S rRNA可变区V3-V4进行PCR扩增,前引物序列为ACTCCTACGGGAGGCAGCA,后引物序列为GGACTACHVGGGTWTCTAAT。扩增成功后,制备测序文库,基于Illumina Novaseq-PE250平台对样品进行高通量测序,PCR扩增及测序工作由上海派森诺生物科技股份有限公司完成。
1.3.4 短链脂肪酸含量的测定
1.3.4.1 GC分析条件
DB-FATWAX UI(30 m×0.250 mm×0.25 μm)毛细管色谱柱,载气为高纯氮气,柱流量1.5 mL/min,升温程序为[10]:初始温度 70 ℃,保持 1 min,以15 ℃/min升至160 ℃,保持6 min,再以30 ℃/min升至210 ℃,保持5 min;进样口温度250 ℃,检测器温度250 ℃,分流比19:1,进样量0.5 μL。
1.3.4.2 标准品溶液制备
对8个短链脂肪酸混合标准溶液的制备,精密称量乙酸20.9 mg、丙酸19.9 mg、异丁酸9.5 mg、丁酸10.1 mg、异戊酸9.2 mg、戊酸10.0 mg、己酸9.3 mg、2-乙基丁酸9.6 mg,并用1%甲酸水定容至10 mL,制成混合标准品母液,将母液稀释1、2、5、10、100、500、100倍后过0.45 μm水膜,置4 ℃冰箱存放备用。
1.3.4.3 样品溶液制备
取2 mL消化液至离心管中,加入1%甲酸水[14],涡混仪上混匀30 s,加入1 μL内标(2-乙基丁酸),混匀,再以8000 r/min离心10 min,移取上清液过0.45 μm水膜进行气相色谱分析。
1.3.4.4 数据处理
实验结果以平均值±标准差(±s)表示,组间比较用t检验,p<0.05为差异有统计学意义。
2 结果与讨论
2.1 测序数据和聚类分析
细菌 16S rDNA高通量测序得到有效序列量有1370867条,高质量序列量有1029466条。在97%相似度标准下聚类分析,共得到7334个OTU,其相对应的OTU数目见图1。结果显示在升结肠与横结肠中稳定期的OTU数目最多分别为475和1012,在降结肠中干预期的OTU数目最多为1262,说明在升结肠与横结肠中稳定期肠道菌群的种类更丰富,在降结肠中干预期肠道菌群的种类更丰富,经过橘皮汤干预后肠道菌群种类有所减少。
为进一步比较样本间的物种组成差异,实现对各样本的物种丰度分布趋势的展示,使用热图进行物种组成分析。结果如图2所示,巨单胞菌属(Megamonas)在维持期升结肠丰度最高,双歧杆菌属(Bifidobacterium)在稳定期升结肠丰度最高,不动杆菌属(Acinetobacter)在维持期横结肠丰度最高,拟杆菌属(Bacteroides)稳定期降结肠丰度最高,韦荣氏球菌属(Veillonella)在稳定期升结肠丰度最高,克雷伯菌属(Klebsiella)在稳定期降结肠丰度最高,萨特氏菌属(Sutterella)在干预期升结肠丰度最高,代尔夫特菌属(Delftia)在维持期降结肠丰度最高。经橘皮汤干预后巨单胞菌属、不动杆菌属、萨特氏菌属及代尔夫特菌属等菌属丰度升高,拟杆菌属、韦荣氏球菌属及克雷伯菌属等菌属丰度降低。
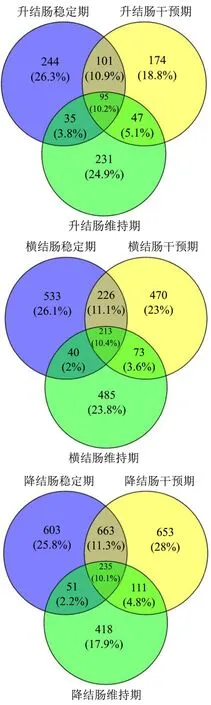
图1 OTU分布韦恩图Fig.1 Venn diagram showing the distribution of OTU
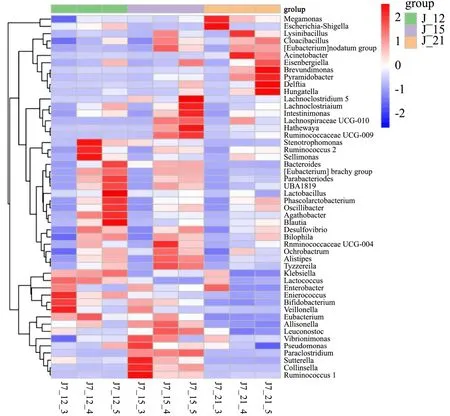
图2 物种聚类的属水平物种组成热图Fig.2 Species composition thermogram at genus level based on species clustering
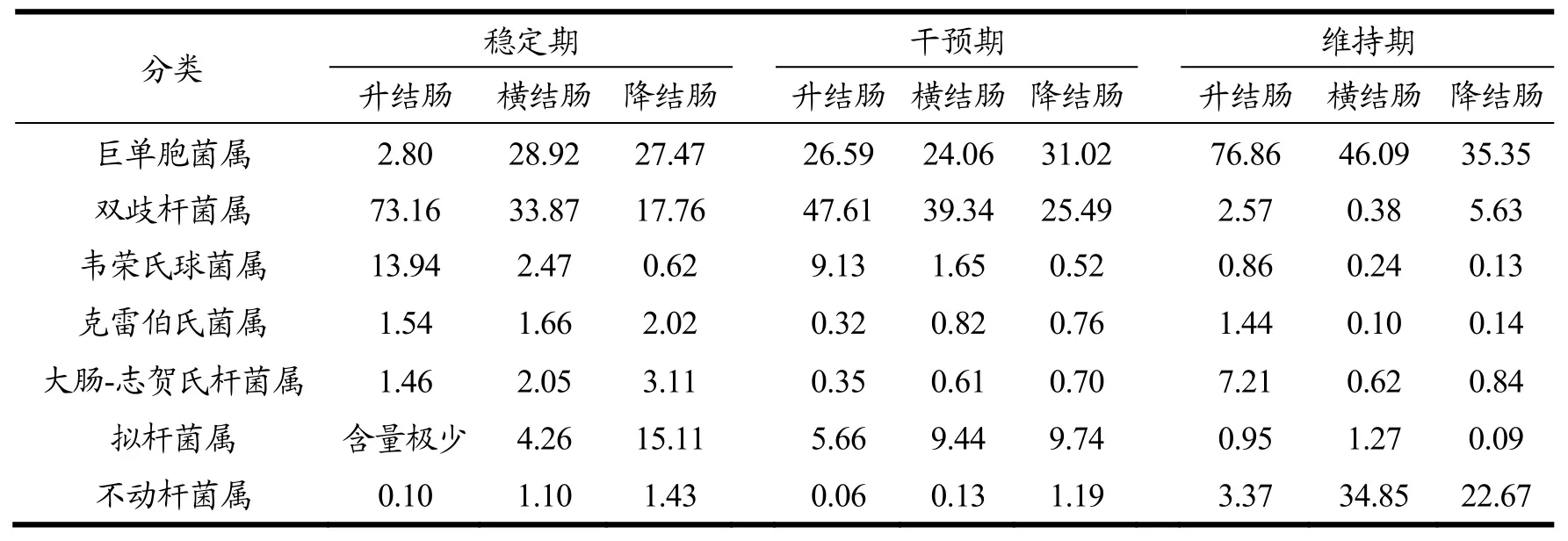
表1 微生物区系属水平相对丰度(%)分布Table 1 Relative abundance (%) distribution of microflora at genus level
2.2 消化液样品中的细菌物种鉴定及菌群结构分析
门水平物种组成柱状图如图3所示。优势菌群为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)及放线菌门(Actinobacteria)。经橘皮汤干预后,厚壁菌门的相对丰度增加,放线菌门的相对丰度减少。
属水平分布如表1所示,三个时期不同结肠菌群的差异较大。经橘皮汤干预后,巨单胞菌属相对丰度在干预期升高了27.5%、在维持期升高了62.61%;韦荣氏球菌属相对丰度在干预期下降了33.65%、在维持期下降了92.78%,克雷伯菌属相对丰度在干预期下降了63.60%、在维持期下降了67.82%;双歧杆菌属在维持期下降明显,大肠-志贺氏杆菌属(Escherichia-Shigella)在干预期明显下降,Bacteroides拟杆菌属在维持期明显下降,不动杆菌属在维持期显著上升。
属水平物种组成柱状图如图4所示。升结肠、横结肠、降结肠共有的菌属有巨单胞菌属、双歧杆菌属、大肠-志贺氏杆菌属、韦荣氏球菌属、不动杆菌属、萨特氏菌属、克雷伯菌属及拟杆菌属。总体来说放线菌门的双歧杆菌属和厚壁菌门中的巨单胞菌属在相对丰度上占优势。

图3 门水平物种组成柱状图Fig.3 Histogram of species composition at phylum level

图4 属水平物种组成柱状图Fig.4 Histogram of species composition at genus level
2.3 Alpha多样性分析
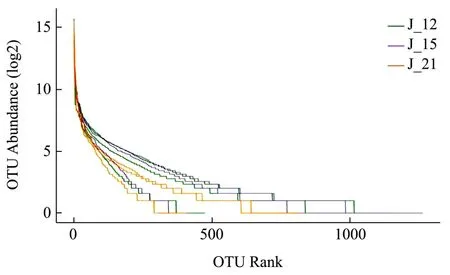
图5 稳定期、干预期和维持期的丰度等级曲线图Fig.5 The curve of abundance grade in stable, treatment and maintenance period
丰度等级曲线可用来反应物种丰度、多样性及均匀度。在水平方向上,曲线的宽度反映物种的丰度,物种的丰度越高,曲线在横轴上的范围越大;曲线的形状(平滑程度)反映了样本中物种的均度,曲线越平缓,物种分布越均匀。三个时期的丰度等级曲线如图5所示,稳定期折线较陡峭,丰度差异较大,均匀度较低;干预期折线的平缓程度较好,群落中各ASV/OTU间的丰度差异较小,群落组成的均匀度较高;维持期的升结肠和横结肠的曲线宽度最宽,物种丰度最高。
2.4 Beta多样性分析
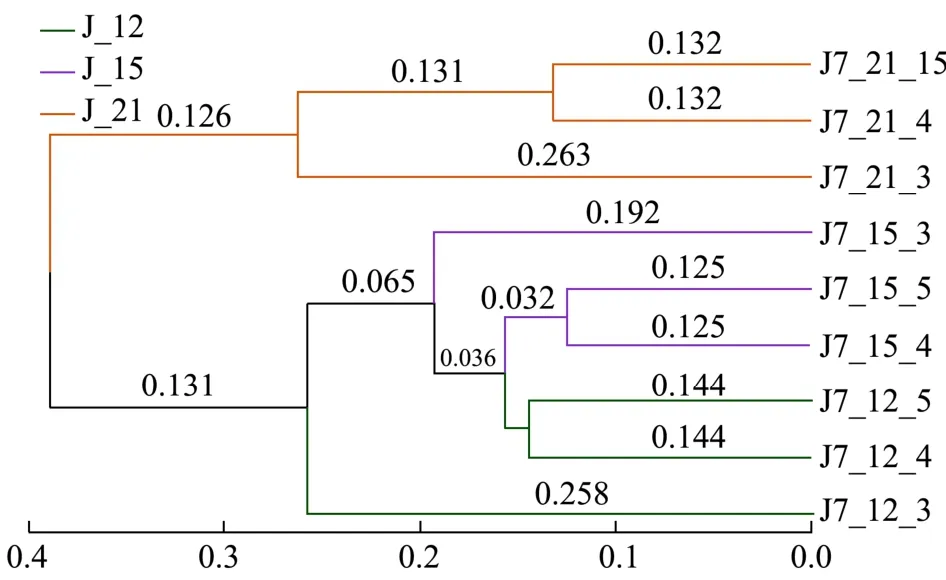
图6 距离矩阵的Bray-Curtis distance指数UPGMA聚类树Fig.6 Bray Curtis distance index UPGMA clustering tree of distance matrix
数据以样本距离矩阵的Bray-Curtis distance指数采用加权的计算方法,通过计算两个样本间各物种丰度差值的绝对值之和与其总丰度的比值,得到UPGMA聚类树。样本根据彼此之间的相似度聚类,样本间的分枝长度越短,两样本越相似。结果如图6所示,在三个时期中均是横结肠与降结肠相似度较高,与升结肠相似度低,这可能是因为食物营养液首先进入升结肠,再进入横结肠与降结肠,而进入横结肠与降结肠的是升结肠的发酵产物。三个时期相比差距较大,原因是稳定期只有食物营养液在系统中发酵,干预期中在食物营养液的基础上加入了橘皮汤,维持期虽然恢复了食物营养液继续发酵,但却是在干预期橘皮汤干预改变的菌群中继续发酵。
2.5 短链脂肪酸GC图谱分析
2.5.1 短链脂肪酸的标样色谱图

图7 短链脂肪酸混合标准品GC图Fig.7 GC graph of SFACs standard
图7为 8个标准品的 GC图,由图可知,采用DB-FATWAX UI(30 m×0.250 mm×0.25 μm)毛细管色谱柱,以甲酸作为吸附占据剂可同时分离 8种SCFAs,且分离效果较好。
2.5.2 消化液中短链脂肪酸色谱图

图8 消化液样品中短链脂肪酸GC图Fig.8 GC of SFACs in digestive juice samples
图8是SHIME系统中消化液样品短链脂肪酸GC图,由图可见在本研究气相色谱条件下,乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸、2-乙基丁酸(内标)可以依次得到分离,且峰形较好;其中乙酸、丙酸含量较多,丁酸次之;己酸未检测出。
2.5.3 短链脂肪酸的含量分析


图9 橘皮汤对短链脂肪酸的影响Fig.9 Effect of orange peel soup on SCFAs
橘皮汤干预后对短链脂肪酸的影响如图9所示。橘皮汤干预与稳定期对照比较时乙酸在升结肠阶段变化不明显,在横结肠阶段显著减少,在降结肠阶段显著增多,总体增加了3.21%;丙酸在升结肠、横结肠与降结肠阶段显著减少了45.43% (p<0.01);异丁酸、丁酸和异戊酸在升结肠、横结肠与降结肠阶段显著增多 (p<0.01),分别增加 52.94%、40.86%和 48.94%;戊酸在升结肠发酵6 h无显著变化,在横结肠与进入降结肠显著增多了80.00%。说明橘皮汤干预后改变了肠道菌群结构及丰度的变化,相对应的改变了其代谢产物短链脂肪酸含量。
2.6 讨论
肠道菌群作为人体最大的微生态系统,与宿主共生,保持动态平衡,维持正常的生理过程。其代谢产物短链脂肪酸主要包括乙酸、丙酸、丁酸,是肠道上皮细胞的主要能量来源且能够维持肠道的酸性环境,促进肠上皮细胞的生长与分化,抑制病原微生物的生长。在本研究中橘皮汤干预使肠道菌群代谢产物乙酸含量先下降后上升,丁酸、异丁酸、戊酸、异戊酸的含量上升,丙酸的含量下降。乙酸是多数细菌发酵的主要代谢产物,也是胆固醇合成的最主要底物,在机体内,大部分乙酸被吸收入血液,进入肝脏的代谢,作为周边组织的能源。乙酸的含量在干预期降结肠中升高,可能是由于在橘皮汤干预期降结肠菌群多样性与丰度上升的缘故。丙酸是拟杆菌门发酵的主要产物,橘皮汤干预后拟杆菌属丰度降低,从而使丙酸含量降低,也有研究发现丙酸主要与克雷伯氏菌呈正相关[15],在本研究中橘皮汤也抑制了克雷伯氏菌属的生长。丁酸主要由厚壁菌门代谢形成,能被结肠上皮细胞吸收利用,是结肠、盲肠能量的首选来源[16],厚壁菌门的巨单胞菌属在该菌群中属于优势菌种,且经过橘皮汤干预后巨单胞菌属丰度上升。也有研究发现丁酸和变形菌门呈显著性负相关[17],本研究结果也显示变形菌门的克雷伯氏菌属丰度下降。短链脂肪酸的生成和消耗是个动态过程,可以推测橘皮汤干预后,影响了能发酵产生短链脂肪酸的菌群,使其丰度发生变化。而以某种短链脂肪酸为能量来源的菌群增多会使短链脂肪酸减少。与稳定期相比干预期的物种属水平相对丰度提高的有巨单胞菌属、拟杆菌属,异丁酸、异戊酸及戊酸含量的提高可能与这些菌属相关,还可能与韦荣氏菌属、克雷伯氏菌属、大肠-志贺氏杆菌属等有害菌的减少有关,但主要由哪些菌群代谢形成还有待研究。
中药在肠道内可以发挥“扶正祛邪的作用”,即促进有益菌的生长,抑制有害菌的生长。有研究证明补益类中药党参能够促进益生菌的生长和繁殖,口服党参,机体肠道内乳杆菌明显增加,有害大肠杆菌明显降低[18]。龙承星[19]建立小鼠肠道菌群腹泻型模型中放线菌门显著增加,厚壁菌门显著降低,经七味白术散治疗后放线菌门比例下降,厚壁菌门比例上升且高于正常组。本研究结果显示橘皮汤能增加厚壁菌门的相对丰度,减少放线菌门的相对丰度。
肠道菌群失调常导致腹泻或慢性腹泻,若腹泻严重则出现恶心、呕吐症状。腹泻患者常服用双歧杆菌三联活菌胶囊、乳酸菌素片及乳酸菌胶囊等。乳酸菌是发酵糖类及可发酵碳水化合物产生大量乳酸,抑制肠道内腐败细菌的繁殖,调整肠道菌群,改善肠道运动功能,进而起到治疗腹泻的作用。而巨单胞菌属亦是利用各种碳水化合物产生乙酸、丙酸和乳酸[20],丁酸也是由厚壁菌门代谢形成,橘皮汤干预后巨单胞菌属在维持期丰度大幅增长,这可能与乳酸菌治疗腹泻的功能类似且与丁酸含量升高有关。克雷伯氏菌属的肺炎克雷伯氏菌增多可引起肺炎、脑膜炎、呼吸道感染、泌尿系统感染、腹膜炎、腹泻及败血症等。橘皮汤干预后有害菌克雷伯氏菌属丰度下降,这可能也是橘皮汤能抑制腹泻的可能性之一。因此橘皮汤可能是通过促进厚壁菌门巨单胞菌属生长从而增加乙酸与丁酸含量,且抑制变形菌门克雷伯氏菌属来达到治疗腹泻的作用。总的来说橘皮汤的作用机制与肠道微环境的改变及其代谢产物短链脂肪酸的改变密切相关。
本研究使用的粪便样品来自过去半年未使用抗生素药物的健康宿主,对于特定群体如高脂患者、糖尿病患者、过敏人群在橘皮汤干预后肠道菌群及短链脂肪酸的变化还尚待探究。
3 结论
橘皮汤干预能起到改变肠道微生物多样性的功效,并具有调整菌群丰度水平的作用,表现出促进厚壁菌门巨单胞菌属生长水平,抑制变形菌门克雷伯菌属及韦荣氏球菌属等肠道有害微生物的生长,对放线菌门双歧杆菌属也有一定的抑制作用;并对肠道菌群代谢产物短链脂肪酸的产生有一定的促进作用,在一定程度上改善了人体肠道健康。短链脂肪酸的含量也在一定程度上反映了细菌的活性及菌群的数量。为橘皮汤治疗呕吐、呃逆、嗳气及其药食同源中药食材功能开发提供了一定的理论基础。

