高产β-葡聚糖的黄伞菌株分离、鉴定及其体外模拟消化
韩宛芸,张长懿,顾泽鹏,段小雨,孙庆杰,邱立忠,卞希良,邬应龙,刘韫滔*
1(四川农业大学 食品学院,四川 雅安,625014)2(青岛农业大学 食品科学与工程学院,山东 青岛,266109) 3(诸城兴贸玉米开发有限公司,山东 潍坊,261000)
β-葡聚糖作为多糖研究领域中的一个重要分支,是多糖发挥生物学活性和功能的主要物质,如抗肿瘤、免疫调节、预防和治疗心血管疾病、抗病毒及抗氧化等,因此也被称为高效的生物反应调节因子[1-2]。近年来,β-葡聚糖在功能性食品、添加剂、医药学等产业领域有着广泛的应用[3]。工业化生产的β-葡聚糖主要来源于麦类作物和酵母[4-5],但由于麦类作物生长周期长,酵母中β-葡聚糖仅存在于酵母细胞壁中,含量较低。因此,寻找一种β-葡聚糖产量高且生长周期短的生物至关重要。
饮食中的生物活性化合物对人体健康的影响主要取决于在胃肠道中的利用率,消化过程导致大量营养素和微量营养素发生一系列变化,从而限制了它们的最终生物可利用性[6-7]。无论是子实体还是菌丝体,黄伞多糖均为葡萄糖含量居多的β构型的多聚体,具有多种生物学活性[8-11]。然而,野生黄伞子实体生产量低,质量不均一,不易获得;同时人工栽培黄伞子实体生产周期长、成本高,因而黄伞菌未得到全面开发。有研究指出,被人体吸收的β-葡聚糖是其发挥生物活性的主要物质[12],因此,有必要探究黄伞菌株中β-葡聚糖的生物可利用率。
综上,本研究旨在采用组织分离法获得1株具有高产β-葡聚糖特性的菌株,同时拟以菌丝体生物量、β-葡聚糖产量、产率作为黄伞液态发酵条件优化的响应值,并对最优组分进行体外模拟消化[13],探究消化前后黄伞营养成分的变化及生物可利用率,以科学合理地评价膳食营养素的摄入量。
1 材料和方法
1.1 实验材料
本试验所用菌株为云南楚雄彝族自治州商家于2017年在山中采摘,选取黄色,伞形完整无外伤,表面附有一层透明黏液,呈白色或黄褐色绒毛状的菌株,加冰袋空运至雅安。为排除试验过程中水对试验的影响,本试验用水均为超纯水。
1.2 菌株分离及鉴定
1.2.1 培养基
马铃薯葡萄糖琼脂培养基(potato dextrase agar,PDA);综合PDA培养基;改良马丁培养基(MMN)[14-15]。
1.2.2 菌株的分离
采用组织分离法及重复转管纯化(至少3次)对子实体进行分离培养,培养期间定时观察菌落形态,并将疑似真菌菌丝体通过光学显微镜染色观察,将初步判定为纯种的菌丝体扩大培养后经40%甘油保种。
1.2.3 菌株鉴定
依照《中国真菌志》中第四十九卷,鳞伞属-多脂鳞伞对样品进行形态学鉴定,并拍照记录。同时进行分子生物学分析,对测序结构构建N-J树,根据节点上的自展值从而确定菌株的物种或其近源的物种。
1.3 β-葡聚糖产量的测定
依照β-葡聚糖检测试剂盒的操作规程测定β-葡聚糖的产量[16]。β-葡聚糖产量、产率按公式(1)(2)计算:
m2=m3-m4
(1)
(2)
式中:m1,菌丝体生物量,1 L培养液中所含的菌丝体干重,g/L;m2,β-葡聚糖产量,1 L培养液中所含的菌丝体中的β-葡聚糖总量,g/L;m3,总葡聚糖产量,1 L培养液中所含的菌丝体中的总葡聚糖产量,g/L;m4,α-葡聚糖产量,1 L培养液中所含的菌丝体中的α-葡聚糖总量,g/L;ωl,β-葡聚糖产率,%。
1.4 液态发酵条件优化
1.4.1 碳源优化
以综合PDA培养基为基础培养基,分别以单糖(葡萄糖、半乳糖、甘露糖)、寡糖(蔗糖、麦芽糖、低聚果糖)、多糖(可溶性淀粉、糊精)作为不同碳源,添加量均为20 g/L,pH值自然(培养基初始pH值为5.0),将预先活化的液体菌种分别以200 μL的接种量接入装液量为50 mL含有不同碳源的培养基中。培养参数:25 ℃、120 r/min、10 d。计算不同碳源条件下β-葡聚糖产量、产率,每组试验做3个平行。
1.4.2 氮源优化
以综合PDA培养基为基础培养基,分别以有机氮(酵母浸出粉、胰蛋白胨、蛋白胨)和无机氮(氯化铵、硫酸氨、硝酸钠)作为不同氮源,添加量均为10 g/L。
1.4.3 培养温度优化
以综合PDA培养基为基础培养基,设置培养温度分别为21、23、25、27和29 ℃。
1.4.4 初始pH值优化
以综合PDA培养基为基础培养基,设置初始pH值分别为为3.0、4.0、5.0、6.0、7.0、8.0和9.0。
1.4.5 最优发酵条件的确定及验证
根据单因素试验所得结果,以β-葡聚糖产量、产率为响应值,采用适当的正交试验,以此确定黄伞液体发酵的最优条件,随后进行验证试验。
1.5 体外模拟消化
按照购买试剂说明书对酶活力进行测定,参考前期研究配制的胃肠道消化液[10-11],对黄伞菌丝体(20 g干重)进行体外模拟消化,主要经过模拟口腔、胃、小肠3阶段,模拟消化结束后,将残渣冻干,以获得经体外模拟消化后残渣质量,上清液浓缩定容备用。以超纯水做空白对照,所有数据的处理均扣除空白,以消除体外模拟消化液中矿物质、酶等对于实验结果的干扰。
参照GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》、GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》和GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》的方法测定消化前后黄伞残渣中的灰分、粗蛋白、粗脂肪含量,通过公式计算其中总碳水化合物的含量[11];采用反向高效液相色谱、ICP-MS、β-葡聚糖检测试剂盒测定原始样品及消化液中游离氨基酸含量、矿物质含量及β-葡聚糖含量。
1.6 数据处理与分析
所有数据均用SPSS 22.0软件进行单因素方差分析,以平均值±标准差表示,当P<0.05则认为具有显著性差异。
2 结果与分析
2.1 菌种鉴定
2.1.1 子实体形态学鉴定
黄伞子实体菌盖直径约4.35 cm,扁半球形,中部凸起,表面微黏,呈姜黄色,并附有红褐色近似鳞片状的微凸起物,中央处较为密集。菌肉白色,菌褶直生密集。菌柄中生,长约5.15 cm,粗1.10 cm,粗细较为均等,下部略有弯曲。
2.1.2 菌落形态鉴定
如图1-a所示,在25 ℃培养7~15 d,不同培养基中黄伞的生长形态几乎一致,菌丝呈现白色,紧贴培养基生长。对试验组织分离的90支斜面进行统计,该菌株在改良MMN培养基和综合PDA培养基上生长速度较快,在PDA培养基上生长较为缓慢,且大多数在PDA培养基上基本不生长。同时,对各培养基的分离成功率进行统计,综合PDA培养基分离成功率最高,可达33.33%,如图1-b所示,可作为野生黄伞的分离培养基。改良MMN培养基的分离成功率次之(23.33%),而PDA培养基为6.67%,这可能是由于培养基中营养成分较为单一,仅以葡萄糖和马铃薯提取物作为菌丝体生长所需要的碳氮源,不能为菌丝体生长提供充足的营养成分及生长因子。因此,PDA培养基不便于作为食用菌的分离培养基。
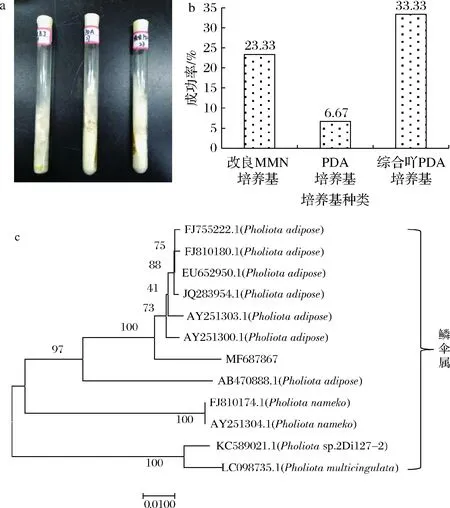
a-黄伞的菌落形态;b-各培养基对黄伞分离成功率统计;c-黄伞菌株(MF 687867)的系统发育学地位图1 黄伞的分离鉴定Fig.1 Isolation and identification of P.adiposa节点上的数据表示Bootstrap value,即自展支持率,用来检验进化树分支可信度。该值越接近100,表明菌株之间差异越小
2.1.3 分子鉴定
真菌DNA经PCR反应,电泳检测,在琼脂糖凝胶电泳上得到单一条带,经ITS1/ITS4序列扩增后,与DNA Marker比较,在琼脂糖凝胶电泳上得到一条大小约为650 bp的亮带,PCR产物经纯化回收后,获得一组由644个碱基构成的序列,将该序列在NCBI GenBank中运用Nucleotide BLAST工具与现有数据库中的DNA序列进行同源序列比对。结果表明,该菌株与鳞伞属的部分菌株序列相似性较高,可达99%及以上,基于此建立系统发育树(图1-c),最终确定分离所得菌株为黄伞,将测序所得的菌株序列提交到GenBank,获得基因登陆号为MF 687867(https://www.ncbi.nlm.nih.gov/nuccore/MF687867)。
2.2 菌种的选择
对分离所获得的19株菌进行β-葡聚糖产量、产率测定,其中,菌株PA-008(来自综合PDA培养基)中β-葡聚糖产量、产率最高,分别为2.93 g/L和24.80%。因此,选择菌株PA-008作为接下来的研究对象。
2.3 液体发酵条件的优化
2.3.1 碳源对黄伞β-葡聚糖产量和产率的影响
如表1所示,黄伞对于碳源利用范围较广,在一般的单糖和双糖培养基中均可生长。单糖,尤其是葡萄糖对于黄伞菌丝体的生长影响更为有利,但对于淀粉类多糖的利用率极低,可能是因为单糖分子质量小,可直接通过细胞膜被细胞吸收,而双糖、多糖等高分子物质必须由细胞分泌的胞外酶分解为单糖后才可以被细胞吸收[17]。

表1 液体发酵条件对黄伞β-葡聚糖产量、产率的影响Table 1 The influence of liquid fermentation conditions on the yield of P.adiposa β-glucan
对于黄伞中β-葡聚糖产量、产率而言,碳源种类对其影响较为显著,利于黄伞高产β-葡聚糖的碳源有葡萄糖(2.93 g/L,24.80%)、低聚果糖(2.49 g/L,31.56%)、蔗糖(2.37 g/L,25.72%),其中低聚果糖明显有利于β-葡聚糖的产生,但不利于菌丝体(7.87 g/L)的生长,可见黄伞菌丝体对于不同碳源的利用方式和利用率有着较大的差异。显著性差异分析表明半乳糖、甘露糖、蔗糖对于黄伞β-葡聚糖产量、产率的影响没有显著性差异,但其中以蔗糖为碳源的培养基组分中β-葡聚糖产率最高,基于β-葡聚糖高产的目的,分别选用葡萄糖、蔗糖、低聚果糖作为后续正交试验的影响因子。
2.3.2 氮源对黄伞β-葡聚糖产量和产率的影响
如表1所示,黄伞对于有机氮的利用率远高于无机氮,这与有关的报道一致[18]。这可能是由于有机氮在真菌细胞内可迅速参与多条合成代谢途径,而无机氮成分过于单一,并且需要经过自身合成后才可以供给使用。在3种有机氮中,酵母浸出粉的β-葡聚糖产量最高(3.00 g/L),而含有胰蛋白胨的培养基其菌丝体生物量(10.56 g/L)相较于其他2种有机氮源略低,但其β-葡聚糖产量、产率(2.69 g/L,25.48%)均高于含牛肉膏的培养基,表明不同有机氮培养基的菌丝体生物量与β-葡聚糖产量、产率并不成正相关,这与上述碳源的优化结论一致。但在所选取的3种无机氮中,菌丝生物量与β-葡聚糖的产量呈正相关,这可能是由于黄伞对于不同无机氮的利用方式及利用率不同。基于β-葡聚糖高产的目的,分别选择酵母浸出粉、胰蛋白胨、牛肉膏作为后续正交试验的影响因子。
2.3.3 培养温度对黄伞β-葡聚糖产量和产率的影响
如表1所示,β-葡聚糖产量、产率在温度为25 ℃时达到最大值(2.93 g/L,24.80%),同时β-葡聚糖产量、产率在温度为2~25 ℃之间没有显著性差异,且之后随着温度的升高,β-葡聚糖产量、产率逐渐降低,在温度低于25 ℃时,β-葡聚糖产量、产率随着温度的升高逐渐升高。基于此变化规律,为获得黄伞产β-葡聚糖液态发酵最适温度,选择温度为23、25和27 ℃作为后续正交试验的影响因子。
2.3.4 初始pH值对黄伞β-葡聚糖产量和产率的影响
如表1所示,β-葡聚糖产量、产率在pH值为6.0时达到最大值(3.14 g/L,25.68%),通过显著性差异分析,β-葡聚糖产量、产率在pH值在5.0~7.0没有显著性差异,且之后随着pH值的升高,β-葡聚糖产量、产率逐渐降低,在pH<6.0时,β-葡聚糖产量、产率随着pH值的升高逐渐升高。基于此变化规律,为获得黄伞产β-葡聚糖液体发酵最适初始pH值,选择初始pH值为5.0、6.0、7.0作为后续正交试验的影响因子。
2.3.5 正交试验优化
基于培养条件的单因素优化结果,其中碳源(葡萄糖、蔗糖、低聚果糖)、氮源(酵母浸出粉、胰蛋白胨、牛肉膏)、温度(23、25和27 ℃)、初始pH值(5.0、6.0和7.0)对菌丝体β-葡聚糖产量、产率影响显著,因此对这4个因素进行正交试验优化,分别以β-葡聚糖产量(X)、β-葡聚糖产率(Y)为响应值进行无交互作用的正交试验,且每组试验都在120 r/min转速恒温摇床振荡培养10 d,正交试验设计及试验结果见表2。
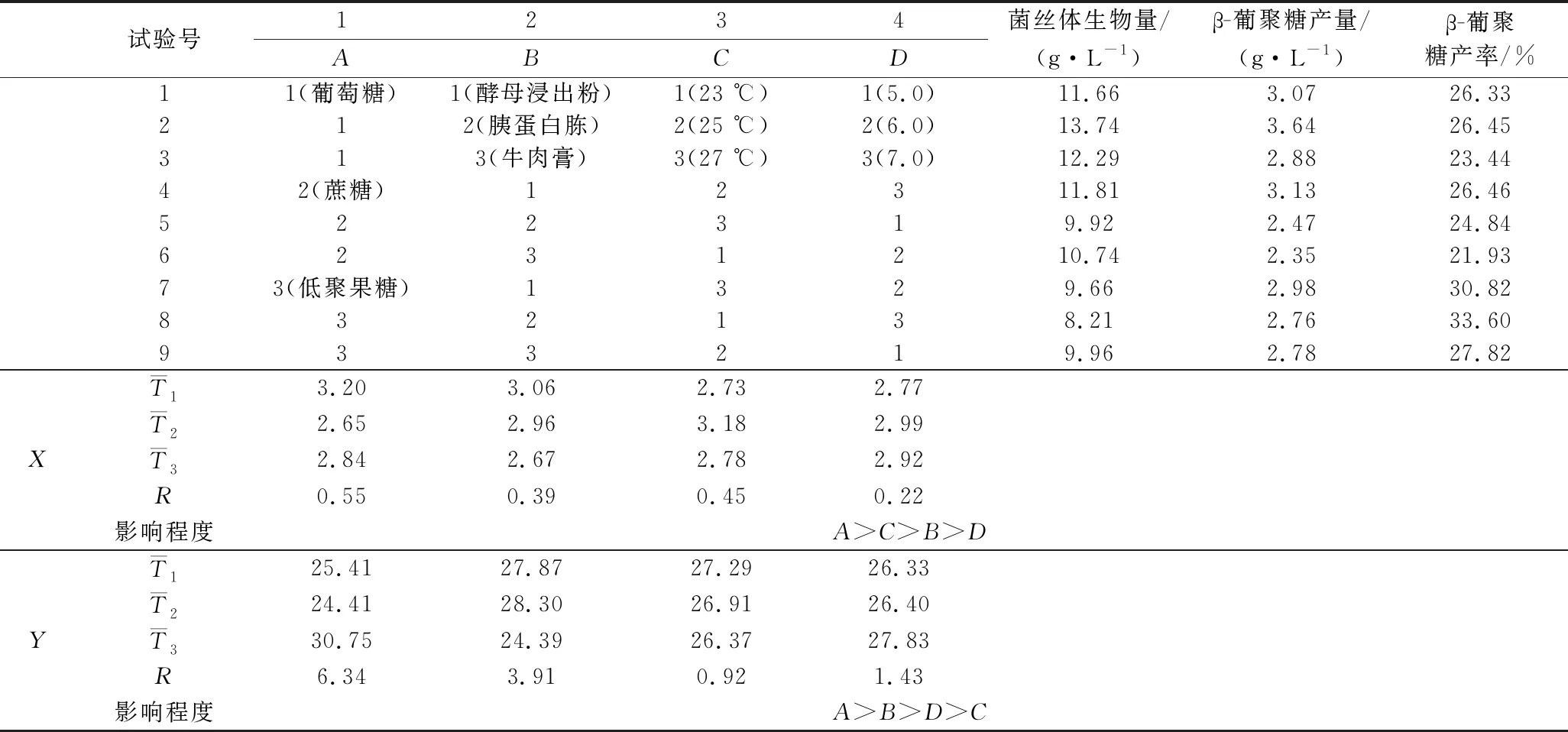
表2 正交试验结果与极差分析Table 2 Results of orthogonal experiment and range analysis
从表2的极差分析中可知,影响β-葡聚糖产量的各因素主要关系为:A(碳源)>C(培养温度)>B(氮源)>D(初始pH值);影响β-葡聚糖产率的各因素主要关系为:A(碳源)>B(氮源)>D(初始pH值)>C(培养温度)。由此可知,碳源种类对于黄伞中β-葡聚糖产量、产率的影响最为显著。此外,基于β-葡聚糖高产的目的,理论上最优发酵条件为A1B1C2D2;以β-葡聚糖产率为响应值理论上最优发酵条件应该为A3B2C1D3。
2.3.6 最优发酵条件的验证
综合β-葡聚糖产量、产率的分析,为在单位时间内获得更多β-葡聚糖,因此选择最优发酵条件为A1B1C2D2或A3B2C1D3。对2种组合各做2次验证试验,其中组合A1B1C2D2的菌丝体生物量、β-葡聚糖产量、β-葡聚糖产率平均值分别为13.91 g/L、3.74 g/L、26.89%,组合A3B2C1D3的菌丝体生物量、β-葡聚糖产量、β-葡聚糖产率平均值分别为9.83 g/L、3.11 g/L、31.64%,均高于其他试验组,尽管培养基组合为A3B2C1D3的β-葡聚糖产率最高,但其菌丝体生物量、β-葡聚糖产量均低于组合A1B1C2D2,为在单位时间内获得更多的β-葡聚糖,因此,选择黄伞液体发酵条件的最优组合为A1B1C2D2,即碳、氮源分别选择葡萄糖、酵母浸出粉,培养温度为25 ℃,初始pH值为6.0,其余培养参数为:120 r/min、10 d。
2.4 黄伞菌丝体体外模拟消化前后宏量营养素的变化
2.4.1 宏量营养素消化分析
由表3可知,经体外模拟消化后,菌丝干重为15.58 g,菌丝体消化率达22.10%,尤以灰分、粗蛋白的消化率最高。尽管粗脂肪消化率达33.11%,但总体而言,黄伞菌株中粗脂肪含量较低。因此,有必要进一步分析其氨基酸及矿物质的释放量和可利用率。

表3 黄伞菌丝体体外模拟消化前后宏量营养素分析Table 3 Analysis of macronutrients before and after simulated digestion of the mycelium of P.adiposa
2.4.2 氨基酸消化分析
在被人体吸收之前,蛋白质必须经历一系列胃肠道的酶促水解。表4显示了黄伞菌丝体中可吸收的氨基酸含量及其可利用率。研究表明,黄伞比大多数植物蛋白更具营养价值,其必需氨基酸与非必需氨基酸比值达0.607。经模拟消化后,消化液中可部分释放17种氨基酸,可吸收样品中必需氨基酸与非必需氨基酸之比为0.582,即消化导致必需氨基酸的释放低于非必需氨基酸,可能是由于在消化过程中,由于消化酶和其他物质(如脂质、糖类等)的存在使氨基酸发生不同程度的反应,从而放大了由不同氨基酸的能力引起的差异[12]。此外,尽管氨基酸均有一定程度的释放,但游离氨基酸总量远低于总蛋白消化量,这可能是因为蛋白质在消化过程中由于酶和胃液低pH的作用发生了水解,使肽链断开,但并未完全水解成氨基酸。在氨基酸中,Asp、Glu、Gly、Ala和Arg引起可口的味道[11]。
在这项研究中,Glu含量似乎是在消化液中检测到的17个氨基酸中最高的,这为黄伞菌丝体的工业化应用提供了一定指导。此外,消化后Val和Leu的含量较高。研究指出,支链氨基酸由Leu,Ile和Val组成,具有多种生理和代谢作用,在免疫和脑功能中至关重要[19],这意味着黄伞菌丝体具有增强免疫功能的潜力。

表4 黄伞菌丝体体外模拟消化前后氨基酸分析Table 4 Amino acid analysis before and after in vitro simulated digestion of the mycelium of P.adiposa
2.4.3 矿物质消化分析
表5显示了黄伞菌丝体中12种矿物质的绝对含量及其生物可利用率,由于矿物质溶解度是吸收的先决条件,因此,矿物质的生物可利用率是为了量化溶解在胃肠道环境中并被人体吸收的物质。其中,Cu的生物可利用率最高,达56.13%,其次为Mg,此外,单价元素(如K、Na)的生物可利用率也较高。由于培养基中K元素的添加,可能增加了黄伞菌丝体对于K的摄入,在黄伞菌丝体及其消化液中,K含量都居于最高值,这种高K膳食的摄入可能有助于预防高血压和糖尿病等慢性疾病[20]。值得一提的是,尽管黄伞菌丝体中存在重金属矿物质(Pb、Cd、As等),但其经体外模拟消化后均低于安全值。
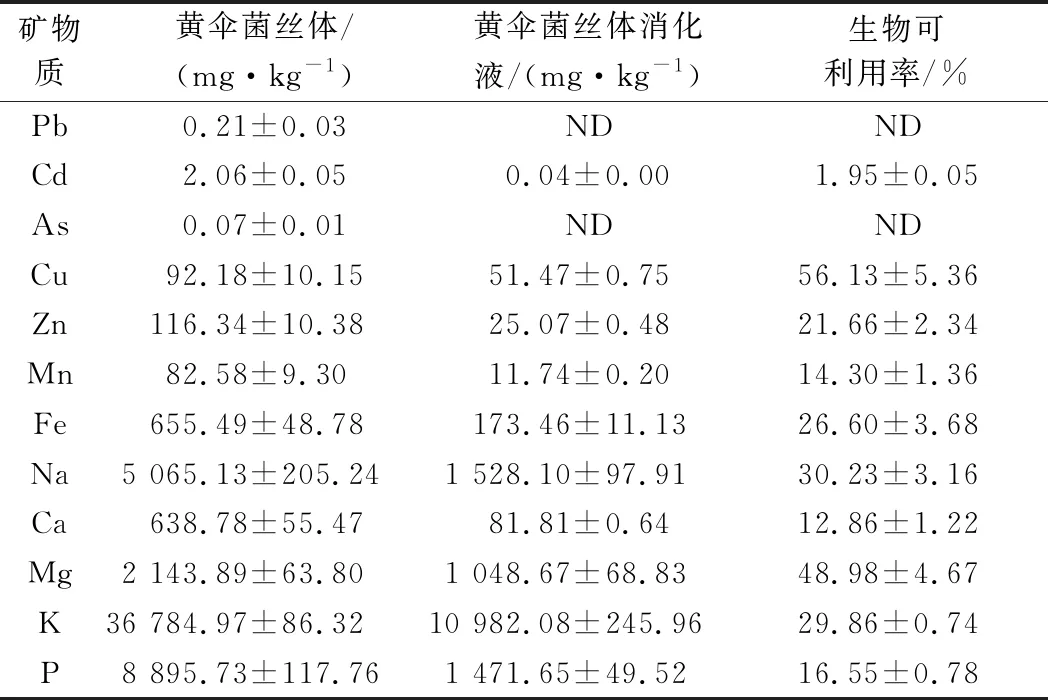
表5 黄伞菌丝体体外模拟消化前后矿物质分析Table 5 Analysis of minerals in the mycelium of P.adiposa before and after in vitro simulated digestion
2.4.4 β-葡聚糖含量分析
体外模拟消化后,消化液中β-葡聚糖的含量为(41.92±3.42)mg/g,生物可利用率为(15.50±1.14)%,尽管黄伞菌丝体中β-葡聚糖含量很高,但在人体消化环境中的生物可利用率较低,研究表明,经胃肠道消化后,β-葡聚糖可能由于胃液中的低pH而发生一定程度的解聚,随后被肠道微生物所利用。同时,有研究报道,在人体实验中,不能被人体吸收的β-葡聚糖高达88.5%,即生物可利用率仅有11.5%[21]。因此,黄伞的食用有助于提高β-葡聚糖的生物可利用率,从而更有助于β-葡聚糖发挥其生理功能。然而,在体外模拟消化过程中,样品粒径对燕麦粉β-葡聚糖的生物可利用率有很大的影响,粒径越小越有助于β-葡聚糖在胃部的消化吸收,但极不利于在肠道的消化[12],因此,有必要进一步探究β-葡聚糖的释放部位及其结构,进而确定β-葡聚糖的高效利用方法。
3 结论
本试验以野生黄伞为供试材料,分离、筛选出1株具有高产β-葡聚糖能力的菌株PA-008(GenBank登录号:MF 687867),优化工艺参数,确定其最优发酵条件为:葡萄糖、酵母浸出粉为最优碳氮源,培养温度为25 ℃,初始pH值为6.0,其余培养参数为:120 r/min、10 d。为工业化培养黄伞菌丝体提供理论依据。同时,采用体外消化模型确定了黄伞菌株中营养物质的生物可利用率。深入研究了黄伞菌株中氨基酸、矿物质、β-葡聚糖的生物可利用率,从营养的角度看,上述有关营养成分的释放和抗氧化活性的部分数据为更科学和深入的评估黄伞菌株提供了初步基础。