Fisher判别模型在肾透明细胞癌多层螺旋CT征像及病理学WHO/ISUP分级中的价值
陈天昱 樊树峰
肾透明细胞癌(clear cell renal cell carcinoma,CCRCC)约占成人肾恶性肿瘤的75%~90%,其预后效果与病理学分级相关,世界卫生组织/国际泌尿病理学会(World Health Organization/International Association of urological pathology,WHO/ISUP)级别越高,预后越差,反之越好[1]。不同病理分级的肿瘤治疗方案也不同,如术前影像学评估为低级别组的CCRCC可选肾脏部分切除术或微创射频消融术,对于失去手术机会的高级别组可首选靶向治疗、化疗等非手术治疗方案[2],因此准确预测其病理学分级对患者临床治疗方案的选择和预后有重要意义。笔者将CCRCC术前多层螺旋CT(multisliecs helieal CT,MSCT)检查结果及术后病理WHO/ISUP分级资料建立术前病理分级Fisher判别模型,并通过与术后病理结果对照,以验证此模型的判别效力,评估临床应用价值。
1 对象和方法
1.1 对象 收集浙江中医药大学附属第二医院病历系统中2017年5月至 2020年5月具有手术病理及术前增强CT检查资料的CCRCC患者53例,男28例,女25 例,年龄 35~78岁;其中右肾病灶 29例(54.6%),左肾病灶24例(45.2%)。纳入标准:(1)所有患者均为单侧肾脏,单发病灶;(2)病灶局限于肾脏,无邻近脏器及远处转移灶。排除标准:(1)检查前经放、化疗等其它治疗;(2)有肾脏衰竭等其它基础性疾病。术后WHO/ISUP分级Ⅰ级16例,Ⅱ级12例,Ⅲ级14例,Ⅳ级11例,Ⅰ、Ⅱ级定为低级别组,Ⅲ、Ⅳ级定义为高级别组。本研究经本院医学伦理委员会审批同意。
1.2 肾脏CT检查方法、参数及图像征像分析 肾脏MSCT检查CT型号为SOMATOM Definition AS 64排128层4D螺旋CT。所有患者均经肘静脉注射碘佛醇对比剂,流速为3 ml/s,行平扫期、皮髓质期、实质期、排泄期扫描。由2位经验丰富的放射科高年资主治医师在PACS系统工作站上对肿瘤的 CT形态学征象进行评价、测量并记录,内容包括肿瘤大小、位置,是否浸润性生长,边缘是否规则、有假包膜,是否发生液化、坏死,肿瘤内部是否发生钙化等。
1.3 病理分级标准 目前CCRCC的分级于2016年由WHO将原常用的Fuhrman分级标准修订为WHO/ISUP分级标准,具体标准为根据肿瘤细胞核形态及核仁情况。Ⅰ级:400倍光镜下瘤细胞无核仁或核仁不明显;Ⅱ级:400倍光镜下瘤细胞可见清晰的核仁,但在100倍光镜下核仁不明显或不清晰;Ⅲ级:100倍光镜下可见清晰的核仁;Ⅳ级:明显多形性的核,瘤巨细胞、肉瘤样或横纹肌样分[3]。
1.4 统计学处理及建立Fisher判别模型 采用SPSS 22.0统计软件。两组间CT征像的比较采用单因素χ2检验。采用logistic回归分析有统计学差异的CT征象的预测价值。以两组间有统计学差异的CT征象作为建立Fisher判别模型纳入指标并求出判别临界值Z,然后将两组中每例患者CT征像赋值代入公式中,求得每例患者的Zc值。当Z>Zc判别为高级别组,Z<Zc判别为低级别组,Z=Zc时判别为高、低两组均可,以术后病理结果为金标准来检验判别模型的判别效力,采用交叉核实法计算误判率。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者影像学征像的比较 低级别组为28例,高级别组为25例,其中肿瘤长径、浸润性生长、边缘规则或有假包膜、发生液化或坏死4项特征在两组间差异均有统计学意义(均P<0.05);肿瘤生长位置、强化均匀性、肿瘤内部发生钙化3项特征在两组间差异均无统计学意义(均P>0.05),见表1。
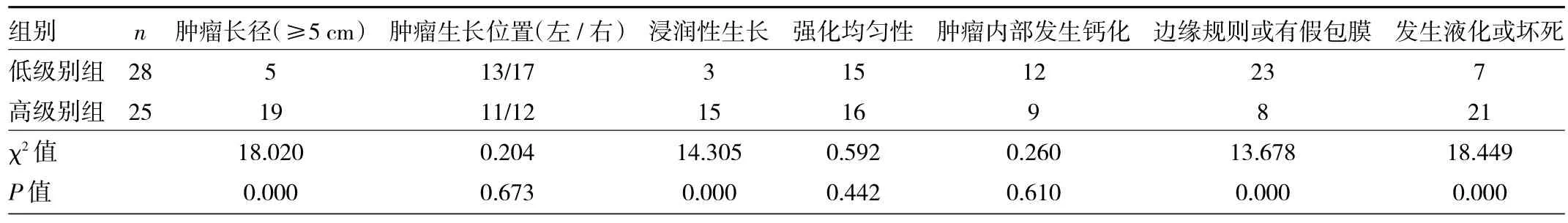
表1 两组患者影像学征像的比较(例)
2.2 logistic回归分析结果及CT影像学、病理学图像特点 结果显示,肿瘤长径、是否浸润性生长,边缘是否规则或有假包膜,是否发生液化或坏死,为预测CCRCC WHO/ISUP分级的独立预测因子,见表2。
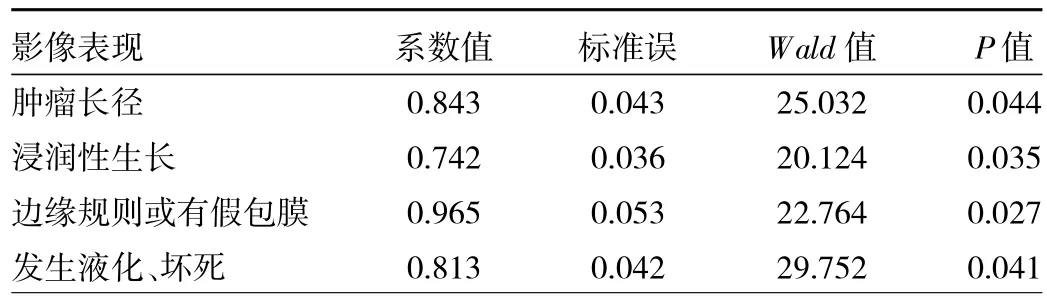
表2 CCRCC病理分级影响因素logistic回归分析结果
CCRCC患者CT平扫表现为等密度或者稍低密度的软组织肿块,增强扫描发现皮质期肿瘤实质部分强化程度常高于正常肾皮质;皮髓质期、延迟及排泄期肿瘤强化部分明显退出,相对正常肾组织呈相对低密度[4]。低级别组肿瘤CT表现为边界相对清晰且部分患者边界存在假包膜征;病理图片示细胞核核形呈类圆形,Ⅰ级400倍光镜下无核仁或核仁不明显,Ⅱ级400倍光镜下可见部分核仁。高级别组肿瘤CT表现边界相对欠清晰,部分患者可见液化、坏死组织或表现为邻近正常肾组织结构侵犯,如肾窦或肾门等;病理图片示细胞核明显不规则、怪异、呈多形性改变。见图1-3。

图1 45岁男性左侧肾透明细胞癌(CCRCC)患者WHO/ISUPⅡ级图像[a:CT平扫肿瘤呈类圆形等稍低密度;b:增强扫描皮质期肿瘤呈显著不均匀强化,实质部分强化程度高于肾皮质,病灶呈类圆形,假包膜征(+,白箭头示);c:皮髓交界期肿瘤强化减退明显,呈相对低密度,内见小片坏死密度图;d:400倍光镜下示部分细胞核可见清晰核仁]

图2 52岁男性右侧肾透明细胞癌(CCRCC)患者WHO/ISUPⅣ级图像(a:CT平扫肿瘤呈稍低、等密度,边界欠清晰;b:增强扫描皮质期肿瘤呈显著不均匀强化,内见小片相对低密度影;c:排泄期冠状面重建,内见片状液化坏死影,肿瘤侵犯右侧肾窦,右侧肾窦结构欠清晰;d:400倍光镜下示肿瘤细胞核形状明显形态怪异、呈多形性改变,核仁大)
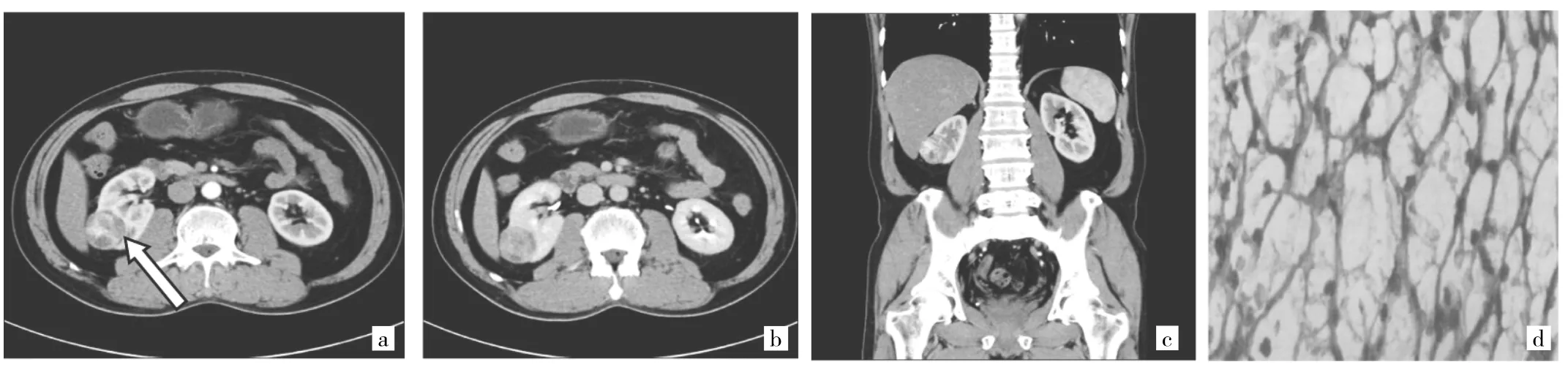
图3 43岁女性右侧肾透明细胞癌(CCRCC)患者WHO/ISUPⅠ级(a:肿瘤呈类圆形,直径约3.5 cm,边界清晰,CT增强皮质期明显不均匀强化,边界清晰,假包膜征(+,白箭头示);b:皮髓期肿瘤强化部分明显退出,呈相对低密度影;c:皮质期CT冠状面重建,显示肿瘤边界清晰;d:400倍光镜下示肿瘤细胞核类圆形、核仁不明显)
2.3 建立判别模型 选定具有统计学差异的4项CT征象:肿瘤长径(X1,临界值为 5 cm),浸润性生长(X2),发生液化或坏死(X3),肿瘤边缘规则或有假包膜(X4)作为判别指标来建立判别方程式,得出判别公式为Z=0.48X1+0.348X2+0.741X3+0.414X4。其中CT征像赋值规则为长径(≥5 cm=1,<5 cm=0),是否浸润生长(是=1,否=0),是否发生液化、坏死(是=1,否=0),边缘规则或有假包膜(是=1,否=0)求得函数判别界值:Zc=1.24。判别规则为:Z<1.24判定为高分化CCRCC,即Ⅰ~Ⅱ级,Z>1.24判定为低分化CCRCC,即Ⅲ~Ⅳ级,当Z=1.24时判为高分化组或低分化组皆可。
2.4 交叉核实法对判别函数的效果评价 将判别数据代入判别模型后,判别模型将病理结果中5例高级别组判为低级别组,2例低级别组判为高级别组,误判率为 13.21%,正确率为 86.79%,灵敏度为89.66%,特异度为71.43%,见表3。

表3 交叉核实法评估Fisher判别模型判别效果(例)
3 讨论
目前CCRCC的分级于2016年由WHO将原常用的Fuhrman分级标准修订为WHO/ISUP分级标准,是预测CCRCC生物侵犯和潜在转移能力的有效参数。CCRCC病理学分级越高,5年生存率和手术预后越差,周边组织生物侵犯及潜在转移灶的可能性越大[5-6]。因此术前准确的预测及评估其病理学分级对手术方式的选择、肿瘤切除的可能性就显得尤为重要。CCRCC肿瘤组织病理活检术是判断其病理分级的金标准。但是有学者研究表明,针吸活检术对小肾肿瘤病理分级准确性很高;但是对于较大肿瘤由于液化、坏死等原因导致其均质性较差,针吸活检术可能不能完整的提供肿瘤病理分型和分级所需的信息[7-8]。CT检查目前是临床诊断肾癌的主要方法,基于CCRCC的CT影像学征像建立的Fisher判别模型具有客观、稳定、高灵敏度的特点,为术前准确评估CCRCC病理学分级提供了可能。
有文献研究表明,CCRCC细胞核病理分级与肿瘤的最长径、是否浸润性生长,肿瘤均质性(囊性或实性),肿瘤边缘是否清楚4项指标密切相关;与肿瘤生长位置、患者发病年龄、性别、发生钙化、强化是否均匀无关[9]。本文中4项CT观察指标在高、低分化组间均有统计学差异,与上述文献报道一致。国内外学者研究表明,肿瘤长径越长其分化程度越低,WHO/ISUP分级越高,肿瘤潜在的侵袭性越高,也越容易发生远处转移。Thompson等[10]、Moura等[11]研究得出肿瘤直径为7 cm为其侵袭性增加的临界值;而Remzi等[12]经过研究后则以直径3 cm为临界值。造成这种临界值的差异可能是样本量大小差异造成的,本研究以直径5 cm为临界值,病理分级低级别组30例中有5例直径≥5 cm,高级别组23例中有19例直径≥5 cm。由于肾癌分化高低的差异,导致其生物学行为也不一样。部分CCRCC患者由于生物学形状表现为膨胀性生长导致挤压邻近正常肾组织,在肿瘤周围形成一圈纤维假包膜,与正常肾实质分界清楚[13]。存在假包膜的肿瘤通常分化程度较高、侵袭性较低,生长也较缓慢,WHO/ISUP分级通常为低级别组。而表现为浸润性生长的肿瘤病灶边缘与正常肾组织通常分界不清,肿瘤分化程度较低、侵袭性及恶性程度较高,其WHO/ISUP分级通常为高级别组,对于CT形态学表现为浸润性生长、边界不清的CCRCC患者发生远处转移的潜在可能性较大,术后更应密切监测及随访[14]。本组53例患者中病理分级低级别组浸润性生长为3例,高级别组为15例。低级别组由于肿瘤分化程度高,生长较缓慢,肿瘤在CT图像上常表现为均匀的实性密度,发生液化、坏死概率较低。高级别组肿瘤由于其生长方式为侵袭性生长,生长速度过快,肿瘤血供不足,导致其液化、坏死成分较多,本组低、高级别组发生液化、坏死患者分别为7、21例。本文及文献研究表明CCRCC一些CT表现例如钙化、强化均匀性可同时出现在Ⅱ级和Ⅲ级之间,差异无统计学意义,可能是由于CCRCC病理学特征易发生纤维、透明样变或凝固性坏死所导致[15]。
综上所述,本研究在已知病理结果的基础上回顾性分析并建立判别模型,采用交叉核实法检验模型判别效力,得出误判率为13.21%,正确率为86.79%,说明此判别模型具有一定的应用价值,可以为临床医师对肾癌术前分级预测提供参考和帮助。

