denosumab治疗后骨巨细胞瘤伴显著炎性反应的罕见组织形态分析
宫丽华,孙晓淇,张 铭,张 文,董荣芳,张婷婷,丁 宜
denosumab是拮抗核因子kappa-β受体活化因子配体(receptor activator of nuclear factor kappa-β ligand, RANKL)的单克隆抗体,目前已广泛应用于骨巨细胞瘤的术前辅助治疗[1]。应用denosumab治疗前,骨巨细胞瘤应行穿刺活检,并结合临床影像学明确病理诊断。经denosumab治疗后手术标本,其组织学形态与治疗前穿刺组织差异较大。本课题组前期报道denosumab治疗后骨巨细胞瘤呈一系列经典形态特点[2]。本文现对骨巨细胞瘤经denosumab治疗后罕见病理组织形态学改变进行总结分析并复习相关文献,以提高临床与病理医师对骨巨细胞瘤经denosumab治疗后组织学改变的认识。
1 材料与方法
1.1 临床资料收集2020年1~5月我院存档的3例经denosumab治疗后的骨巨细胞瘤,患者均有denosumab治疗前后的完整临床、影像学及治疗资料。
1.2 方法3例患者denosumab治疗前经穿刺活检标本及治疗后手术标本,均经10%中性福尔马林固定,部分质硬标本经98%甲酸以1 ∶1对标本进行脱钙处理,石蜡包埋,3 μm厚切片并常规行HE染色。免疫组化采用EnVision两步法,一抗CD3、CD4、CD8、CD20、CD38、SMA、H3F3AG34W、RANKL、CD163。denosumab治疗前后组织标本的镜下形态及免疫组化评估,均经3位病理医师共同审阅。
2 结果
2.1 临床特点3例患者均经术前穿刺并结合免疫组化检测诊断为骨巨细胞瘤,其中男性2例,女性1例,年龄分别为20、31、38岁。肿瘤分别位于右股骨远端、右肱骨近端及右股骨远端,denosumab治疗时间分别为1、1、3个月,治疗过程中未发生临床不良反应。
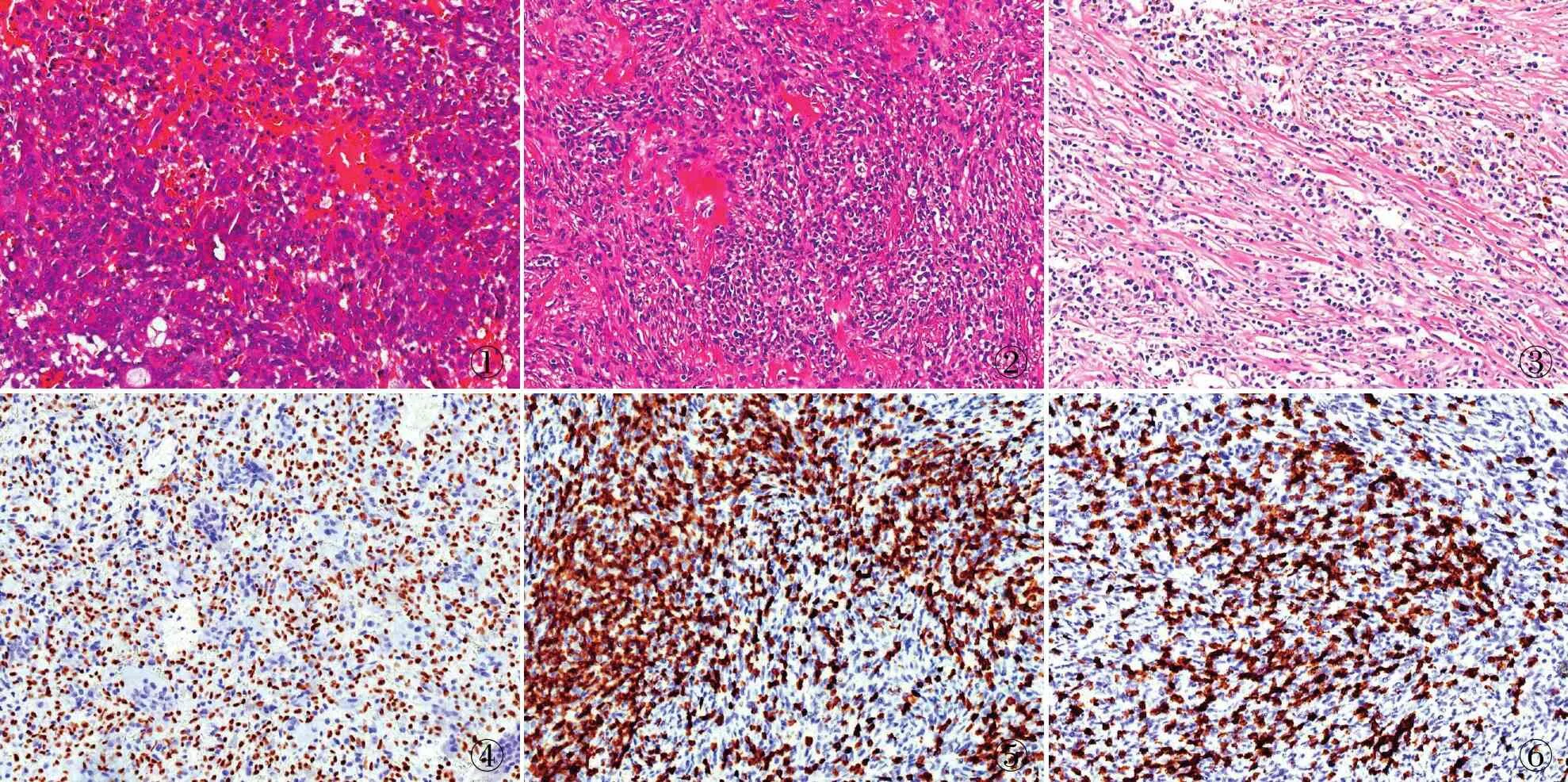
2.2 病理特征3例骨巨细胞瘤患者治疗前穿刺活检均显示经典骨巨细胞瘤形态(图1),未见炎细胞浸润。经denosumab治疗后,均显示巨细胞消失伴大量梭形细胞增生,并有弥漫炎细胞浸润。炎细胞包括淋巴细胞及浆细胞,未见中性粒细胞。瘤细胞呈梭形,细胞核卵圆形,胞质粉染,与反应性的纤维母细胞混杂存在,HE染色形态难以鉴别。部分梭形细胞呈纤维细胞样或肌纤维母细胞样,胞核内可见小核仁,胞质丰富粉染。炎细胞或散在分布,或灶状聚集于梭形的肌纤维母细胞样细胞间,形成炎性肌纤维母细胞性肿瘤的形态;也可形成束状及storiform排列(图2),小灶伴泡沫细胞散在分布,形成似非骨化性纤维瘤样形态。成骨较少,以小灶性为主,3例标本中成骨占比均<5%。新生骨较幼稚,为丝状的粉染骨样基质,伴浆细胞弥漫分布,基质周围见梭形、卵圆形间质细胞;仅极小灶可见略成熟的不规则骨组织,骨间为疏松的纤维结缔组织,但未见成熟的板层骨。局灶以较均一的丝状粉染胶原为主,散在星芒状肌纤维母细胞伴大量浆细胞浸润(图3),形成似IgG4相关硬化性疾病的形态。
2.3 免疫表型术前穿刺活检组织显示瘤细胞H3F3AG34W阳性(图4),多核巨细胞阴性。denosumab治疗后梭形细胞部分显示H3F3AG34W阳性,同时RANKL、CD163均阳性,此部分细胞为治疗后仍然存在的肿瘤细胞。部分梭形细胞SMA阳性,提示为反应性的肌纤维母细胞。浸润的淋巴细胞CD3(图5)、CD8(图6)多呈阳性;CD4少量阳性,CD20散在阳性,CD38显示大量浸润的浆细胞。
①②③④⑤⑥
3 讨论
经denosumab治疗后的骨巨细胞瘤,与原形态相比会发生显著改变:包括巨细胞的消失,呈单一性的梭形细胞增生伴显著纤维化及不同形态骨的形成[3];但对于其中有关炎细胞浸润的报道较少。Rekhi等[4]对27例denosumab治疗后骨巨细胞瘤的组织学形态观察中发现,其中12例除有denosumab治疗后的典型反应外,还出现炎细胞反应,包括淋巴细胞、浆细胞及组织细胞。Wojcik等[5]在4例患者中发现以淋巴细胞为主的炎症,并伴显著的泡沫细胞,或散在分布整个病变处,或在某些区域成簇排列。文献仅报道有炎细胞浸润,但并未对炎细胞的分布进行详尽描述,也未对炎细胞的免疫组化标记进行分类,故难以评估炎细胞的数量及类型。本组病例在治疗前穿刺组织内并未见炎细胞反应,治疗后出现炎细胞广泛分布,表型分析也首次显示炎细胞以CD8阳性的T淋巴细胞为主。在RANKL与免疫系统的研究中发现,RANKL/RANK/OPG通路及其在免疫系统中的功能是炎症与骨骼破坏之间的桥梁。骨巨细胞瘤表达RANKL,RANKL也可由激活CD4阳性的T细胞表达,从而激活破骨细胞,还可以共同刺激其他表达RANK的细胞,如树突状细胞和单核细胞/巨噬细胞,从而促进骨骼中的一系列分解代谢事件。因此,T淋巴细胞是与炎症、自身免疫性疾病和移植排斥相关的局部和全身性骨丢失过程的关键。尽管如此,多项研究也表明RANKL/RANK/OPG通路仅对骨骼的代谢发生作用,对炎症反应没有影响。在对denosumab治疗类风湿性关节炎骨破坏的一项II期临床试验中发现,每年两次向接受甲氨蝶呤治疗的类风湿性关节炎患者注射 denosumab(180 mg),可显著抑制骨结构损伤[6]。在此治疗过程中,骨结构损伤得到抑制,而且也增加皮质骨[7]以及手和手腕[8]的骨矿物质密度,但对炎症并未产生影响。因此,denosumab只能改善骨骼参数。本组病例中出现的大量以CD8阳性为主的T淋巴细胞及浆细胞,与denosumab对RANKL的阻断似乎并无关联。
有实验表明,denosumab除了抑制破骨细胞生成外,还可能调节一系列T细胞介导的反应。最近的一项Meta分析[9]表明,用denosumab治疗骨质疏松或骨质减少的妇女发生严重感染的风险明显高于对照组,其中罕见的严重皮肤感染(主要是下肢)和憩室炎的发生率显著高于对照组。因此,认为RANKL抑制剂可以放大皮肤过敏和炎症反应,而不是增加自身感染的易感性。本组3例患者尽管在denosumab治疗后的肿瘤组织中存在大量的炎细胞反应,但其并无全身感染的症状及炎症指标的升高,因此我们推测这种仅存在于肿瘤内的炎细胞浸润,可能是对肿瘤的反应。此外,尽管穿刺组织内未见明确的炎细胞浸润,也不排除由于穿刺组织的局限性,原肿瘤中确实存在大量的炎性反应,经denosumab治疗后引起了放大效应。本组对denosumab治疗后骨巨细胞瘤的组织形态观察中,此种现象所占比例较少,对于其是否为个体现象或者存在RANKL对T细胞的诱导作用,仍有待于更多的样本进一步分析。
大量淋巴细胞及反应性的肌纤维母细胞/纤维母细胞的存在而产生的组织形态,需与其他形态相似的疾病进行鉴别:(1)炎症性肌纤维母细胞性肿瘤,组织学上由肌纤维母细胞样梭形细胞增生伴浆细胞、淋巴细胞、嗜酸性粒细胞等炎症细胞浸润。免疫组化标记vimentin、SMA、actin均阳性,CD68部分阳性;40%~60%的病例可显示ALK阳性。(2)非骨化性纤维瘤,温和的梭形细胞呈storiform排列,破骨样的巨细胞散在分布,可有含铁血黄素沉积,灶状泡沫样组织细胞增生;结合临床影像学可资鉴别。(3)IgG4相关硬化性疾病,组织学形态伴大量淋巴浆细胞浸润、间质纤维化,其中IgG4阳性浆细胞数>10~100个/HPF,且IgG4/IgG>40%是除组织形态特点外诊断IgG4相关疾病的重要标准。文献报道[10]H3F3AG34W突变抗体在骨巨细胞瘤中的应用有较高的特异性和敏感性,研究已经证实经denosumab治疗后,尽管骨巨细胞瘤组织形态经历较大改变,但H3F3AG34W突变的瘤细胞仍然存活,可资鉴别。本组3例患者均显示治疗前、后H3F3AG34W突变蛋白表达一致。因此,通过突变蛋白检测可以清晰显示肿瘤细胞,结合患者的临床病史及治疗史,可以做出准确诊断。

