lncRNA MEG3对脂多糖诱导人牙髓干细胞衰老的影响
朱婷婷,胡青芳,刘学玉,孙德刚,辛秉昌,高嫘娜
人牙髓干细胞(human dental pulp stem cells, hDPSCs)是一类与骨髓间充质干细胞有着极其相似的免疫表型及形成矿化结节能力的细胞,可自我更新和多向分化[1]。同时,hDPSCs容易培养和低免疫原性,被认为是组织工程学理想的种子细胞,目前其不仅应用于牙齿相关疾病[2],还可以用于糖尿病、心脏疾病和关节炎等疾病的治疗[3-5]。然而,hDPSCs经体外长期培养易发生衰老,影响其增殖速度、多向分化潜能,进而限制其后续应用[6]。因此,探究hDPSCs的衰老机制,探索hDPSCs发生衰老过程中关键作用因子,对于增强hDPSCs的稳定性和拓展其临床应用前景具有重要意义。
近期研究发现,长链非编码RNA(long non-coding RNA, lncRNA)参与调控hDPSCs的衰老及分化过程[7-9]。如,在衰老hDPSCs中lncRNA FAM96B低表达,而过表达lncRNA FAM96B后可明显减少SA-β-gal阳性细胞数、增强hDPSCs矿化能力以及促进其成骨分化[9]。另外,lncRNA母源性印记基因3(maternal imprinting gene 3, MEG3)异常表达与人脂肪干细胞衰老密切相关[10],然而lncRNA MEG3对hDPSCs衰老的作用机制尚未有研究证实。为此,本实验旨在通过分析经脂多糖(lipopolysaccharide, LPS)处理后hDPSCs衰老过程中lncRNA MEG3表达量的变化规律,阐明lncRNA MEG3与hDPSCs衰老的关系,为研究hDPSCs衰老的相关调控机制提供实验依据,以及对牙齿相关疾病的细胞治疗提供新的理论依据和技术支持。
1 材料与方法
1.1 试剂及仪器DMEM培养基、10%胎牛血清、青霉素-链霉素、LPS和SA-β-gal溶液均购于美国Sigma-Aldrich公司;lncRNA MEG3 shRNA(sh-MEG3)、ROCK1 siRNA(si-ROCK1)、pcDNA3.1-ROCK1(OE-ROCK1)及空白质粒均由中国GeneChem公司构建;Trizol试剂盒和RIPA裂解液均购于天根生化科技(北京)公司;Lipofectamine 2000购自美国Invitrogen公司;SYBR GREEN Master Mix Kit购于北京索莱宝科技公司;Prime-ScriptTM试剂盒购于日本Takara公司;BCA试剂盒购自北京百奥莱博科技公司;ROCK1、p53和p21抗体均购自美国Abcam公司;CO2培养箱购自美国赛默飞公司;显微镜购自德国莱卡公司;实时荧光定量PCR仪购于美国Applied Biosystems公司;电泳仪和凝胶成像系统购于美国Bio-rad公司;酶标仪购自南京德铁实验设备公司。
1.2 方法
1.2.1hDPSCs细胞分离培养 收集青岛市口腔医院健康志愿者(年龄18~24岁)拔除的完整、无龋坏的第三磨牙15颗,75%乙醇消毒后,用裂钻将牙齿沿牙颈部截断,劈开牙冠打开牙髓腔,取出牙髓组织,PBS清洗,切成1 mm3的碎片。0.3%Ⅰ型胶原酶和0.4%分散酶37 ℃消化45 min后,加入含20%FBS的DMEM培养基中止消化,收集悬液,1 000 r/min离心5 min,加入含10%胎牛血清、100 μg/mL青霉素及链霉素的DMEM重悬,并置于37 ℃ 5%CO2培养箱中恒温培养。每隔48 h更换1次新鲜培养基,细胞生长至密度为80%时进行传代,本实验中所用hDPSCs细胞为第三代。通过流式细胞仪对所分离细胞表面分子CD34、CD44、CD45、CD80、CD90和CD105的表达水平鉴定分离细胞确认为hDPSCs细胞[11]。本实验由青岛市口腔医院伦理委员会批准,志愿者均签署知情同意书。
1.2.2细胞转染 将上述分离纯化的hDPSCs培养,待细胞汇合度到70%~80%时按Lipofectamine 2000转染试剂说明书将sh-MEG3、sh-NC、si-ROCK1、OE-ROCK1、si-NC以及OE-NC分别转染至hDPSCs,并于37 ℃ 5%CO2培养箱中继续培养48 h待用,并采用qRT-PCR和Western blot检测转染效率。
1.2.3LPS诱导hDPSCs衰老 将细胞计数后接种于6孔板,培养144 h,培养过程中使用10 ng/mL LPS刺激hDPSCs,分别刺激1次(处理时间6 h)、3次(每隔48 h经LPS处理6 h)、6次(每隔24 h经LPS处理6 h),以生理盐水组为对照组。
1.2.4qRT-PCR检测lncRNA MEG3的表达水平 使用Trizol Reagent分别提取经处理后的hDPSCs内总RNA,用一步法逆转录试剂盒将全部RNA逆转录成cDNA,以GAPDH为内参,进行PCR扩增,扩增程序为:94 ℃预变性2 min;94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸30 s,合计30个循环。lncRNA MEG3正向引物5′-CTGCCCATCTACACCTCACG-3′,反向引物5′-CTCTCCGCCGTCTGCGCTAGGGGCT-3′;内参GAPDH正向引物5′-CAAGATCATCAG CAATGCCT-3′,反向引物5′-ATGGACTGTGGTCAT GAGT-3′。结果采用2-ΔΔCt法计算lncRNA MEG3的相对表达量。
1.2.5Western blot法检测ROCK1、p53和p21蛋白的表达 收集各组待测hDPSCs,PBS洗涤2次,加入RIPA裂解液,37 ℃水浴30 min,12 000 r/min离心10 min,取上清,使用BCA法测定蛋白浓度。每组用等量蛋白样品进行SDS-PAGE电泳分离蛋白条带,并用电转移法将蛋白转移至PVDF膜上,5%脱脂奶粉封闭2 h,后和一抗ROCK1(1 ∶2 000)、p53(1 ∶1 000)和p21(1 ∶1 000)在4 ℃孵育过夜;次日,TBST洗涤3次,将膜加入HRP标记的二抗(1 ∶10 000)室温孵育2 h;TBST洗涤3次后加入ECL化学发光液进行显影,然后在凝胶成像仪上拍照显影,采用Image J灰度分析软件分析灰度值,计算相对表达量。
1.2.6β-半乳糖苷酶(SA-β-gal)染色检测细胞衰老 将经处理后的hDPSCs接种于新的6孔板,于37 ℃ 5%CO2条件下培养48 h;吸除培养基,用PBS缓冲液洗涤,每孔加入SA-β-gal染色固定液1 mL,室温下静置固定15 min;去除细胞固定液,用PBS缓冲液洗涤细胞3 min,洗涤3遍;配置染色工作液,每孔加入1 mL染色工作液,37 ℃孵育过夜;次日光学显微镜下观察。阳性细胞染色后呈蓝绿色,阴性细胞不被染色;显微镜下各组选取3个视野,计数细胞总数和SA-β-gal染色阳性细胞数,计算阳性细胞数占总细胞数的百分比。
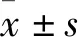
2 结果
2.1 LPS诱导hDPSCs衰老过程中lncRNA MEG3和ROCK1的表达水平qRT-PCR检测结果显示,相比于对照组,LPS处理hDPSCs后可显著上调lncRNA MEG3的表达水平,且在LPS处理6次时,lncRNA MEG3的表达水平最高(P<0.001,图1)。

图1 qRT-PCR检测lncRNA MEG3在LPS处理hDPSCs不同次数后的表达水平:*P<0.05,**P<0.01,***P<0.001
Western blot检测结果显示,与对照组相比,LPS处理hDPSCs后衰老相关蛋白(p53和p21)以及ROCK1的表达水平均升高,且随着处理次数的增加,上调效应也逐渐增强,尤其是作用6次后衰老相关蛋白及ROCK1的表达水平最高(P<0.001,图2)。这些结果表明,在LPS处理6次后可显著诱导hDPSCs衰老,且上调了lncRNA MEG3和ROCK1的表达水平。

图2 Western blot法检测ROCK1和衰老相关蛋白p53和p21的表达水平:A.电泳图;B.柱状图;*P<0.05,**P<0.01,***P<0.001
2.2 敲降lncRNA MEG3对LPS诱导hDPSCs衰老的影响基于LPS处理hDPSCs后lncRNA MEG3表达上调,为进一步探讨lncRNA MEG3在LPS诱导hDPSCs衰老的作用,采用qRT-PCR检测转染效率结果显示,相比于sh-NC组,转染sh-MEG3于hDPSCs中可显著下调lncRNA MEG3的表达水平(0.95±0.17vs0.39±0.13,P<0.01)。同时,相比于sh-NC组,敲降lncRNA MEG3(sh-MEG3组)后可显著下调未用LPS处理的对照组和LPS处理6次组中hDPSCs衰老相关蛋白(p53和p21)的表达(P<0.05,图3)。

图3 Western blot法检测敲降lncRNA MEG3对LPS诱导hDPSCs衰老相关蛋白表达水平的影响:A.电泳图;B.柱状图;*P<0.05,**P<0.01
进一步采用SA-β-gal染色检测敲降lncRNA MEG3对LPS诱导hDPSCs衰老的影响(图4)。在未用LPS处理的hDPSCs对照组中,对照组(未转染)、sh-NC组和sh-MEG3组SA-β-gal阳性细胞率(%)分别为27.31±3.61、26.69±2.73和8.44±4.8;LPS处理6次组中,各分组的SA-β-gal阳性细胞率(%)分别为38.24±8、35.33±4.3和12.53±2.88。在未用LPS处理的对照组和LPS处理6次组中,sh-MEG3组的SA-β-gal阳性细胞率均低于sh-NC组(P<0.01)。上述实验结果提示,敲降lncRNA MEG3可显著缓解LPS诱导的hDPSCs衰老。

对照组sh-NCsh-MEG3未处理组LPS处理6次
2.3 敲降ROCK1缓解LPS诱导的hDPSCs衰老进一步分析敲降ROCK1对LPS诱导hDPSCs衰老的影响。Western blot检测结果显示,相比于si-NC组,敲降ROCK1(si-ROCK1组)显著下调ROCK1在未用LPS处理的对照组和LPS处理6次组hDPSCs中的表达水平(P<0.01,图5)。同时,敲降ROCK1显著下调衰老相关蛋白p53和p21的表达水平(P<0.05,图5)。

图5 Western blot法检测敲降ROCK1对LPS诱导hDPSCs衰老相关蛋白表达水平的影响:A.电泳图;B.柱状图;*P<0.05,**P<0.01
SA-β-gal染色结果显示,在未用LPS处理的对照组中,对照组(未转染)、si-NC组和si-ROCK1组SA-β-gal阳性细胞率(%)分别为25.36±3.9、31.69±4.41和6.17±6.07;LPS处理6次组中,各分组的SA-β-gal阳性细胞率(%)分别为33.22±3.73、32.78±6.04和15.08±2.3。在未用LPS处理的对照组和LPS处理6次组中,si-ROCK1组的SA-β-gal阳性细胞率均低于si-NC组(P<0.01,图6)。由此可知,敲降ROCK1可显著缓解LPS诱导的hDPSCs衰老。

对照组si-NCsi-ROCK1未处理组LPS处理6次
2.4 敲降lncRNA MEG3通过下调ROCK1缓解LPS诱导的hDPSCs衰老上述实验结果表明,单独敲降lncRNA MEG3或ROCK1可显著缓解LPS诱导的hDPSCs衰老。为进一步探讨lncRNA MEG3是否通过ROCK1介导LPS诱导的hDPSCs衰老。Western blot法检测结果表明,相比于仅过表达ROCK1(OE-ROCK1组),ROCK1在sh-MEG3 + OE-ROCK1组中的表达水平明显下调(P<0.01)。同时,仅过表达ROCK1可显著上调LPS处理hDPSCs中衰老相关蛋白p53和p21的表达水平(P<0.05),但同时敲降lncRNA MEG3(sh-MEG3+OE-ROCK1组)可明显下调过表达ROCK1对LPS处理hDPSCs中衰老相关蛋白的促进作用(P<0.01,图7)。

图7 Western blot法检测单独过表达ROCK1或同时过表达ROCK1并敲降lncRNA MEG3后ROCK1和衰老相关蛋白的表达水平:A.电泳图;B.柱状图;*P<0.05,**P<0.01
SA-β-gal染色结果显示,在未用LPS处理的对照组中,对照组(未转染)、OE-NC组、OE-ROCK1组和sh-MEG3+OE-ROCK1组SA-β-gal阳性细胞率(%)分别为28.83±3.56、25.11±4.56、37.04±2.87和22.2±2.79;LPS处理6次组中,各分组的SA-β-gal阳性细胞率(%)分别为35.11±5.44、36.81±6.03、51.28±3.24和28.84±5.89。在未用LPS处理的对照组和LPS处理6次组中,过表达ROCK1较OE-NC组可显著上调hDPSCs中SA-β-gal阳性细胞数(P<0.05),但同时敲降lncRNA MEG3可显著下调ROCK1单独过表达的作用效果(P<0.01,图8)。可见,敲降lncRNA MEG3可能通过抑制ROCK1的表达水平,进而缓解LPS诱导hDPSCs的衰老。

对照组OE-NCOE-ROCK1sh-MEG3+OE-ROCK1对照组LPS处理6次
3 讨论
lncRNA是非编码RNA的重要组成部分,其长度大于200个核苷酸,在细胞生命活动中发挥表观遗传调控、基因转录水平及转录后水平调控、剂量补偿效应等作用[12-13]。其中,lncRNA MEG3是一种多效的lncRNA,参与肿瘤细胞的分化、增殖、凋亡、血管生成、转移等,且在多种肿瘤组织和细胞中低表达[14]。近几年研究发现,lncRNA MEG3也参与细胞衰老。如lncRNA MEG3能够抑制小鼠卵巢颗粒细胞增殖,并促进卵巢功能早衰[15]。本实验结果显示,lncRNA MEG3在LPS处理后的hDPSCs中高表达,且敲降lncRNA MEG3后可明显抑制LPS诱导hDPSCs中衰老相关蛋白p53和p21的表达水平,同时也下调了SA-β-gal阳性细胞数。机制上,敲降lncRNA MEG3通过下调ROCK1缓解LPS诱导的hDPSCs衰老。
ROCK1是一种蛋白丝氨酸/苏氨酸激酶,是GTPase RhoA的主要下游效应因子,并且是细胞骨架中产生收缩力的肌球蛋白的调节因子。ROCK1在癌症、特定细胞活力、细胞转移、血管新生等方面具有重要作用[16]。有研究证实,ROCK1在肌腱干细胞衰老细胞中高表达,且敲降ROCK1可显著诱导年青人肌腱干细胞增殖、诱导移行和腱分化[17]。Chen等[18]研究也发现,ROCK1在衰老加速倾向的小鼠中过表达。Scott等[19]发现,ROCK1抑制剂能够抑制内皮细胞衰老。然而,ROCK1对hDPSCs衰老的影响却鲜有报道。
本实验首先用LPS处理hDPSCs诱导其衰老,根据处理次数不同,设立1、3、6次三个实验组,结果显示与对照组相比,随着LPS处理次数增加,各组细胞中ROCK1和衰老相关蛋白(p53和p21)的表达水平都在逐渐上调。研究结果提示,ROCK1异常高表达与hDPSCs衰老有关。p53/p21已被证实是调控细胞衰老的重要分子,p53/p21过表达与细胞周期、凋亡和转录调控有关[20-22]。也有研究证实,p53/p21通路在细胞衰老过程中被激活[23-24]。因此在本实验中,选择p53、p21作为检测hDPSCs衰老过程的重要标志因子。为进一步验证lncRNA MEG3是否通过ROCK1对hDPSCs衰老起调控作用,本实验在hDPSCs中过表达ROCK1并敲降lncRNA MEG3,结果显示过表达ROCK1组p53、p21表达明显上调,hDPSCs衰老细胞明显增加;相反,敲降lncRNA MEG3明显下调了过表达ROCK1对hDPSCs衰老的促进作用。
综上所述,本实验结果证实lncRNA MEG3/ROCK1分子轴是hDPSCs衰老过程中重要信号通路调控因子。敲降lncRNA MEG3可通过下调ROCK1表达抑制LPS诱导的hDPSCs衰老。本实验解释了hDPSCs衰老的潜在发生机制,也为hDPSCs在细胞治疗中的应用提供实验基础。

