miR-32-5p靶向ZEB1、ZEB2基因调控乳腺癌增殖和侵袭能力的机制
俞 杨,姚 嘉,杨时平,李冠乔
ZEB1、ZEB2是E-cadherin的候选阻遏物。ZEB1、ZEB2蛋白参与包括骨骼组织、平滑肌组织、神经组织等多种组织的分化[1-2]。ZEB1、ZEB2在多种肿瘤中异常表达,包括胰腺癌[3]、肺癌[4]、肝癌[5]、结肠癌[6]和乳腺癌[7]。近年研究显示,miR-32-5p参与调控胰腺癌、前列腺癌、肝细胞癌等肿瘤细胞的增殖、迁移、侵袭等恶性生物学行为,与肿瘤的发生、发展密切相关,且在胃瘤、骨肉瘤和结直肠癌等不同肿瘤中起抑癌或致癌作用[8-10]。目前,miR-32-5p在乳腺癌中的表达尚不明确。本实验旨在探讨miR-32-5p及ZEB1、ZEB2在乳腺癌MCF-7细胞系中的作用,并分析两者间的关联性。
1 材料与方法
1.1 材料本实验入组的样本选自2019年1月~2019年6月就诊于海南省人民医院的女性乳腺癌患者,所有患者均经病理学确诊;包括癌旁组织30例和乳腺癌组织30例。本实验经我院伦理委员会批准,患者均签署知情同意书。
1.2 细胞培养MCF-10A、MDA-MB-231和MCF-7细胞购于北京国家实验细胞资源共享平台。MCF-10A给予100 ng/mL霍乱毒素及1%P/S培养,MDA-MB-231用含有10%胎牛血清(浙江天杭生物公司)的L-15培养基(Gibco,美国)进行培养。MCF-7用含有10%胎牛血清(浙江天杭生物公司)的MEM培养基(Gibco,美国)进行培养。
1.3 qRT-PCR检测通过qRT-PCR法检测癌旁组织和乳腺癌组织中ZEB1、ZEB2和miR-32-5p的表达水平;检测乳腺癌细胞系MCF-10A、MDA-MB-231和MCF-7中ZEB1和ZEB2的表达水平,以及MCF-7细胞中ZEB1和ZEB2敲除效率。利用Trizonl(上海生工公司)提取组织或细胞中的RNA,用逆转录试剂盒(北京天根生化科技公司)逆转录合成cDNA,荧光染料法(SYB Green,罗氏,美国)进行实时定量PCR检测,QuantStudio 3仪器(Applied Biosystem,美国)检测荧光信号。miR-32-5p、U6、ZEB1、ZEB2和GAPDH引物由上海生工公司合成。miR-32-5p表达以U6为内参,ZEB1和ZEB2表达以GAPDH为内参。
1.4 Western blot检测取处于对数生长期的细胞或组织(癌旁和癌)用含蛋白酶抑制剂的RIPA裂解液进行裂解,12 000 r离心20 min,上清即为蛋白。BCA试剂盒(北京普利莱基因公司)进行蛋白浓度的定量,加入5×Loarding buffer进行蛋白的变性。取等量的蛋白用SDS-PAGE凝胶进行电泳,电泳完成后转移到NC膜(密理博中国公司)上,5%脱脂牛奶室温封闭1 h,一抗孵育过夜(ZEB1、ZEB2、E-cadherin、vimentin和GAPDH抗体购于美国Abcam公司),TBS-T清洗3次,每次10 min,用HRP偶联的二抗(北京中杉金桥公司)室温孵育1 h,TBS-T清洗3次,每次10 min。ECL进行避光显影,化学发光成像仪采集图像(Bio-Rad,美国)。
1.5 免疫组化用4%多聚甲醛固定组织,于20%蔗糖中4 ℃过夜。制作蜡块,切片,贴片。TBS-T清洗3次,0.3%过氧化氢-甲醇作用30 min,TBS-T清洗3次。0.3%Triton X100作用30 min,TBS-T清洗3次。加入用血清稀释液稀释的一抗4 ℃孵育过夜,TBS-T清洗3次。TBS-T稀释的二抗室温孵育2 h,TBS-T清洗3次。加入显色液,进行免疫组化显色,梯度乙醇脱水后,封固,拍照。
1.6 免疫荧光检测MDA-MB-231和MCF-7细胞中ZEB1和ZEB2的表达水平,将细胞消化吹散,按5×105个/孔接种于6孔板中,24 h后取出已爬好细胞的玻片,PBS清洗3次。4%多聚甲醛固定15 min,PBS清洗3次。0.5%Triton X-100室温孵育20 min,PBS清洗3次。正常山羊血清室温封闭30 min,PBS清洗3次。加足够量稀释好的一抗,湿盒中4 ℃孵育过夜。PBS清洗3次,滴加稀释好的荧光二抗,湿盒中室温孵育1 h。Hoechst避光孵育5 min,PBS清洗3次。用含抗荧光淬灭剂的封片液封固,荧光显微镜(奥林巴斯)下观察、采集图像。
1.7 细胞凋亡染色检测MCF-7细胞中敲减ZEB1和ZEB2,以及加入miR-32-5p抑制剂后的细胞凋亡情况。按照试剂盒说明书的步骤进行染色(北京索莱宝公司),最后荧光显微镜(奥林巴斯)下观察、采集图像。
1.8 克隆形成实验检测MCF-7细胞中敲减ZEB1和ZEB2后细胞克隆形成能力。将细胞消化吹散,按照每孔500个细胞种到6孔板中,每个做3个孔。5%CO2、37 ℃培养2~3周后,弃上清,PBS小心清洗3次,4%多聚甲醛固定15 min,Giemsa染色液染15 min,流水缓慢洗去染色液。照相机拍照并计数。
1.9 划痕实验检测MCF-7细胞敲减ZEB1和ZEB2后的细胞迁移能力。先用Marker笔在6孔板背后用直尺划横线。在每孔中加入5×106个细胞,过夜铺满。第2天用枪头沿着直尺,尽量垂直于背后的横线划痕,枪头要垂直,不能倾斜(不同孔之间使用同一枪头),PBS清洗3次,加入无血清培养基。37 ℃、5%CO2培养箱中培养,24 h后取出拍照。Image J软件计算细胞间距离的均值。
1.10 细胞侵袭和迁移检测检测MCF-7细胞敲减ZEB1和ZEB2,以及加入miR-32-5p抑制剂后细胞侵袭和迁移能力的变化。在迁移小室(密理博中国公司)铺上30 μg基质胶(BD,美国),37 ℃ 30 min形成重构的基质膜。上小室中加入200 μL含1×105个细胞的无血清培养基,下小室中加入600 μL含血清培养基。培养24 h后,检测细胞的侵袭情况。4%多聚甲醛固定15 min,苏木精染色15 min,然后用棉签移除上小室中非迁移的细胞。显微镜(奥林巴斯,日本)下拍照,计数。迁移步骤和侵袭类似,只是迁移小室中未加基质胶。
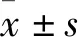
2 结果
2.1 乳腺癌组织中ZEB1、ZEB2与miR-32-5p表达的关系癌旁组织和乳腺癌组织中ZEB1和ZEB2蛋白表达相比,乳腺癌组织中ZEB1和ZEB2蛋白表达均高于癌旁组织(图1A)。乳腺癌组织中ZEB1 mRNA(t=11.72,P<0.001)和ZEB2 mRNA(t=16.6,P<0.001)表达水平均高于癌旁组织(图1B)。乳腺癌组织中miR-32-5p表达水平高于癌旁组织(图2)。经Person相关性检验结果显示,ZEB1表达与miR-32-5p表达呈正相关(R2=0.743 7,P<0.001),ZEB2表达与miR-32-5p表达呈正相关(R2=0.679 5,P<0.001,图3)。

图1 A.癌旁组织和乳腺癌组织中ZEB1和ZEB2蛋白的表达;B.癌旁组织和乳腺癌组织中ZEB1和ZEB2 mRNA的表达:N.正常组织;T.癌组织;与癌旁组织相比,***P<0.001

图2 癌旁组织和乳腺癌组织中miR-32-5p mRNA的表达

图3 ZEB1、ZEB2表达与miR-32-5p表达的相关性分析:A.ZEB1与miR-32-5p;B.ZEB2与miR-32-5p
2.2 ZEB1、ZEB2在乳腺癌增殖和侵袭中的作用MCF-10A、MDA-MB-231和MCF-7细胞中ZEB1和ZEB2蛋白水平相比,MDA-MB-231和MCF-7细胞中ZEB1和ZEB2蛋白表达水平高于MCF-10A细胞(图4)。Control组与si-ZEB1组ZEB1 mRNA表达水平比较,差异有统计学意义(t=30.59,P<0.001);Control组与si-ZEB2组ZEB2 mRNA表达水平比较,差异有统计学意义(t=20.25,P<0.001,图5)。与Control组比较,si-ZEB1组ZEB1蛋白表达降低;与Control组比较,si-ZEB2组ZEB2蛋白表达降低(图6)。si-ZEB1组与Control组比较,si-ZEB1组细胞克隆形成能力减弱;si-ZEB2组与Control组相比,si-ZEB2组细胞克隆形成能力减弱(图7)。si-ZEB1组与Control组比较,si-ZEB1组细胞迁移能力减弱;si-ZEB2组与Control组比较,si-ZEB2组细胞迁移能力减弱(图8)。si-ZEB1组与Control组比较,si-ZEB1组细胞侵袭能力减弱;si-ZEB2组与Control组比较,si-ZEB2组细胞侵袭能力减弱(图8)。si-ZEB1组与Control组比较,si-ZEB1组E-cadherin蛋白表达增加,vimentin蛋白表达降低;si-ZEB2组与Control组比较,si-ZEB2组E-cadherin蛋白表达增加,vimentin蛋白表达降低(图9)。上述实验结果表明,ZEB1、ZEB2通过上皮-间质转化(epithelial-mesenchymal transition, EMT)途径影响乳腺癌的增殖和侵袭。

图4 MCF-10A、MDA-MB-231和MCF-7细胞中ZEB1和ZEB2蛋白的表达

图5 敲减ZEB1和ZEB2后,ZEB1和ZEB2 mRNA的表达:A.ZEB1 mRNA的表达;B.ZEB2 mRNA的表达;***P<0.001

图7 敲减ZEB1和ZEB2后的克隆形成情况
2.3 miR-32-5p通过与ZEB1、ZEB2相互作用影响乳腺癌的增殖和侵袭双荧光素酶报告基因实验表明,NC组和miR-32-5p组比较,过表达miR-32-5p能够抑制细胞中荧光素酶的活性,将预测的结合位点突变后,其抑制作用消失(图10)。Control组和miR-32-5p inhibitor组中ZEB1和ZEB2蛋白表达对比,miR-32-5p inhibitor组ZEB1和ZEB2蛋白表达水平降低(图11)。Control组、miR-32-5p inhibitor组、miR-32-5p inhibitor+ZEB1组和miR-32-5p inhibitor+ZEB2组细胞侵袭能力比较:与Control组相比,miR-32-5p inhibitor组细胞侵袭数目减少;与miR-32 inhibitor组相比,miR-32-5p inhibitor+ZEB1组和miR-32-5p inhibitor+ZEB2组细胞侵袭数目增加(图12)。Control组、miR-32-5p inhibitor组、miR-32-5p inhibitor+ZEB1组和miR-32-5p inhibitor+ZEB2组细胞迁移能力比较:与Control组相比,miR-32-5p inhibitor组细胞迁移数目减少;与miR-32-5p inhibitor组相比,miR-32-5p inhibitor+ZEB1组和miR-32-5p inhibitor+ZEB2组细胞迁移数目增加(图12)。Control组、miR-32-5p inhibitor组、miR-32-5p inhibitor+ZEB1组和miR-32-5p inhibitor+ZEB2组E-cadherin和vimentin蛋白表达比较:与Control组相比,miR-32-5p inhibitor组E-cadherin蛋白表达增加,vimentin蛋白表达降低;与miR-32-5p inhibitor组相比,miR-32-5p inhibitor+ZEB1组和miR-32-5p inhibitor+ZEB2组E-cadherin蛋白表达降低,vimentin蛋白表达升高(图13)。
3 讨论
乳腺癌是女性常见的恶性肿瘤之一,肿瘤的侵袭和远处转移高达90%以上,是乳腺癌患者死亡的主要原因,但乳腺癌的具体发病机制尚不明确。通过对乳腺癌的分子生物学研究表明,乳腺癌的发生和发展是一个复杂的过程,是多基因和多因素相互作用的结果。在肿瘤活检和体液中都发现了特定miRNA失调,研究表明,miRNA可以在乳腺癌的发生和发展中起抑癌或癌基因的作用[11],通过对miRNA的研究可能为乳腺癌的治疗提供新的靶点。
EMT是上皮细胞失去特性并获得间质特性的转分化过程。EMT的发生参与了高度移动和侵入癌细胞的生理过程[12]。ZEB1和ZEB2是EMT过程中的关键转录因子。研究表明,ZEB1和ZEB2诱导的EMT在癌症发展中至关重要,ZEB1与乳腺癌的增殖、浸润及淋巴结转移有关[13]。ZEB1和ZEB2表达受多种信号通路和成分的调节,包括TGF-β、β-catenin、miRNA和其它因子。本实验发现,ZEB1和ZEB2在乳腺癌中均高表达,抑制ZEB1和ZEB2表达会促进细胞凋亡,ZEB1和ZEB2通过调控E-cadherin和vimentin蛋白表达抑制细胞克隆的形成、迁移和侵袭。为更进一步探究上游调控的miRNA,本实验选择了miR-32-5p为分析对象。Gao等[14]研究发现胰腺癌中miR-32-5p表达水平升高,可影响肿瘤的远期转移,其作用机制与PTEN信号通路有关。

图8 敲减ZEB1和ZEB2后,乳腺癌细胞的迁移和侵袭情况

图9 敲减ZEB1和ZEB2后,EMT相关蛋白E-cadherin和vimentin的表达

图10 ZEB1、ZEB2与miR-32-5p的结合位点,双荧光素酶报告系统验证结合位点:A.ZEB1;B.ZEB2;***P<0.001

图11 抑制miR-32-5p后,ZEB1和ZEB2蛋白的表达

图13 抑制miR-32-5p后,E-cadherin和vimentin蛋白的表达

图12 抑制miR-32-5p后细胞侵袭和迁移情况
敲出miR-32-5p基因可导致SPC-A1细胞的活力显著下降,细胞周期停滞在G2/M期,并抑制迁移和侵袭[15]。衣兰娟等[16]研究发现,与正常胃黏膜细胞相比,胃癌细胞中miR-32-5p表达显著升高,且抑制miR-32-5p表达可抑制Cyclin D1、MMP-2和MMP-9蛋白表达,从而降低胃癌细胞的生物活性,提高其凋亡率。本实验结果发现,乳腺癌组织样本和细胞系中miR-32-5p过表达,并且miR-32-5p表达与ZEB1和ZEB2表达呈正相关。首次阐明了miR-32-5p通过与ZEB1和ZEB2的3′UTR相互作用,调控乳腺癌的增殖、凋亡、迁移和侵袭。

