干扰素诱导跨膜蛋白2 对脑心肌炎病毒体外增殖的影响
毕英杰,谢晶莹,许淑娟,邓盈盈,李倬,冯若飞
1.西北民族大学生物医学研究中心生物工程与技术国家民委重点实验室,甘肃兰州730030;2.甘肃农业大学动物医学院,甘肃兰州730070
脑心肌炎病毒(encephalomyocarditis virus,EMCV)于1945 年由HELWIG 和SCHMIDT 于佛罗里达州迈阿密首次分离[1],1958 年,巴拿马报道 EMCV 可感染猪并引起致死性心肌炎[2]。我国于2005 年首次分离获得EMCV,命名为BJC3[3]。该病毒属小RNA 病毒科,心病毒属,是无囊膜单股正链RNA 病毒,病毒衣壳为直径30 nm 的二十面体对称结构,每个衣壳由 VP1、VP2、VP3 和 VP4 4 种结构蛋白组成[4]。该病毒可致仔猪致死性心肌炎及怀孕母猪流产、产死胎与木乃伊胎,给各国养猪行业造成了巨大经济损失[5]。
干扰素诱导跨膜蛋白2(interferon induced transmembrane proteins 2,IFITM2)是干扰素诱导跨膜蛋白家族成员之一,1984 年,FRIEDMAN 等[6]通过 cDNA文库筛选,在经干扰素治疗的神经母细胞瘤中鉴定出IFITM 基因。目前,已在人类体内发现了IFITM1、IFITM2、IFITM3、IFITM5 和 IFITM10,其基因位于 11 号染色体上[7],其中IFITM2 主要位于细胞内相关区室,但具体位置尚未明确[8]。有研究证明,IFITM 是一种内源性限制因子,可抑制甲型流感病毒和登革热病毒[9],其抗病毒作用广泛,包括西尼罗病毒(West Nile virus,WNV)、严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus,SARS-CoV)、埃博拉病毒(ebola virus,EBOV)、马尔堡病毒(Marburg virus,MARV)、中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus,MERS-CoV)、人类免疫缺陷病毒1 型(human immunodeficiency virus 1,HIV-1)、黄热病毒(yellow fever virus,YFV)、水泡性口炎病毒(vesicular stoma-titis virus,VSV)和丙型肝炎病毒(hepatitis C virus,HCV)等[10-15]。本研究通过构建重组表达质粒pcDNA3.1-IFITM2,在 HEK293 细胞中探讨 IFITM2 对 EMCV 感染的影响,为后续其作用机制的深入研究奠定基础。
1 材料与方法
1.1 细胞、菌株、病毒、质粒及基因序列 HEK293细胞、BHK-21 细胞、感受态 E.coli BL21、EMCV 毒株PV21 及空载体pcDNA3.1 均由西北民族大学生物医学研究中心提供;靶向IFITM2 的siRNA 序列(siRNA001 序列为:5′-ACCACATTGTGCAAACCTT-3′,siRNA002 序列为:5′-CCAACTACGAGATGCTCAA-3′,siRNA003 序列为:5′-CCATTCTGCTCATCATCAT-3′)及对照序列siRNANC 均由广州瑞博生物科技公司设计合成。
1.2 主要试剂 胰蛋白酶、DMEM 基础培养基及新生牛血清购自兰州民海生物工程有限公司;重组人干扰素 α-2a(recombinant human interferon alpha-2a,IFNα-2a)购自沈阳三生制药集团;细胞总RNA 提取试剂盒 RNAiso plus、LA-Taq 聚合酶及 M-MLV 反转录酶购自日本TaKaRa 公司;去内毒素质粒提取试剂盒购自美国Omega 公司;SYBR Select Master Mix购自美国AppliedBiosystems 公司;LipofectamineTM2000 Transfection Reagent 购自美国 Invitrogen 公司;Opti-MEM 购自美国Gibco 公司;鼠抗β-actin 单克隆抗体购自美国Abcam 公司;兔抗IFITM2 多克隆抗体购自美国Proteintech 公司;HRP 标记的山羊抗鼠及山羊抗兔IgG 购自美国Jackson 公司;Trans-Blot Turbo Mini-size Transfer Stacks 及 Hyper Singal 高敏 ECL 化学发光底物试剂盒购自美国BIO-RAD 公司;RIPA细胞裂解液及PMSF 蛋白保护剂均购自上海碧云天生物技术有限公司。
1.3 细胞培养 将液氮保存的HEK293 及BHK-21细胞于37 ~40 ℃温水中快速溶解,300× g 离心10 min;弃上清,加入1 mL 含10% NBS 的DMEM 培养基重悬,转移至细胞瓶,于37 ℃,5% CO2培养箱中培养。
1.4 重组表达质粒的构建 根据GenBank 中登录的人源IFITM2 基因序列(NM_006435),应用 Primer 5.0 软件设计基因引物,F:5′-GGGGATCCATGAACCACATTGTGCAAAC-3′(下划线部分为BamHⅠ酶切位 点),R:5′-GGGAATTCCTATCGCTGGGCCTGGACGA-3′(下划线部分为EcoRⅠ酶切位点),扩增产物大小为439 bp。引物由西安擎科泽西生物技术有限公司合成。参考文献[16]方法构建人源IFITM2 重组表达质粒,经BamHⅠ和EcoRⅠ双酶切鉴定,将鉴定正确的质粒送西安擎科泽西生物技术有限公司测序,测序正确的重组表达质粒命名为pcDNA3.1-IFITM2。
1.5 HEK293 细胞中IFITM2 过表达情况的检测在LipofectamineTM2000 的介导下,将重组表达质粒pcDNA3.1-IFITM2 及空载体 pcDNA3.1 转染至HEK293 细胞中,于37 ℃转染 24 h 后,收集 HEK293细胞,按RNAiso plus 试剂盒说明书提取细胞总RNA,反转录为cDNA,以其为模板进行qPCR 扩增,扩增条件为:95 ℃预变性 30 s,95 ℃变性 5 s,60 ℃退火34 s,共40 个循环。转染48 h 后,收集转染细胞,RIPA 裂解,经15% SDS-PAGE 分离蛋白后,转移至PVDF 膜,用2.5% 脱脂奶粉于室温封闭1 h;TBST洗涤 3 次,加入兔抗 IFITM2 多克隆抗体(1 ∶3 000稀释)及鼠抗 β-actin 单克隆抗体(1 ∶5 000 稀释),于 4 ℃孵育过夜;TBST 洗涤3 次,加入 HRP 标记的山羊抗兔及山羊抗鼠IgG(1 ∶10 000 稀释),室温孵育1 h;ECL 法显色。同时设空白对照组(未转染)。
1.6 IFITM2 过表达对EMCV 增殖影响的检测 在LipofectamineTM2000 的介导下,将重组表达质粒pc-DNA3.1-IFITM2 和空载体pcDNA3.1 转染至HEK293细胞,于 37 ℃培养 24 h;按 100 TCID50的 EMCV 感染 HEK293 细胞,37 ℃,5%CO2细胞培养箱孵育 2 h;弃培养液,加入含3% NBS 的DMEM 培养基,继续培养 24 h;-80 ℃反复冻融 3 次;于 4 ℃,5 000 × g离心10 min,取培养上清,参照文献[17]方法检测病毒拷贝数,TCID50法检测病毒滴度。
1.7 HEK293 细胞中IFITM2抑制效果的检测 在LipofectamineTM2000 的介导下,将 siRNA(siRNA001、siRNA002、siRNA003)及 siRNANC 序列转染至 HEK-293 细胞(预先经 2 000 IU / mL IFNα2a 刺激 12 h),于37 ℃培养24 h。采用qPCR 法及Western blot 法检测干扰效果,方法同1.5 项。
1.8 IFITM2 下调对EMCV 体外增殖影响的检测将抑制IFITM2表达的HEK293 细胞进行EMCV 感染,并检测子代病毒的病毒拷贝数和病毒滴度,方法同 1.6 项。
1.9 IFITM2 过表达对EMCV 吸附影响的检测HEK293 细胞长满至单层,在LipofectamineTM2000 的介导下,转染重组表达质粒pcDNA3.1-IFITM2,转染24 h 后,按 MOI = 3 接种 EMCV,4 ℃孵育 2 h;用预冷的1 × PBS 洗去未结合的病毒粒子,收集细胞,提取总RNA,参照文献[17]方法检测病毒拷贝数,即为吸附的病毒粒子数。
1.10 IFITM2 过表达对EMCV 进入影响的检测HEK293 细胞长满至单层,在LipofectamineTM2000 的介导下,转染重组表达质粒pcDNA3.1-IFITM2,转染24 h 后,按 MOI = 3 接种 EMCV,4 ℃孵育 2 h;用预冷的1 × PBS 洗去未结合的病毒粒子,加入3% NBS DMEM 培养基,37 ℃孵育 2 h;弃培养上清,1 × PBS洗涤细胞,收集细胞,提取RNA,参照文献[17]方法检测病毒拷贝数,即为进入的病毒粒子数。
1.11 统计学分析 应用GraphPad Prism 5 软件进行统计学分析,数据均采用均值 ± 标准差(±s)表示,组间比较采用T-tests 及One-way ANOVA 方法,以P < 0.05 为差异有统计学意义。
2 结 果
2.1 目的基因扩增产物的鉴定 IFITM2 基因PCR产物经1.2% 琼脂糖凝胶电泳检测,可见439 bp 的目的基因片段,大小与预期一致,见图1。
2.2 重组表达质粒的鉴定 重组表达质粒pcDNA3.1-IFITM2 的双酶切(BamHⅠ/ EcoRⅠ)产物经 1.2%琼脂糖凝胶电泳检测,可见约439 和5 428 bp 的目的基因片段及载体片段,大小与预期一致,见图2。测序结果显示,扩增片段与NCBI原始序列同源性为100%。表明重组质粒pcDNA3.1-IFITM2 构建正确。

图1 IFITM2 基因PCR 产物的电泳图Fig.1 Electrophoretic profile of PCR product of IFITM2 gene
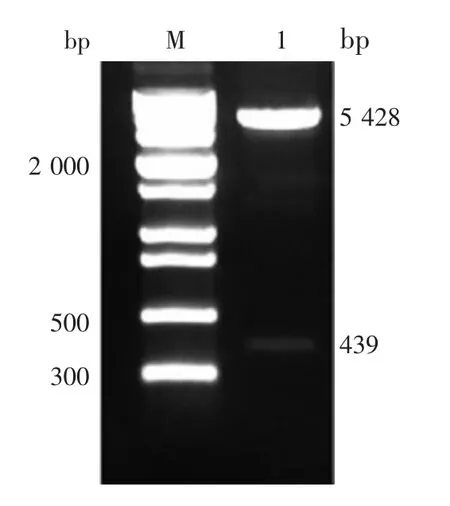
图2 重组质粒pcDNA3.1-IFITM2 的双酶切(BamHⅠ/EcoRⅠ)鉴定Fig.2 Restriction map of recombinant plasmid pcDNA3.1-IFITM2(BamHⅠ/ EcoRⅠ)
2.3 HEK293 细胞中IFITM2 的过表达 pcDNA3.1-IFITM2 组、pcDNA3.1 组和空白对照组 HEK293 细胞IFITM2 基因mRNA 转录水平分别为 1 478.220 00、1.057 50、1.004 24,蛋白表达水平分别为1.80、1.14、1.00。 pcDNA3.1-IFITM2 组 HEK293 细胞IFITM2 基因mRNA 转录水平及蛋白表达水平均明显高于pcDNA3.1 组和空白对照组(F = 1.013,P <0.001),见图3。
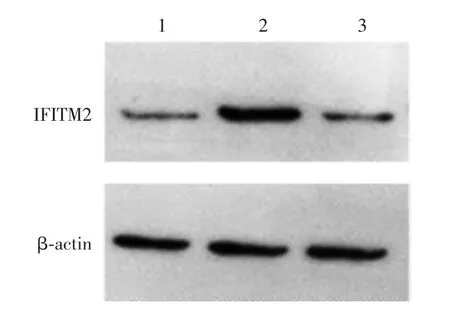
图3 Western blot 法检测过表达IFITM2 蛋白的水平Fig.3 Determination of overexpression level of IFITM2 by Western blot
2.4 过表达IFITM2 对EMCV 体外增殖的影响pcDNA3.1-IFITM2 组及pcDNA3.1 组病毒粒子拷贝数分别为 1.614 51 × 105和 5.068 77 × 106,病毒滴度分别为 10-5.67和 10-6.68TCID50/ mL。pcDNA3.1-IFITM2 组的病毒粒子拷贝数及病毒滴度均显著低于 pcDNA3.1 组(t 分别为 7.32 和 16.83,P 分别<0.001 及<0.05)。表明过表达IFITM2 可抑制EMCV在HEK293 细胞中的增殖。
2.5 HEK293 细胞中IFITM2 的抑制效果 siRNA001、siRNA002、siRNA003 及 siRNANC 组 HEK293 细胞中IFITM2 基因mRNA 转录水平分别为0.39、0.42、0.38、1.00,IFITM2 蛋白表达水平分别 0.36、0.32、0.28、1.00,见图4。siRNA001、siRNA002、siRNA003组HEK293 细胞中IFITM2 基因mRNA 转录水平及蛋白表达水平均明显低于siRNANC 组(F = 131.2,P < 0.001)。表明靶向 IFITM2 的 siRNA 可有效干扰IFITM2 基因的转录和蛋白表达,3 种siRNA 序列的干扰效果差异无统计学意义(F=9.024,P > 0.05),因此,用其混合液(siRNAMix)和siRNANC 分别转染HEK293 细胞,用于后续试验。
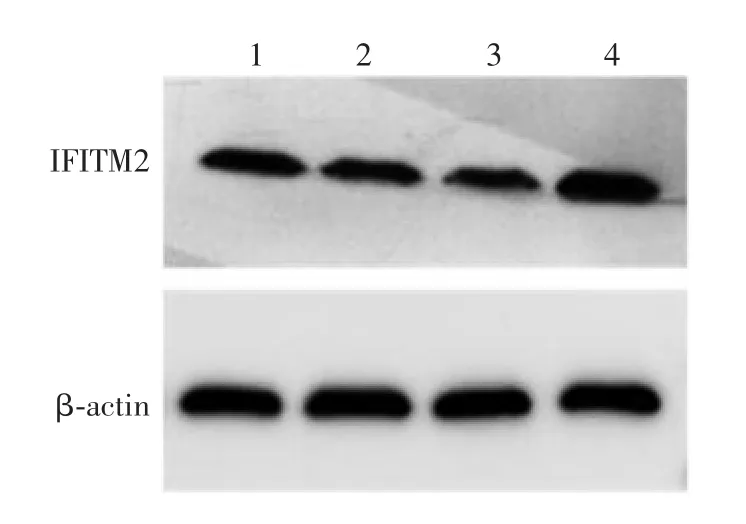
图4 Western blot 法检测 HEK293 细胞中 IFITM2 的抑制情况Fig.4 Western blotting of IFITM2 inhibition in HEK293 cells
2.6 IFITM2 下调对EMCV 体外增殖的影响 si-RNAMix 组和siRNANC 组病毒粒子拷贝数分别为1.23 × 106和 6.38 × 104,病毒滴度分别为 10-7.79和10-6.11TCID50/ mL。siRNAMix 组的病毒粒子拷贝数及病毒滴度均明显高于siRNANC 组(t 分别为8.193 和 5.622,P 均 < 0.001)。提示 HEK293 细胞中敲低IFITM2 可显著促进EMCV 增殖。
2.7 IFITM2 过表达对EMCV 吸附及进入的影响pcDNA3.1-IFITM2 组与pcDNA3.1 组的吸附病毒粒子数分别为 3.303 × 105和 3.440 × 105,进入病毒粒子数分别为1.38×106和3.45×106。pcDNA3.1-IFITM2 组与pcDNA3.1 组的吸附病毒粒子数差异无统计学意义(t = 0.499 8,P > 0.05),pcDNA3.1-IFITM2 组的进入病毒粒子数明显低于pcDNA3.1组(t=7.026,P < 0.01)。表明 IFITM2 蛋白对 EMCV的吸附过程无影响,但可有效抑制病毒的进入过程。
3 讨 论
先天性免疫是机体抵抗病毒感染的第一道防线,干扰素作为重要的抗病毒因子,具有广谱抗病毒作用。病毒感染机体后激活宿主先天免疫,进而产生大量炎症因子和干扰素刺激基因,发挥抗病毒作用。有报道表明,IFITM2 作为干扰素刺激基因的一种,可抑制多种病毒复制[18]。本研究结果表明,HEK293 细胞中过表达IFITM2 可显著抑制EMCV增殖(P < 0.05),同时下调 IFITM2 后可促进 EMCV的增殖(P < 0.001),IFITM2 对 EMCV 的抑制主要发生在病毒感染早期的进入过程,对吸附过程无影响。
早期研究发现,IFITM2 和IFITM3 可限制HIV-1的进入[19],同时IFITM2 还可通过阻止病毒膜与核内体融合,从而限制裂谷热病毒(rift Valley fever virus,RVFV)的感染[20];有研究通过进行单个病毒颗粒融合测定,表明IFITM 还可抑制内体中融合孔的形成,阻止内体中的病毒-细胞融合[21],由此推测IFITM2抑制病毒增殖可能是通过抑制膜融合发挥作用。
另外,IFITM2 不仅可抑制RNA 病毒的复制,还可抑制DNA 病毒复制。有研究指出,IFITM2 可抑制PRV 在PK15 细胞中的复制,通过胆固醇途径发挥作用[22];对非洲猪瘟病毒(african swine fever virus,ASFV)的相关研究也发现,IFITM2 可通过改变膜融合和内体胆固醇含量抑制病毒进人[23]。本研究表明,IFITM2 可抑制EMCV 在HEK293 细胞中的增殖,抑制病毒进入。结合上述研究结果推测,IFITM2 抑制病毒增殖可能与膜融合相关。本研究为后续深入研究IFITM2 抗病毒的作用机制奠定了基础,也为相应抗病毒药物研发提供了实验依据。

