KCNMA1 在胰腺癌细胞系中的表达及其作用机制
严江渝,张策
山西医科大学细胞生理学教育部重点实验室,山西太原030001
胰腺癌(pancreatic cancer,PC)是一种死亡率极高、预后不良的高度侵袭性的恶性肿瘤,总体5 年存活率仍然低于8%,中位生存期仅5 ~6 个月[1]。据估计,至2030 年,PC 将成为美国癌症相关死亡的第二大常见原因[2]。由于缺乏早期筛查技术,大多数PC 患者被诊断时即为晚期,不再适合手术切除[3]。因此,在PC 中急需发现新的治疗靶点。
离子通道是癌症研究中的一个新兴领域,同时被认为是潜在的治疗靶点。在过去的几十年中,离子通道的失调和/ 或功能障碍已被报道存在于不同癌症疾病中[4-5]。离子通道参与许多重要的病理过程,如代谢重组[6]、增殖[7]、细胞凋亡[8]、上皮-间质转化[9]、迁移和侵袭[10-11]。
由细胞内Ca2+和膜去极化激活的K+通道BK 通道(KCNMA1,KCa1.1,MaxiK)在许多细胞类型中广泛表达[12]。除了众所周知的参与调节神经元兴奋性和血管张力功能[13],还有研究表明,BK 通道也与许多类型的癌症的发展和进展相关,包括乳腺癌[14]、胸膜间皮瘤[15]和前列腺癌[16]等。
据报道,KCNMA1 存在于正常胰腺的导管上皮中,并在调节HCO3-分泌中起关键作用[16-17]。但KCNMA1是否可在PC 中表达及其作用机制尚不清楚。本文在PC 细胞系中表达KCNMA1,并探讨其在增殖、凋亡、迁移和侵袭中作用。
1 材料与方法
1.1 细胞 文中所用细胞系均由上海肿瘤研究所张志刚实验室惠赠。
1.2 主要试剂及仪器 DMEM 和RPMI 培养基购自美国Hyclone 公司;胎牛血清(FBS)购自美国Gibco公司;LipofectamineTMRNAiMAX 转染试剂及TRIzol RNA 分离试剂购自美国Invitrogen 公司;Prime ScriptTMRT Master Mix 购自日本TaKaRa 公司;磷酸酶抑制剂购自美国Bimake 公司;BCA 蛋白质测定试剂购自上海碧云天生物技术有限公司;gelRed 购自美国Biotium 公司;Anti-Bcl-2(ab32124)、anti-Bax(ab32-503)、anti-Caspase-3(ab32351)、anti-KCNMA1(ab3586)及 anti-PARP1 抗体(ab32064)购自美国 Abcam 公司;anti-Actin 抗体(R1102-1)和山羊抗兔 IgG 辣根过氧化物酶(HRP)偶联的二抗(HA1023)购自杭州HuaBio 公司;Annexin V-FITC / PI 凋亡测定试剂盒、2 × Taq plus PCR MasterMix 购自北京庄盟国际生物基因科技有限公司;CCK-8 试剂购自日本Dojindo 公司;Transwell 购自美国 Corning 公司;T100 TM 热循环仪系统购自美国Bio-Rad 公司;增强的化学发光蛋白质印迹检测系统购自美国GE 公司;Matrigel 及流式细胞仪购自美国BD 公司。
1.3 细胞培养及基因沉默 Patu-8988T、MiaPaCa-2、PANC-1、Capan-1 细胞在含 10%FBS 的 DMEM 培养基中于 37 ℃和 5%CO2条件下培养,AsPC-1、CFPAC-1、BxPC-3 细胞在含10% FBS 的RPMI 培养基中37 ℃和5% CO2条件下培养。根据LipofectamineTM说明书进行非靶向对照5′-UUCUCCGAACGUGUCACGUTT-3′和靶向 KCNMA1 5′-CUGGCAGAGUCCUGGUUGUTT-3′的 siRNA 转染。siRNA 由 Gene Pharma(上海)合成。转染48 h 后收获细胞并用于以下试验,对照(NC)组为转染非同源 siRNA 组,干扰(si-KCNMA1)组为转染siRNA 靶向敲除KCNMA1 组。所有试验均重复3 次。
1.4 KCNMA1 在PC 细胞系上表达的检测 采用RT-PCR 法。使用TRIzol RNA 分离试剂从细胞中提取总RNA,按PrimeScriptTMRT Master Mix 说明书逆转录合成cDNA,以其为模板,利用2 × Taq plus PCR MasterMix 和T100 TM 热循环仪系统进行RT-PCR扩增。Actin-F 引物序列:5′-GTACGCCAACACAGTGCTG-3′,Actin-R 引物序列:5′-CGTCATACTCCTGCTTGCTG-3′;KCNMA1-F 引物序列:5′-TCTTTGCTCTCAGCATGGTG-3′,KCNMA1-R 引物序列:5′-CCGCAAGCCGAAGTAGAGAAG-3′。引物由赛默飞世尔科技(中国)有限公司合成。PCR 产物经1.5%琼脂糖凝胶电泳分析,使用gelRed 染色,NIH Image 1.60软件分析结果。
1.5 沉默KCNMA1 基因对PC 细胞增殖影响的检测 采用CCK-8 法。具体操作按试剂说明书进行。转染siRNA 48 h 后,用计数板计数PC 细胞,按5 ×103个 / 孔接种至96 孔板中并在生长培养基中培养,分别于 0、24、48 h 加入 CCK-8,10 μL / 孔,37 ℃温育2 h,450 nm 处检测吸光度,绘制生长曲线。
1.6 沉默KCNMA1 基因对PC 细胞凋亡影响的检测 采用 Annexin V-FITC / PI 双染法。细胞转染siRNA 48 h 后,弃掉培养基,PBS 洗涤 2 次,用不含EDTA 的胰酶消化,加入1 mL PBS 吹起细胞,收集液体,700 × g 离心 5 min,预冷 PBS 洗涤 2 次,400 μL 1 × Banding buffer 悬浮细胞,浓度约 1 × 106个 / mL;在细胞悬液中加入5 μL Annexin V-FITC,混匀后于2 ~ 8 ℃避光孵育 15 min;加入 10 μL PI,混匀后于2 ~8 ℃避光孵育5 min;上流式细胞仪进行细胞凋亡分析。
1.7 沉默KCNMA1 基因对PC 细胞迁移及侵袭影响的检测 转染siRNA 48 h 后收集细胞(5×105个),重悬于无血清培养基中,加至覆盖有50 μL Matrige的Transwell 上室,下室加入含10% FBS 的培养基作为化学引诱物,孵育24 h;用棉绒刮擦去除上室细胞,4% PFA 固定并经结晶紫染色,通过计数染色的细胞确定侵入能力。迁移测定除上室内不用Matrigel覆盖,其他方法相同。
1.8 Western blot 分析 转染siRNA 48 h 后收集细胞,用加有苯基甲磺酰氟(PMSF)和磷酸酶抑制剂的蛋白裂解缓冲液(RIPA)裂解细胞30 min;BCA 蛋白质测定试剂测定蛋白质浓度。通过垂直电泳分离蛋白,将分离胶上的蛋白转移至PVDF 膜,室温5%BSA(w / v)封闭 1 h;将膜与一抗于 4 ℃温育过夜;PBST 洗涤,将膜与辣根过氧化物酶(HRP)偶联的二抗于室温温育1 h;PBST 洗涤,用增强的化学发光蛋白质印迹检测系统检测蛋白质-抗体复合物。
2 结 果
2.1 KCNMA1 在PC 细胞系上的表达 PCR 结果显示,KCNMA1 在 MiaPaCa-2 和 PANC-1 细胞上的表达水平明显高于其他细胞系,见图1,因此选取MiaPaCa-2 和PANC-1 细胞进行后续试验。Western blot 分析显示,转染siRNA 48 h 后,能显著减少KCNMA1 蛋白在MiaPaCa-2 和PANC-1 细胞上的表达,见图2。

图1 KCNMA1 在PC 细胞系上表达的RT-PCR 检测Fig.1 Determination of expression of KCNMA1 in PC cell lines by RT-PCR
2.2 沉默KCNMA1 基因对PC 细胞增殖的影响 结果显示,与NC 组相比,从接种转染siRNA 的MiaPaCa-2 和 PANC-1 细胞后 24 h 开始,各 si-KCNMA1 组 A450即明显升高,差异均有统计学意义(MiaPaCa-2 细胞中 0、24、48 h t 值分别为 0.854、0.031 和 0.000,PANC-1 细胞中 0、24、48 h t 值分别为 0.963、0.024和 0.008,P 均 < 0.05),见图3,表明在 MiaPaCa-2和PANC-1 细胞中降低KCNMA1 的表达均可使细胞活力降低,抑制增殖。
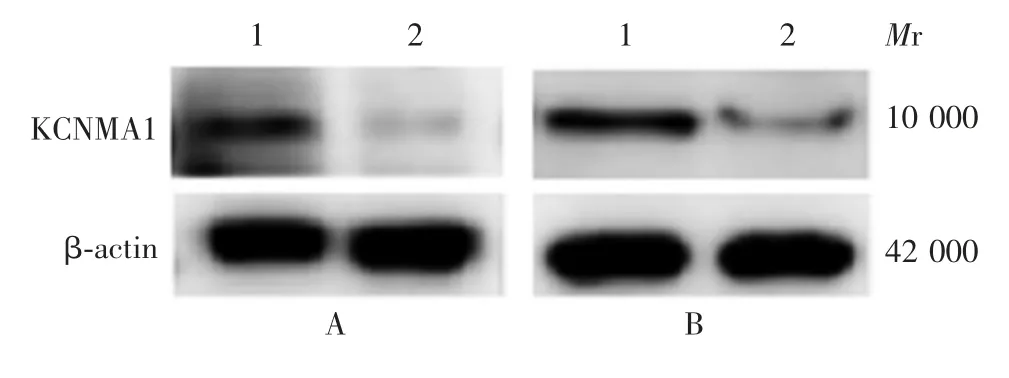
图2 沉默KCNMA1 对其在PC 细胞系上表达影响的Western blot 分析Fig.2 Analysis of effect of silencing KCNMA1 on expression of KCNMA1 in PC cell lines by Western blot
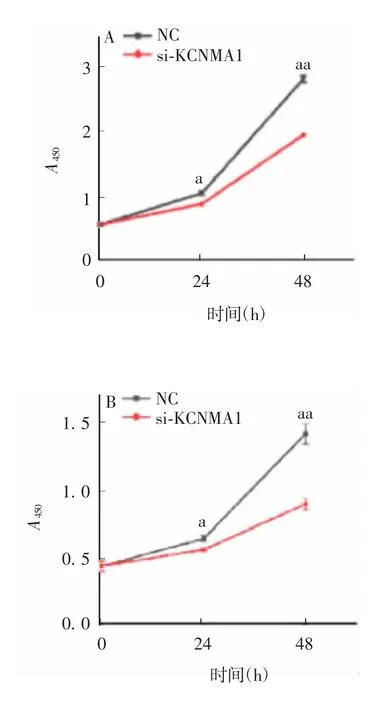
图3 沉默 KCNMA1 基因对 MiaPaCa-2(A)和 PANC-1细胞(B)增殖的影响Fig.3 Effect of KCNMA1 on proliferation of MiaPaCa-2(A)and PANC-1(B)cells
2.3 沉默KCNMA1 基因对PC 细胞凋亡的影响 流式细胞术结果显示,在MiaPaCa-2 和PANC-1 细胞系中下调KCNMA1 后,凋亡比例分别从8.65%和9.99%增加至12.72%和25.1%,见图4;Western blot 分析显示,与 NC 组相比,si-KCNMA1 组凋亡相关蛋白 BAX、Cleaved-PARP1、Actived-Caspase-3 在MiaPaCa-2 和 PANC-1 细胞上的表达增加,BCL-2 在MiaPaCa-2 细胞上的表达减少,但在PANC-1 细胞上的表达增加,见图5,与流式细胞术分析结果一致。表明沉默KCNMA1 基因诱导了PC 细胞凋亡的产生。

图4 沉默KCNMA1 基因对PC 细胞凋亡影响的流式细胞术检测Fig.4 Flow cytometry of effect of silencing KCNMA1 gene on apoptosis of PC cells

图5 沉默KCNMA1 基因对PC 细胞凋亡相关蛋白表达影响的Western blot 分析Fig.5 Analysis of effect of silencing KCNMA1 gene on expression of proteins associated with apoptosis of PC cells by Western blot
2.4 沉默KCNMA1 基因对PC 细胞迁移及侵袭的影响 结果显示,与NC 组相比,通过下调KCNMA1,MiaPaCa-2 和PANC-1 细胞的迁移明显减弱,细胞数分别从(183.7 ± 4.4)和(186.7 ± 8.2)个减少至(103.8 ± 10.6)和(117 ± 12.2)个,差异有统计学意义(t 均为 0.000,P 均 < 0.01),见图6;在 MiaPaCa-2 和PANC-1 细胞的侵袭表型上观察到相同的结果,细胞数分别从(118.4 ± 13.3)和(192.1 ± 16.0)个减少至(63 ± 5.8)和(116.8 ± 9.8)个,差异有统计学意义(t 均为 0.000,P 均 < 0.01),见图7。表明沉默KCNMA1 抑制了PC 细胞的迁移及侵袭能力。

图6 沉默KCNMA1 基因对PC 细胞迁移的影响Fig.6 Effect of silencing KCNMA1 gene on migration of PC cells

图7 沉默KCNMA1 基因对PC 细胞侵袭的影响Fig.7 Effect of silencing KCNMA1 gene on invasion of PC cells
3 讨 论
根据美国癌症协会的数据,2018 年有超过170万新病例被诊断出来[1]。至目前为止,PC 作为消化道恶性肿瘤,具有发病隐匿、早期转移、局部肿瘤侵袭和化疗耐药性等特点。越来越多的证据表明,离子通道不仅可以调节可兴奋细胞中的离子稳态和电信号,还可以调节多种类型癌细胞中的细胞增殖、转移及分化[5,17]。因此,离子通道很可能成为癌症的潜在治疗靶点。
有报道显示,KCNMA1 在许多癌细胞中发挥重要作用[5,18];BLOCH 等[16]报道,KCNMA1 基因扩增可促进前列腺癌中肿瘤细胞的增殖;CAMBIEN等[19]发现,敲除 BKα 促进了骨肉瘤的发展;EDALAT等[20]发现,BK 通道阻断抑制胶质母细胞瘤细胞的辐射诱导的迁移 / 脑浸润;KHAITAN 等[14]报道,KCNMA1 在乳腺癌中的表达与脑转移有关。本研究首次报道KCNMA1 可表达于PC 细胞MiaPaCa-2 和PANC-1 中。
肿瘤细胞增殖及抗凋亡活性均较正常细胞明显升高,使得恶性肿瘤能够无限增殖[21];在癌症背景下,沉默KV9.3 抑制结肠癌和胃癌细胞的增殖[22];HERG 钾通道在急性髓性白血病中组成性表达,并调节白血病造血祖细胞的细胞增殖[23];阻断Nav1.5 通道可减少卵巢癌细胞的迁移及增殖[24]。本研究发现,KCNMA1 具有潜在的调节增殖及抗细胞凋亡作用,经流式细胞术检测发现,沉默KCNMA1 诱导了PC 细胞凋亡,同时运用Western blot 法检测了凋亡相关蛋白 BAX、BCL-2、Cleaved-PARP1、Actived-Caspase-3 的表达,与流式细胞术结果一致。表明KCNMA1 在MiaPaCa-2 和PANC-1 两个细胞系中对凋亡相关蛋白的调节具有不同的作用,下调KCNMA1引起BCL-2 在MiaPaCa-2 上表达减少而在PANC-1上表达增加。
癌症转移是导致超过90%人类癌症死亡的根本原因[25]。转移级联是一个多步骤的过程,作为第一步,细胞迁移在转移中起着不可分割的作用。细胞迁移的特点是极化细胞和分子过程,促进前缘突出(局部体积增大)和后缘收缩(局部体积减小),离子通道在迁移过程中起到关键作用[18]。在促进细胞迁移中对离子通道活性的依赖性已经被反复报道。如BK 通道的沉默或药物抑制会损害胶质瘤细胞迁移[26];KCa3.1 通道参与体内胶质母细胞瘤的浸润行为[27]。本研究发现,KCNMA1 参与 PC 细胞的迁移及侵袭,沉默KCNMA1 抑制了PC 细胞迁移及侵袭的能力。
综上所述,在PC 细胞中沉默KCNMA1 能抑制癌细胞增殖、迁移及侵袭,促进细胞凋亡。KCNMA1可能为PC 的治疗提供新的靶点。

