安宁思茅松毛虫6龄幼虫肠道可培养细菌的多样性研究*
李选文,熊智,黄雨云,张珊,周艺萍,韦建福,4,熊忠平
(1.西南林业大学 生命科学学院,云南 昆明 650224;2.西南林业大学 继续教育学院,云南 昆明 650224;3.西南林业大学 生物多样性学院,云南 昆明 650224;4.云南师范大学 生命科学学院,云南 昆明 650500)
思茅松毛虫(Dendrolimukikuchii)隶属于鳞翅目(Lepidoptera)枯叶蛾科(Lasiocampidae)松毛虫属(Dendrolimus),最早在云南思茅发现而命名[1],主要分布在云南、四川、湖南、湖北、贵州等省[2]。思茅松毛虫是我国危害松树最为严重的6种松毛虫之一,具有繁殖潜能大、数量波动明显、迁移能力强、暴食性明显等特征[3]。当其大面积爆发时,会使大量松科(Pinaceae)植物枯萎死亡,状如火烧,严重影响相关地区的生态环境和林业产业,给当地人们的生产生活带来极大不便[4]。2000年江西省萍乡市莲花县,爆发过一次思茅松毛虫灾害,导致湿地松(Pinuselliottii)的受灾面积达到522 hm2[5]。
近年来,对思茅松毛虫的防治方法主要为营林措施[6]、物理防治[6]、化学防治[7-8]以及生物防治[9]。但随着化学药品的使用,在思茅松毛虫体内产生了一定的抗药性,因此,白僵菌(Beauvriabassiana)[9]、苏云金杆菌(Bacillusthriengiensis)、病毒[10]等生物防治成为了新型的防治方式。随着研究的进展,昆虫肠道微生物越来越成为研究的热点[11],越来越多种类的昆虫肠道内微生物的多样性及其对寄主的生理功能也逐渐显现,能够应用于害虫防治、昆虫资源的开发以及生物能源的生产等领域[12]。昆虫肠道作为昆虫重要的组成器官,承担着昆虫生长发育等重要的生命活动。寄居在昆虫肠道的微生物,一方面依赖昆虫肠道提供能量,另一方面又参与了昆虫的生命活动[13-14]。
研究表明,大多数昆虫肠道微生物包括了细菌、真菌和古细菌,而细菌是其中的优势菌群[15]。鳞翅目作为昆虫中的第二大目,分布范围极为广泛,其数量约占昆虫总量的16%,大多以农林业害虫为主,也包括少数具有传粉能力和经济效益的昆虫[16]。鳞翅目昆虫食性多样,肠道菌群会受到地域、气候差异以及食物所携带的微生物的影响,从而导致肠道微生物种类与数量的差异[17-18]。林晓丽以小菜蛾(Plutellaxylostella)为研究对象,采用传统纯培养法和DGGE电泳法研究其肠道微生物的多样性,发现幼虫肠道中分离到的细菌最多,且沙雷氏菌属(Serratia)和假单胞菌属(Pseudomonas)占优势地位[18]。
本实验以安宁地区采集回来健康的思茅松毛虫6龄幼虫为材料,采用纯培养技术、形态学和16S rDNA序列对6龄幼虫肠道细菌进行初步的分离鉴定,探索思茅松毛虫6龄幼虫肠道细菌资源及其多样性,为研究昆虫肠道微生物的功能及对于思茅松毛虫的防治提供参考。
1 材料与方法
1.1 实验材料
思茅松毛虫6龄幼虫样本(图1)采自云南省安宁市草铺镇的云南松(Pinusyunnanensis)林内(24°31′~25°6′ N,102°8′~102°37′ E,海拔1 913 m)。根据安宁市森林的情况,以安宁市权甫派出所为圆点,在方圆1 km2范围内随机挑选10个样品点,每个样品点采集7头健康的思茅松毛虫6龄幼虫,总计70头,并连同6龄幼虫所在的树枝带回实验室饲养,为后续实验做准备。

图1 思茅松毛虫6龄幼虫
1.2 分离培养基与试剂、仪器
牛肉膏蛋白胨培养基(NA)[19]:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂15~20 g,蒸馏水定容至1000 mL,pH 7.0~7.2,121 ℃灭菌20 min。
培养基及生理生化鉴定所用分析纯、化学纯试剂均购自西陇化工股份有限公司,Ezup 柱式细菌基因组DNA 抽提试剂盒购自天根生化科技(北京)有限公司,PCR扩增体系试剂购自硕擎生物科技有限公司。
1.3 肠道细菌的分离纯化
选取50头健康的思茅松毛虫6龄幼虫,在恒温22~24 ℃、恒湿80%~85%条件下,无菌水喂养幼虫,40 h后待其排空体内食物残渣后进行实验。将思茅松毛虫幼虫置于冰上3~5 min,待其昏迷;采用70 %酒精擦拭虫体表面30 s,0.25%次氯酸钠冲泡1 min,无菌水冲洗3次;将体表消毒好的虫子固定于无菌蜡盘上,在无菌环境下操作,使用灭菌后的细尖钳将昆虫腹部剖开,取出整个肠道,并立即用0.9%无菌NaCl溶液冲洗表面2次,然后将肠道取出后置于无菌离心管中,向离心管中加入1 mL PBS缓冲液研磨成匀浆,备用。
将上述肠道匀浆吸取1 mL置于9 mL PBS缓冲液中,稀释成10-1,按照10的倍数梯度稀释,制成10-2、10-3、10-4、10-5的稀释液,吸取每个浓度稀释液100 μL分别涂布于NA培养基中,每个梯度涂3个平板,作为实验组。取最后一次清洗的无菌水100 μL涂布于NA培养基上,作为空白对照。涂板均匀后将培养平板倒置于37 ℃培养箱中,培养3 d后观察空白对照是否有菌落形成,若无菌落长出,则选择单菌落数在30~300株的培养皿,根据涂有肠道内容物悬液培养皿上的单菌落的不同特征,挑取单菌落至新的NA培养基平板上,采用分区划线法进行纯化,直至菌株形态基本一致,得到纯菌株。将得到的菌种保藏于NA斜面培养基中,4 ℃保存备用。
1.4 6龄幼虫肠道可培养菌株的形态观察
将经分离纯化得到的纯菌株用平板划线法接种于新的NA平板上,在37 ℃下培养24~48 h,待菌落长成后,参考黄秀梨等[20]的方法对菌落进行染色,并在显微镜下观察菌株的形态,依据东秀珠等[21]的方法对其特征进行描述鉴定。
1.5 6龄幼虫肠道可培养菌株的生理生化鉴定
按照朱旭芬[22]、周德庆等[23]微生物生理生化鉴定的方法,对6龄幼虫肠道细菌进行生理生化鉴定。
1.6 6龄幼虫肠道细菌16S rDNA分子鉴定
1.6.1 肠道细菌基因组DNA提取及PCR扩增
将1 mL过夜培养的细菌菌液按照Ezup 柱式细菌基因组DNA 抽提试剂盒提取6龄幼虫肠道细菌基因组DNA。提取出的细菌基因组DNA用1.0%的琼脂糖凝胶检测,得到的片段符合细菌基因组DNA大小后,将检测合格的DNA产物作为16S rDNA序列扩增模板。扩增引物[24]选择:正向引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和反向引物1492R(5′-GGTTACCTTGTTACGACTT-3′)。PCR扩增体系为:25.0 μL的2× Tap PCR MasterMix;3.0 μL的模板DNA;10.0 μmol/L 正向引物27F和反向引物1492R各1.0 μL;双蒸水补充至50.0 μL。PCR扩增程序为:94 ℃预变性5 min;94 ℃变性1 min,56 ℃退火1 min,72 ℃延伸3 min,30 个循环;72 ℃终延伸5 min,-20 ℃保存。取4.0 μL PCR扩增后的产物用1%琼脂糖凝胶进行电泳检测,将检测合格的PCR扩增产物送生工生物工程(上海)股份有限公司测序。
1.6.2 6龄幼虫肠道细菌系统发育树构建
测得的序列通过DNA MAN6.0软件进行矫正及拼接,拼接完成后的16S rDNA序列在http://www.ncbi.nlm.nih.gov/中与GenBank数据库中的序列进行BLAST同源性比对,选出与菌株相似度最高的序列,运用软件MEGA 7.0构建Neighbor-Joining系统发育树,判定其分类学关系。
1.7 分离率与群落结构多样性分析
(1)分离率与相对分离率,分别衡量6龄幼虫肠道细菌丰富度和某种6龄幼虫肠道细菌的优势度。分离率[25]指从样品中分离得到的菌株数与全部样本虫数的比值;相对分离率指分离到的某种6龄幼虫肠道细菌株数占分离到的总菌株数的百分率。
(2)群落结构多样性分析
多样性指数[26]的计算公式如下:
①
②
Margalef丰富度指数Ma=(S-1)/lnN
③
式中,S表示某个6龄幼虫肠道细菌的种类数,N表示某个6龄幼虫肠道细菌的总量,Pi表示某种6龄幼虫肠道细菌的相对分离率。
2 结果与分析
2.1 幼虫肠道细菌的种类及数量
从50头6龄思茅松毛虫的幼虫肠道中共分离得到104株细菌,分离率达208.00%。根据菌落的形态特征共有14个类群,整理编号得:N601~N614。
2.2 幼虫肠道细菌的形态特征
对分离得到的14株细菌的菌落特征(图2)与革兰氏染色结果(图3)进行观察,结果见表1。14株菌株中多数菌株的革兰氏染色结果呈阳性,仅有4株呈阴性。且大部分菌株为杆状,仅有N608、N613为球状;大部分菌株边缘整齐,只有N601、N610、N612的边缘呈锯齿状;N606和N607在固体培养基上半透明,其他菌株的菌丝体都是不透明的。

表1 6龄幼虫肠道细菌的菌落形态特征

图2 6龄幼虫部分肠道细菌菌落形态特征注:a为N602,b为N605,c为N607,d为N608,e为N610,f为N611。Fig.2 Colonymorphologyobservationofsomeintestinalbacteriain6thinstarlarvae图3 幼虫部分肠道细菌的显微形态(100×)注:a为N602,b为N607,c为N605,d为N610,e为N608,f为N611。Fig.3 Micromorphologyofsomeintestinalbacteriainlarvae(100×)
2.3 幼虫肠道细菌生理生化鉴定及多样性分析
幼虫肠道细菌生理生化鉴定及多样性分析见表2。

表2 6龄幼虫肠道可培养细菌的生理生化特征
经过对生理生化指标的聚类分析可知,在欧式距离4左右处,可将14个细菌类群划分为2个遗传聚类组,N613自成一类,其他13个细菌类群为一类,其中N614、N610、N609、N606、N611、N604属于一类,N608、N607、N612、N603、N602、N605、N601属于一类,见图4。

图4 菌株生理生化聚类
结合生理生化指标(表2、图4)、细菌的形态特征(图2)、菌落(图3)及显微形态特征(表1),查询细菌鉴定手册后,将分离到的14种细菌形态,初步鉴定为:N601、N602、N603、N607和N612均属于芽孢杆菌属(Bacillussp.),N604为类芽孢杆菌属(Paenibacillussp.),N605为苍白杆菌属(Ochrobactrumsp.),N606为短芽孢杆菌属(Brevibacillussp.),N608为微球菌属(Micrococcussp.),N609为莫拉菌属(Moraxellasp.),N610为栖水菌属(Enhydrobactersp.),N611为土壤芽孢杆菌属(Solibacillusp.),N613为葡萄球菌属(Staphylococcussp.),N614为普罗威登斯菌属(Providenciasp.)。部分菌株因为菌种形态过于相似,需进一步进行后续分子生物学鉴定。
从思茅松毛虫6龄幼虫肠道细菌的相对分离比率(表1)可以看出,104株6龄幼虫肠道细菌中,芽孢杆菌属(Bacillussp.)(N601、N602、N603、N607和N612)相对分离率为53.00%,是思茅松毛虫6龄幼虫肠道中细菌的优势菌群。另外,思茅松毛虫6龄幼虫肠道细菌的Shannon多样性指数、Simpson优势度指数、Margalef丰富度指数分别为2.521 7、0.912 9、2.799 1,说明思茅松毛虫6龄幼虫肠道中的细菌具有丰富的多样性。
2.4 6龄幼虫肠道可培养细菌16S rDNA PCR扩增结果
分离纯化的思茅松毛虫6龄幼虫肠道细菌的基因组DNA,检测合格后,通过1.0%琼脂糖凝胶电泳检测,其PCR扩增条带均在1 500 bp左右,条带清晰(图5)。

图5 思茅松毛虫幼虫肠道中可培养细菌16S rDNA PCR的电泳条带
2.5 幼虫肠道中可培养细菌16S rDNA序列
将所获14种细菌形态6龄幼虫肠道细菌16S rDNA序列在GenBank中注册,获得GenBank登录号(表3),分离到的6龄幼虫肠道细菌与相应菌株的16S rDNA序列相似度在97%-100%之间。从表3看,这104株细菌隶属于10个属,14个类群,初步鉴定为:N601为枯草芽孢杆菌(Bacillussubtilis),N602为空气芽孢杆菌(Bacillusaerius),N603为高地芽孢杆菌(Bacillusaltitudinis),N604为帕萨迪娜类芽孢杆菌(Paenibacilluspasadenensis),N605为人苍白杆菌(Ochrobactrumanthropi),N606为土壤短芽孢杆菌(Brevibacillusagri),N607为甲基营养芽孢杆菌(Bacillusmethylotrophicus),N608为藤黄微球菌(Micrococcusluteus),N609为奥斯陆莫拉菌(Moraxellaosloensis),N610为栖水菌属(Enhydrobactersp.),N611为森林土壤芽孢杆菌(Solibacillussilvestris),N612为短小芽孢杆菌(Bacilluspumilus),N613为头状葡萄球菌(Staphylococcuscapitis),N614为雷氏普罗威登斯菌(Providenciarettgeri)。这些思茅松毛虫6龄幼虫肠道细菌均不能够确定其真正的种属地位,还需要做进一步的实验以鉴定其分类学地位。

表3 思茅松毛虫幼虫肠道中细菌GenBank登录号及最大相似菌株
2.6 系统发育树
将6龄幼虫肠道细菌的16S rDNA序列进行系统发育进化分析,构建系统发育树(图6)。思茅松毛虫6龄幼虫肠道可培养细菌归属于3个大类,第一大类为厚壁菌门(Firmicutes),分别为:芽孢杆菌属、葡萄球菌属、短芽孢杆菌属、类芽孢杆菌属、土壤芽孢杆菌属;第二大类为放线菌门(Actinobacteria),为微球菌属;第三大类为变形菌门(Proteobacteria),分别为:苍白杆菌属、莫拉菌属、栖水菌属、普罗威登斯菌属。
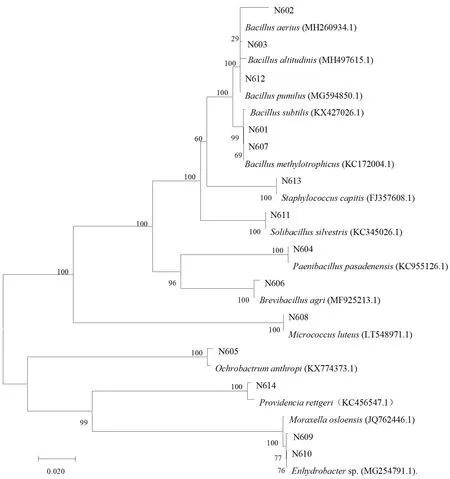
图6 基于16S rDNA序列构建6龄幼虫肠道细菌的系统发育树(邻接法)
3 讨论与结论
思茅松毛虫严重危害云南松等松科(Pinaceae)植物,对林业造成巨大的损失,对人畜造成伤害,对生态环境和人类生活造成了巨大的影响。本研究以6龄思茅松毛虫幼虫为材料,通过对其肠道可培养细菌进行一系列的菌落观察、生理生化实验和16S rDNA同源性分析,共分离得到104 株肠道可培养细菌,初步推测隶属于10个属,14个类群。通过对肠道细菌的相对分离率进行分析,芽孢杆菌属的相对分离率最高为53.00%,是6龄思茅松毛虫幼虫肠道细菌的优势菌属。通过对其多样性进一步分析,得到思茅松毛虫肠道可培养细菌具有丰富的多样性。
昆虫肠道是昆虫重要的发育部分,承担起昆虫生长发育等重要活动[12]。而寄居在昆虫肠道中的微生物对昆虫肠道提供营养,参与了昆虫的生长代谢;通过增强昆虫的免疫和提高定殖抗力,保护昆虫不受外界侵害[14]。另一方面,昆虫为微生物提供了一个生存环境,当寄居在肠道中的某种微生物的数量发生变化后,宿主内的肠道微生态环境也会发生改变,从而导致宿主健康受到影响[13],二者是相互联系的,这为研究微生物杀虫剂奠定了基础。
课题组前期已对采自普洱市宁洱县磨黑镇健康的思茅松毛虫6龄幼虫做了关于肠道细菌的研究[27],研究表明,采自宁洱县的6龄幼虫肠道细菌共分离得到6种细菌,隶属于芽孢杆菌属(Bacillussp.)、克雷伯氏杆菌属(Klebsiellasp.)2个属,而采自安宁地区的6龄幼虫分离到104株肠道细菌,隶属于10个属,14个类群。2个地点采集的6龄幼虫都分离到了芽孢杆菌,这说明其可能是思茅松毛虫6龄幼虫的肠道优势菌属,说明不同地区的思茅松毛虫具有相同的优势菌种,但也有不同的菌种。
细菌最适生长pH在6~7之间,但鳞翅目幼虫中肠pH却高达11~12[27],极端碱性条件不利于绝大多数细菌的生长[29],肠球菌(Enterococcussp.)却能在此生长,说明肠球菌可能以某种方式降低了pH,能缓冲肠道极端pH[30],以适合肠道中大部分的肠道细菌生存。本研究通过对6龄幼虫的肠道细菌分离得到了14个类群的细菌(包含球菌),这为防治思茅松毛虫提供了依据。
近年来,随着分子生物学技术的发展,可以通过宏基因学技术[31-32]不依赖纯培养直接对肠道细菌的总DNA进行提取,进而分析出整个肠道的细菌种类,为研究昆虫的肠道微生物资源库提供全面的研究基础。因此,通过纯培养技术分离得到的6龄幼虫肠道细菌只是其中很少的一部分,需要结合宏基因组技术,才能得到较为全面的细菌类群。
思茅松毛虫是林业重要的害虫,对其肠道微生物的研究,不仅可以补充昆虫肠道微生物资源库,还可以据此进一步分析肠道细菌对昆虫生长发育的影响,最终得到防治思茅松毛虫的生物制剂,从而减少林业害虫的危害。

