丝棉木组培脱菌技术的研究*
许丁帆,刘艳军,焦思鹏,黄俊轩,武春霞,李建科
(天津农学院园艺园林学院,天津 300384)
丝绵木(EuonymusmaackiiRupr.)属卫矛科(Celastraceae)卫矛属(Euonymus)植物,落叶灌木或小乔木,适应性强分布范围广,耐贫瘠、耐盐碱、抗恶劣环境,空气净化能力强,具有较高的观赏价值和药用价值[1-2]。丝棉木木材特性佳、实用性强,是中国西北地区园林绿化的主要树种,秋季橙红色的叶片和粉红色的蒴果均有很高的观赏价值,极具发展潜力[3]。目前,丝棉木种苗主要以播种、扦插和嫁接等常规手段进行繁殖[4-6]。虽然操作简便,技术难度低,但播种繁殖不能较好地保存亲本的优良性状,且周期长;扦插繁殖植株根系较实生苗浅、弱;嫁接方式繁殖易受季节限制。此外,扦插与嫁接时,伤口易受微生物侵染,致使苗木微生物病菌逐渐积累,导致苗木生长缓慢甚至死亡。利用植物组织培养进行丝棉木快速繁殖[7-9],虽然一定程度缓解了种苗的数量问题,但由于丝棉木组培苗长期继代培养,内生菌会随着继代培养次数增加而逐代积累,导致组培苗质量下降,组培苗污染等现象时有发生,阻碍丝棉木优质种苗生产。
关于丝棉木组培脱菌的研究未见报道,利用植物组培脱菌技术,并结合组培快繁技术,在短时间内获得大量优质脱菌组培苗,以增强组培苗的抗逆性,满足生产上对丝棉木优质种苗的需求,同时也可以大量减少农药的使用,对环境保护具有重要意义。因此,本试验采用丝棉木茎段为外植体,利用制霉菌素、硫酸链霉素和羧苄青霉素钠3种抗生素进行丝棉木脱菌处理,寻找丝棉木外植体组培脱菌的最佳途径,获得丝棉木脱菌组培苗,建立丝棉木组培脱菌体系,为生产优质丝棉木种苗提供技术支撑。
1 材料和方法
1.1 试验材料
试验所用丝棉木1 a生休眠枝条取自天津农学院实验楼西南侧成龄的丝棉木植株;制霉菌素(nystatin;USP,≥4 400 units/mg)和羧苄青霉素钠(carbenicillin disodium salt;USP)购于上海麦克林生化科技有限公司;硫酸链霉素(streptomycin sulfate;>95%)购于梯希爱(上海)化成工业发展有限公司。
1.2 试验方法
1.2.1 丝棉木组培苗的获得
将取回的丝棉木枝条置于自来水下冲洗30 min,在超净工作台中,将枝条剪成2~3 cm的小段,每段带1~2个腋芽。用70%乙醇处理30 s,然后置于30%(V/V)次氯酸钠溶液中处理10 min,无菌水冲洗3次,每次冲洗5 min,并用无菌滤纸吸干外植体表面水分,接种到1/2 MS+5.0 mg/L GA3固体培养基上进行培养。培养条件为温度(25±1)℃,光照强度2 000 Lx,24 h光照。期间不定时出现细菌或真菌污染,每天观察并剔除被污染的外植体。培养30 d后将生长正常的腋芽切下,转接至1/2 MS+0.25 mg/LNAA培养基上进行生根培养,获得大量组培苗备用。
1.2.2 丝棉木脱菌处理
取株高、长势一致的组培苗,剪取长度约1.0 cm的茎尖,分别接种到含有不同浓度与种类抗生素的1/2 MS培养基上进行脱菌培养,培养基分别单独添加不同浓度的制霉菌素(25、50、75、100 mg/L)、硫酸链霉素(25、50、75、100 mg/L)、羧苄青霉素钠(125、250、500、750 mg/L);不同抗生素组合(50 mg/L制霉菌素+50 mg/L硫酸链霉素、50 mg/L制霉菌素+250 mg/L羧苄青霉素钠、50 mg/L硫酸链霉素+250 mg/L羧苄青霉素钠、50 mg/L制霉菌素+50 mg/L硫酸链霉素+250 mg/L羧苄青霉素钠)。所有培养基均添加20 g/L蔗糖和7 g/L琼脂,高压灭菌前调节pH=5.8,分装在500 mL广口三角瓶中,培养基于121 ℃、0.1 MPa下灭菌20 min,灭菌后冷却备用。将凝固备用的培养基用微波炉加热融化,待其温度降至60~70 ℃时在超净台中加入所需抗生素。抗生素中制霉菌素为非水溶性,以二甲基亚砜为溶剂,配成50 mg/L的母液;硫酸链霉素与羧苄青霉素钠为水溶性,以蒸馏水为溶剂,分别配成50、250 mg/L母液。为防止抗生素高温分解,抗生素溶解后采用 0.22 μm的无菌微孔过滤器进行抽滤灭菌,灭菌后加入未凝固的培养基中。每个处理接种10瓶,每瓶接种3个外植体,每个处理重复5次。培养条件同1.2.1,每天观察不同处理对丝棉木茎尖外植体的生长情况,30 d后统计丝棉木茎尖的存活率、真菌污染率、细菌污染率和平均生长量。
1.2.3 丝棉木组培苗的增殖培养及脱菌效果检测
将长约1.0 cm的丝棉木茎尖在1/2 MS+50 mg/L制霉菌素+50 mg/L硫酸链霉素+250 mg/L羧苄青霉素钠培养基上进行脱菌培养,每20 d继代培养一次,每次继代培养时剪取外植体上端约1.0 cm的茎尖,分别继代培养1、2、3、4次。选取脱菌处理后成活且长势良好的丝棉木外植体,将其转移到1/2 MS+1.0 mg/LBA+0.5 mg/LNAA的增殖培养基上进行培养,以长势一致的未经脱菌处理组培苗为对照,20 d后统计外植体的增殖系数、真菌污染率、细菌污染率及增殖芽生长势情况。处理重复3次,每个处理接种10瓶,每瓶接种3个外植体,培养条件同上。
1.3 数据处理与分析
成活率=(成活外植体数/接种外植体数)×100%;
真菌污染率=(真菌污染外植体数/接种外植体数)×100%;
细菌污染率=(细菌污染外植体数/接种外植体数)×100%;
平均生长量=∑(脱菌处理30 d后茎尖外植体高-处理前茎尖外植体高)/存活外植体数;
增殖系数=(增殖后总芽数/接种外植体数)×100%。
试验数据均采用Excel 2013和SPSS Statistic 17.0进行数据分析,邓肯氏新复极差法进行差异比较。
2 结果与分析
2.1 制霉菌素对丝棉木茎尖外植体抑菌效果的影响
由表1可知,在未添加制霉菌素的培养基中,丝棉木茎尖外植体出现不同程度的真菌与细菌污染;但随着培养基中制霉菌素浓度的增大,丝棉木茎尖外植体真菌污染率显著降低,细菌污染率无显著变化,说明制霉菌素能够有效抑制丝棉木外植体真菌污染,但对细菌污染无明显作用。丝棉木茎尖外植体成活率、平均生长量随制霉菌素浓度的增加而降低;当培养基中制霉菌素浓度≥50 mg/L时,丝棉木外植体成活率与平均生长量均显著降低且外植体基部出现褐化现象,叶片黄化,说明制霉菌素对丝棉木具有一定的毒害作用,浓度越高,毒害作用越明显。当培养基中制霉菌素浓度为50 mg/L时,丝棉木茎尖外植体真菌污染率较CK显著降低,真菌污染率由CK的14.00%降至1.33%,此时对丝棉木茎尖外植体成活率无显著影响,茎尖可以生长正常。因此,在培养基中添加50 mg/L制霉菌素可有效抑制丝棉木茎尖外植体真菌污染。
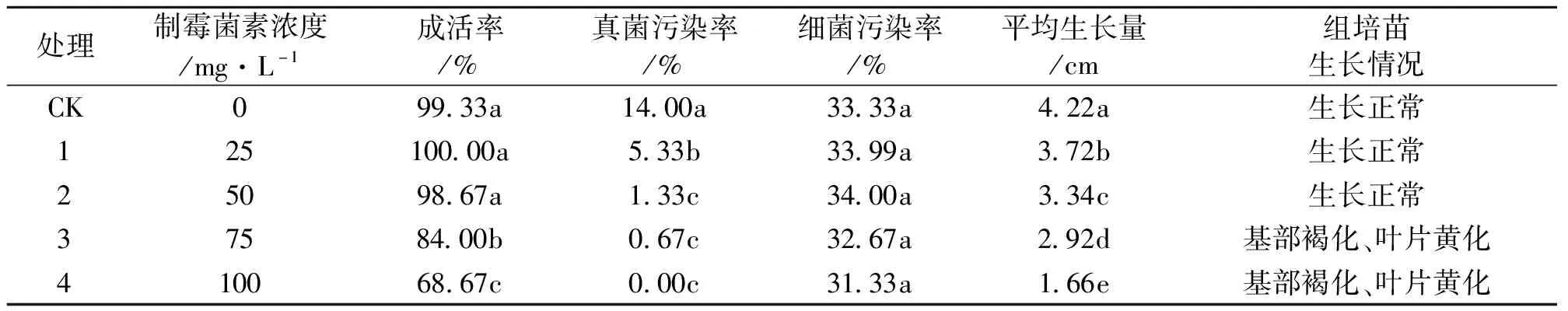
表1 不同浓度制霉菌素对丝棉木茎尖外植体的影响
2.2 硫酸链霉素对丝棉木茎尖外植体抑菌效果的影响
从表2可以看出,与对照相比,在培养基中添加不同浓度的硫酸链霉素,丝棉木茎尖外植体真菌污染率无显著变化,说明硫酸链霉素对抑制丝棉木茎尖外植体真菌污染无明显作用。随着培养基中硫酸链霉素浓度的增大,丝棉木外植体细菌染菌率随之降低,但当培养基中硫酸链霉素浓度≥50 mg/L,细菌污染率不再显著下降,增加硫酸链霉素浓度后丝棉木茎尖不能正常生长,新叶白化,基部出现不同程度的褐化现象。同时,从茎尖外植体的平均生长量看,平均生长量随着培养基中硫酸链霉素浓度的升高而降低,说明硫酸链霉素在一定程度上抑制丝棉木茎尖生长,采用增加硫酸链霉素浓度来提高其抑制细菌的效果的方法不可行。因此,单独使用硫酸链霉素虽能在一定程度上降低茎尖外植体的细菌污染率,但不能完全抑制茎尖外植体的细菌污染。
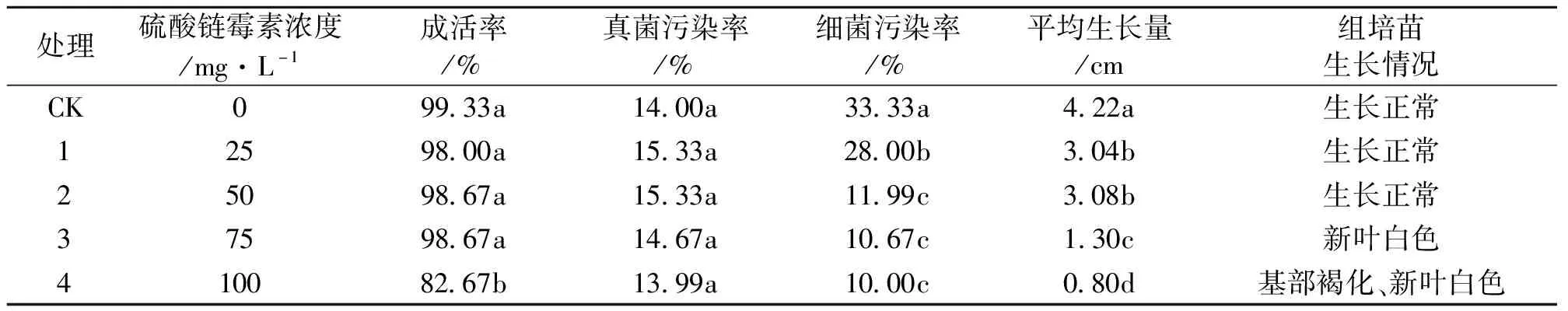
表2 不同浓度硫酸链霉素对丝棉木茎尖外植体的影响
2.3 羧苄青霉素钠对丝棉木茎尖外植体抑菌效果的影响
由表3可知,在培养基中添加不同浓度的羧苄青霉素钠对丝棉木茎尖存活率无显著影响,在含不同浓度羧苄青霉素钠的培养基上丝棉木茎尖均能够正常生长,但丝棉木茎尖生长量受到影响,丝棉木的平均生长量随着培养基中羧苄青霉素钠浓度的升高而显著降低。与CK相比,在培养基中添加不同浓度的羧苄青霉素钠丝棉木茎尖的真菌污染率并没有显著降低,说明羧苄青霉素钠对真菌污染没有抑制作用;在一定浓度范围内,丝棉木茎尖的细菌污染率随羧苄青霉素钠浓度的升高而降低,但当培养基中羧苄青霉素钠浓度≥250 mg/L,细菌污染率无显著变化,此时培养基中均为同种白色细菌污染,分析原因可能是羧苄青霉素钠对该种细菌无明显抑制作用。

表3 不同浓度羧苄青霉素钠对丝棉木茎尖外植体的影响
2.4 抗生素组合处理对丝棉木茎尖外植体抑菌效果的影响
由于单独使用一种抗生素抑菌效果不佳,试验在3种不同抗生素最适浓度的基础上,以3种抗生素的不同组合对丝棉木茎尖外植体进行抑菌处理。由表4知,丝棉木茎尖在所有含不同抗生素组合处理的培养基中,均能正常生长,但平均生长量较3个对照明显减小。从内生菌污染情况看,当培养基中加入50 mg/L制霉菌素与50 mg/L硫酸链霉素或250 mg/L羧苄青霉素钠时,均能有效抑制丝棉木真菌污染,而细菌污染率与对照相比,未发生明显变化;当培养基中50 mg/L硫酸链霉素与250 mg/L羧苄青霉素钠配合使用时,对抑制丝棉木细菌污染效果显著,但对真菌污染无显著抑制作用。当培养基中加入制霉菌素、硫酸链霉素和羧苄青霉素钠3种抗生素时,虽然丝棉木茎尖外植体成活率低于其他处理,但能够有效地抑制丝棉木组培苗真菌与细菌污染。因此,在1/2 MS+50 mg/L制霉菌素+50 mg/L硫酸链霉素+250 mg/L羧苄青霉素钠培养基上进行丝棉木组培苗脱菌处理效果较佳。

表4 不同抗生素组合处理对丝棉茎尖外植体的影响
2.5 继代培养次数对丝棉木脱菌效果的影响
将在1/2 MS+50 mg/L制霉菌素+50 mg/L硫酸链霉素+250 mg/L羧苄青霉素钠培养基上继代培养不同次数的丝棉木茎尖,分别接种到不含抗生素的丝棉木增殖培养基上,20 d后丝棉木增殖培养结果差异显著。增殖培养结果显示(表5),随着脱菌处理继代培养次数的增加,丝棉木真菌与细菌污染率逐渐降低,增殖系数不断提高,增殖芽生长势逐渐增强,说明丝棉木脱菌效果随着继代培养次数的增加而不断增强,同时与增殖系数呈现一定的正相关性,在短时间内丝棉木外植体很难脱除内生菌的影响,内生菌需要随着继代培养次数的增加逐渐脱除。在含50 mg/L制霉菌素、50 mg/L硫酸链霉素和250 mg/L羧苄青霉素钠的培养基上继代培养3~4次以后,丝棉木增殖系数显著提高,增殖芽生长势强,均明显优于其它处理,且增殖培养时基本无内生真菌与细菌污染出现,处理4的细菌污染为人工接种导致的外源污染。

表5 不同继代培养次数对丝棉木增殖培养的影响
3 结论与讨论
在植物组织培养过程中,污染主要可分为内源污染和外源污染两大类。初次接种的外植体在2~3 d内就能在外植体周围或培养基表面长菌,属于外源污染,主要由外植体表面携带或操作不当等原因造成;内源污染主要指由外植体本身所携带的内生菌造成的污染,内生菌一般较难采用表面消毒方法清除,一般在接种一段时间后才出现菌落[10]。外源污染只要选择适合的外植体消毒方法、操作严格要求,环境条件严格控制,一般可控制在理想范围内;而内源性污染,因其具有隐蔽性,是最难控制的污染源[11-12]。随着对抗生素作用机理的不断深入研究, 抗生素越来越广泛的应用于组培脱菌研究中, 而且控制抗生素使用浓度在一定范围内不对外植体造成伤害[13]。同时,生产上可以选用兽用抗生素来降低生产成本,且获取容易[14]。
本试验中50 mg/L硫酸链霉素+250 mg/L羧苄青霉素钠混合使用的抑菌效果明显优于单独使用一种抗生素,能够有效抑制丝棉木组培苗细菌污染。这与简兴[15]在抑制红掌(Anthuriumandraeanum)细菌污染中发现使用300 mg/L的青霉素+180 mg/L链霉素,效果好于1 000 mg/L链霉素单独使用的结果基本一致。究其原因,是因为青霉素与链霉素合用具有一定的增强与协同作用,对多数细菌起到抑制作用。因此,在使用不同抗生素种类时,还需考虑抗生素之间的协同或拮抗作用。黄俊轩等[16]在利用抗生素进行北美海棠(North American Crabapple)组培苗脱菌培养时,仅用抗生素的标准抗菌浓度进行试验,未采用不同抗生素浓度处理,不能准确获得不同抗生素对北美海棠的最佳抑菌浓度。本试验具体研究了3种抗生素不同浓度对丝棉木组培苗抑菌效果及生长的影响,可准确获得制霉菌素、硫酸链霉素与羧苄青霉素钠对丝棉木的最佳使用浓度,分别为50、50、250 mg/L。并在试验中发现高浓度的制霉菌素与硫酸链霉素均对丝棉木组培苗产生不利影响,这与田永亮等[17]抗生素在较高的浓度下会对植物的生长产生不利的影响,过高浓度的抗生素同样会杀死植物的结论一致。但本试验中较高浓度的羧苄青霉素钠未对丝棉木组培苗生长产生明显抑制作用, 这可能与植物的种类不同有关,不同植物对不同抗生素种类的忍耐程度不同。
丝棉木脱菌具体步骤总结如下:以丝棉木带1~2个腋芽的茎段为外植体,经外植体消毒后,获得表面无污染的组培苗;剪取组培苗上端长约1.0 cm茎尖,接种至1/2 MS+50 mg/L制霉菌素+50 mg/L硫酸链霉素+250 mg/L羧苄青霉素钠培养基上,每隔20 d继代培养一次,3~4次继代培养后,将其转移至1/2 MS+0.25 mg/L NAA上进行生根壮苗培养,即可获得优质的丝棉木脱菌组培苗。本结果可直接应用于丝棉木组培快繁研究中,为丝棉木优质种苗生产奠定基础。

