围手术期应用血小板对阿司匹林相关性脑出血患者手术治疗的疗效研究
孟 舒,万 超,夏海龙
[1.重庆市红十字会医院(江北区人民医院)复盛院区,重庆 400020;2.重庆市红十字会医院(江北区人民医院)病案科,重庆 400020;3.重庆市红十字会医院(江北区人民医院)神经外科,重庆 400020]
随着社会老龄化加剧,缺血性脑卒中患者日益增多。为了预防或控制缺血性脑卒中的发生和发展,越来越多患者应用血小板抑制剂类药物,其中以阿司匹林的应用最为广泛[1]。研究表明,阿司匹林是自发性脑出血转归不良和致死率增加的独立预测指标[2-3],并可增加手术后再出血率[4-7]。临床医生甚至认为,术前口服阿司匹林是自发性脑出血患者手术治疗的相对禁忌证,而此类患者多起病急、病情重、病情进展快,延期手术可能耽误患者治疗,影响预后。因此,对阿司匹林相关性脑出血(OAT-ICH)患者制定个体化治疗方案实属必要。本研究对自发性脑出血患者进行回顾性分析,通过完善术前血栓弹力图(TEG)检查,了解患者血小板功能,并指导围手术期血小板的使用,配合相应的手术方式,取得了不错疗效,现报道如下。
1 资料与方法
1.1一般资料 选取重庆市红十字会医院神经外科2017年1月至2019年12月行手术治疗的自发性脑出血患者138例作为研究对象,有长期口服阿司匹林史的23例纳入观察组,其根据TEG决定在围手术期是否应用血小板。无口服阿司匹林史的115例纳入对照组。观察组中,男15例,女8例;年龄39~80岁,平均(56.6±10.3)岁;术前均行TEG检查,花生四烯酸(AA)抑制率大于75%的患者9例,AA抑制率为50%~75%的患者11例,AA抑制率小于50%的患者3例;患者服用阿司匹林的时间为6~60个月,平均(24.0±6.9)个月;服用剂量为50~100 mg/d,平均(72.2±20.7)mg/d。对照组中,男87例,女28例;年龄35~83岁,平均(59.3±11.8)岁。2组一般资料比较,差异均无统计学意义(P>0.05),见表1。纳入标准:(1)均为自发性脑出血患者;(2)经头颅计算机断层扫描(CT)证实为脑内出血;(3)所有患者均行急诊手术治疗;(4)发病前口服阿司匹林的患者均术前完善TEG检查。排除标准:(1)因颅内血管畸形、动脉瘤等其他血管性疾病所致出血。(2)合并有凝血功能障碍或血液性疾病;(3)联合使用其他抗血栓药物,如氯吡格雷、华法林等。
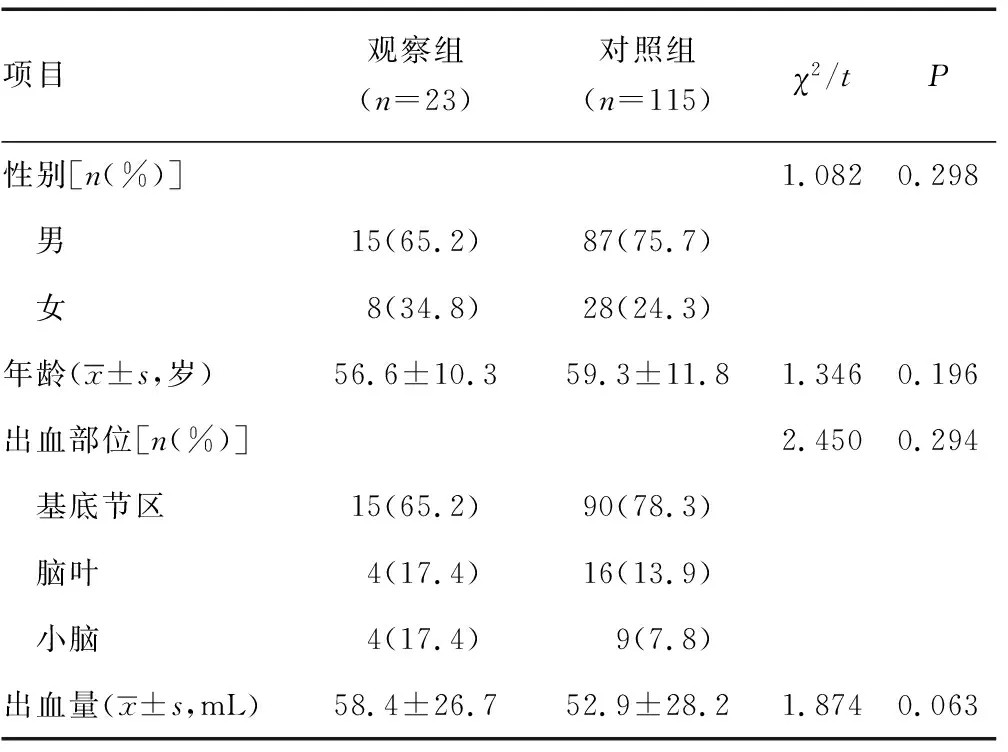
表1 2患者术前一般资料比较
1.2方法
1.2.1影像学资料 术前所有患者均行头颅CT检查,并采用公式计算出血量:血肿量=π/6×血肿层数×血肿最大层面长(mm)×宽(mm)。观察组中,19例为幕上基底节区或脑叶出血,其中9例出血量大于60 mL,剩余10例的出血量为30~60 mL;4例为小脑出血,出血量均大于12 mL。对照组中,106例为幕上基底节区或脑叶出血,其中48例的出血量大于60 mL,剩余58例出血量为30~60 mL。9例为小脑出血,出血量均大于12 mL。
1.2.2治疗方法 综合分析所有患者出血量、出血部位、意识水平、格拉斯哥昏迷指数(GCS)评分和脑疝情况等,选用钻孔引流术、小骨窗开颅血肿清除术和开颅血肿清除+去骨瓣减压术。观察组患者根据TEG结果,决定在围手术期是否应用血小板。观察组23例患者,其中AA抑制率大于75%的患者9例,6例行血肿钻孔引流术,3例行开颅血肿清除+去骨瓣减压术,所有患者均给予术前输入1个治疗量新鲜或冰冻血小板,术后第1天再次输入1个治疗量的新鲜或冰冻血小板;AA抑制率为50%~75%的患者11例,6例行钻孔引流术,2例行小骨窗开颅血肿清除术,3例行去大骨瓣减压术,围手术期未给予血小板输注;AA抑制率小于50%的患者3例,1例行血肿钻孔引流术,2例行小骨窗开颅血肿清除术,围手术期未给予血小板输注。对照组115例患者,45例行钻孔引流术,36例行小骨窗开颅血肿清除术,34例行开颅血肿清除+去骨瓣减压术。
1.2.3观察指标 (1)2组患者术后再出血发生率;(2)2组患者术后3个月的致死率、日常生活能力(ADL)分级及预后良好率,以ADL分级Ⅰ~Ⅲ级为预后良好。
2 结 果
2.12组患者术后再出血情况比较 观察组有3例(13.04%)患者出现术后再出血。其中术前AA抑制率大于75%的患者2例,各1例采用钻孔引流术和开颅血肿清除+去骨瓣减压术;另1例的AA抑制率为50%~75%,采用开颅血肿清除+去大骨瓣减压术。对照组有11例(9.57%)发生术后再出血,其中5例采用钻孔引流术,2例采用小骨窗血肿清除术,4例采用开颅血肿清除+去骨瓣减压术。2组患者术后再出血发生率比较,差异无统计学意义(χ2=0.254,P=0.614)。
2.22组患者术后3个月ADL分级及预后情况比较 术后3个月,观察组患者的致死率略高于对照组,预后良好率低于对照组,但2组间比较差异均无统计学意义(P>0.05),见表2。
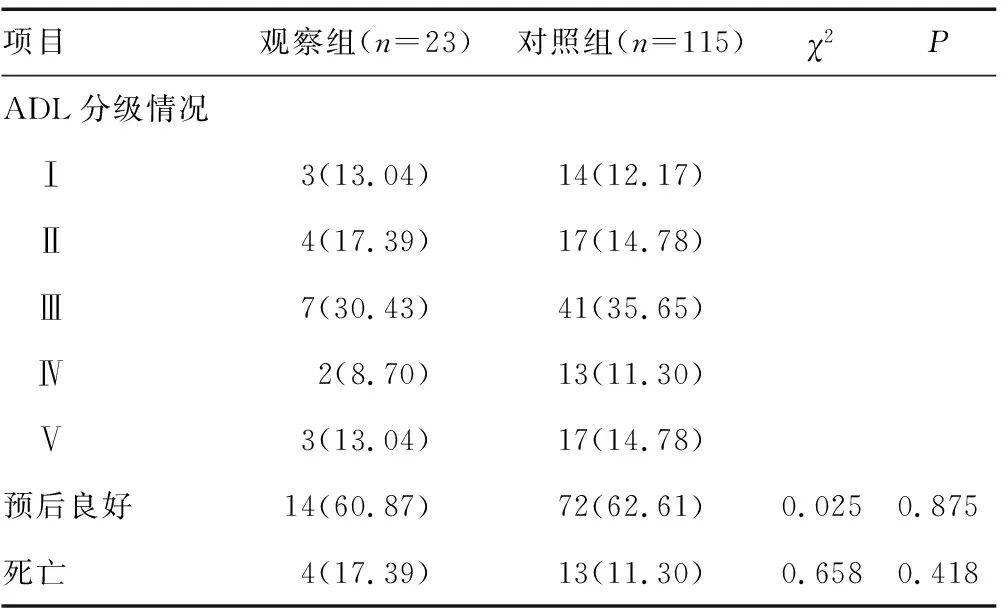
表2 2组患者术后3个月ADL分级及预后情况比较[n(%)]
3 讨 论
脑出血是临床常见的急重症,其致死率、致残率高。目前,阿司匹林已被证实有利于预防心肌梗死和缺血性卒中,但也会增加脑出血发病率[8]。有报道称,口服抗血小板药物引发颅内出血比其他类型的颅内出血年发生率增加6.7~11.0倍[9]。阿司匹林可影响人体凝血机制,患者一旦出现脑出血,其出血量会多于未服用阿司匹林者,术中不易止血,且术后再出血的风险高,预后差,致死率大于50%[9],治疗较为棘手[7,10]。本研究利用术前TEG检查指导OAT-ICH患者围手术期的血小板应用,并辅以相应的手术方式进行个体化治疗。将其与同时期内普通脑出血患者的临床资料进行对比,可见两者在术后再出血率、预后优良率、致死率无明显差异,取得不错的疗效。
OAT-ICH患者因阿司匹林对机体凝血功能产生影响,术中、术后出血的风险高[7,10],围手术期血小板输注被认为是有效的治疗措施,然而目前临床血源供应紧张,且并f非所有OAT-ICH患者均需要血小板输注,故临床需要一种有效方案监测OAT-ICH患者围手术期血小板应用情况。TEG以往多被用在心血管介入中心检测冠心病抗栓治疗,评估血小板活性和抗血小板药物的疗效,以及指导肝脏和心脏手术中输血。近年来,TEG已逐步更多地应用在脑血管介入治疗和颅脑创伤方面[2]。FRONTERA等[11]在抗血小板药物逆转相关指南中提出,接受手术治疗的脑出血患者在血小板输注前需进行血小板功能检测。TEG可以从血小板-纤维蛋白相互反应开始,记录血小板和纤维蛋白凝固级联反应,全面、准确地评估患者术前血小板凝血功能,从而指导OAT-ICH患者术前个体化血小板输注治疗[9,12]。通常以给予阿司匹林治疗后血小板AA抑制率大于75%定义为血小板充分抑制[2],也有报道证实AA抑制率大于75%可作为OAT-ICH患者手术后再出血高风险的预测指标[8]。而对于AA抑制率小于或等于75%的患者,其手术再出血的风险并未明显增加[2]。因此,本研究将术前AA抑制率大于75%作为OAT-ICH患者需输入血小板纠正凝血功能的指标,取得了不错的效果,也证实了其合理性和有效性。
输注血小板是长期口服阿司匹林的患者发生脑出血后逆转血小板功能、降低手术风险的有效措施[13]。2018年3月发布的《神经外科围手术期出血防治专家共识(2018)》中提出[14],口服阿司匹林患者需急诊手术时,可给予血小板输注支持治疗。FRONTERA等[11]也认为,术前输血可加速血小板的更新,从而减少术中出血量,降低术后再出血率。一项前瞻性研究证实,阿司匹林可降低血小板活性,早期输注血小板治疗能够增加血小板的活性,其与未口服阿司匹林效果一致[8]。血小板制剂主要有新鲜血小板和冰冻血小板,李晓卫等[15]比较了OAT-ICH患者围手术期输入新鲜血小板和冰冻血小板的临床疗效,证实两者对于纠正OAT-ICH患者凝血功能障碍、降低术后再出血风险都是有效的,且2组患者在术后再出血率、ADL评分及致死率方面无明显差异。但有报道称,冰冻血小板有不同程度的激活及膜损伤,形状及功能也受到影响[15],低温保护剂还可能导致肝损伤、溶血和致畸等不良反应,故推荐首选新鲜血小板。然而,目前全国血源紧张,且新鲜血小板的保存时间短,脑出血患者则多为急诊手术,临床很难保证新鲜血小板的及时供应。故在综合分析相关因素后,本研究首选新鲜血小板,在不能保证新鲜血小板的情况下,予以输入冰冻血小板纠正患者术前的凝血功能障碍,未见明显与冰冻血小板相关的并发症,但其安全性及不良反应仍需进一步验证。
阿司匹林可不同程度地影响患者的凝血功能,其在人体内的作用时间为24 h,人体通过新陈代谢每天产生的血小板数约占血液系统总量的10%,阿司匹林对于新产生或新输注的血小板不能发挥抑制作用[16]。人体内只需20%的血小板不被阿司匹林抑制,就足以维持正常的凝血过程[8],因此,输注20%的血小板制剂即可明显改善患者的凝血功能,且患者不受服用阿司匹林不良反应的影响[16]。而在第3天时,血小板已更新约20%,应用阿司匹林所致再出血的风险已缓解,故不必继续静脉输注血小板。观察组23例患者,根据术前TEG的治疗,选择性地在围手术期输入血小板治疗,取得了与普通脑出血相当的疗效,治疗效果满意,也证实了围手术期使用血小板能有效降低OAT-ICH患者术中、术后出血风险。
针对OAT-ICH患者的手术治疗,目前常采取手术方式有如下3种:钻孔引流术、小骨窗开颅血肿清除术及开颅血肿清除+去骨瓣减压术[17]。有学者认为,针对中等量出血量(幕上出血量30~60 mL)的OAT-ICH患者应尽量选择钻孔引流术,特别是AA抑制率大于或等于50%的患者[18-23]。钻孔引流术对正常脑组织的损伤小,能避免开颅去骨瓣减压术中对正常脑组织的损伤,降低术中、术后出血的风险,对脑组织的有效保护可使患者远期的恢复情况明显好转。如果术前TEG检查结果显示AA抑制率低于50%,则提示阿司匹林的低反应性[24],不会增加术后再出血风险,故手术方式的选择与普通脑出血无异。如术前已出现脑疝,则需急诊行开颅血肿清除+去大骨瓣减压术[25]。本研究23例OAT-ICH患者中,术前TEG检查提示AA抑制率大于或等于50%的患者共计20例,术前未发生脑疝且预计后期发生脑疝可能性较小的12例患者均采用了钻孔引流术,仅2例血肿量超过80 mL的高龄脑出血患者选择小骨窗开颅血肿清除术,其余6例因术前脑疝形成而行开颅血肿清除+去骨瓣减压术,均取得了不错的疗效。
综上所述,针对OAT-ICH患者,术前口服阿司匹林不应作为手术的禁忌证。合理利用TEG检查,能够比较客观地反映血小板的凝血状态。根据TEG指导,合理选择在围手术期输入血小板输注,再配合个体化手术方式,OAT-ICH患者可以取得较满意的临床疗效。

