HSP90抑制剂AUY922与氟康唑协同抗真菌活性研究
贾海瑞, 刘 珍, 韩 磊, 王苗苗, 刘 伟
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
0 引言
热休克蛋白(Heat Shock Proteins,HSP)是一类广泛存在于原核和真核生物胞内的高度保守蛋白,在细胞应激(病毒感染、缺氧、紫外线照射等)状态下大量合成,能有效阻止蛋白质发生错误折叠、稳定胞内蛋白构象并介导蛋白质到达目标细胞[1].HSP按分子量大小可分为:HSPH(HSP110)、HSPC(HSP90)、HSPA(HSP70)、DNAJ(HSP40)、小分子热休克蛋白HSPB家族(small HSP)和人类分子伴侣家族(HSP60和CCT)[2].其中HSP90占胞内溶质蛋白的1%~2%[3],在癌症、炎症、感染、神经、内分泌等诸多领域的研究正在逐步深入[4-7],逐渐成为相关研究领域的热门.
根据我国感染监测网的数据分析,医院真菌感染的发生率从20世纪90年代初的13.9%上升到90年代末的24.4%[8],即使临床上应用现行的治疗指南,系统性真菌感染导致患者的致死率仍超过50%[9].而多数医院真菌感染由念珠菌引起,其中占比最高的为白念珠菌,其次为光滑念珠菌、近平滑念珠菌、热带念珠菌和克柔念珠菌[10].白色念珠菌作为占临床分离酵母类微生物80%~90%[11]的致病真菌,引起的血液感染死亡率高达40%.但真菌感染缺少特异性的临床表现,常因贻误治疗而失去最佳治疗时机[12].而唑类药物如氟康唑(Fluconazole,FCZ)、伊曲康唑、伏立康唑等作为临床应用最广泛的抗真菌药物,却因大量使用导致例如白念珠菌等致病真菌耐药性的加重.综上真菌感染的治疗研究迫在眉睫.因此FCZ与耐药增敏剂(如钙依赖磷酸酶抑制剂、热休克蛋白抑制剂等)联用以增强对耐药真菌疗效,已成为相关领域研究热点[9].现有研究发现真菌依靠应激反应以对抗药物对细胞膜和细胞壁的损伤,并推测阻断细胞应激反应信号通路可以避免真菌耐药并显著增加抗真菌药物疗效[13].作为细胞应激反应的一个关键点,HSP90功能的实现受到上游通路多种分子调节,例如通过ATP的结合和水解,分子伴侣以及磷酸化、乙酰化等表达后修饰而实现相关调节[14,15],相关研究前景广远.因此将HSP90作为药物靶点的研究方向逐渐成为相应抗真菌药物研发的重心.
为推进抗真菌药物研发进展,通过文献调研发现AUY922(AUY)作为第二代HSP90抑制剂,可以竞争性结合于HSP90的ATP结合位点,从而抑制HSP90的生物学活性,导致细胞内很多关键蛋白不能被正常折叠从而失去生物学功能,且其作为肿瘤及癌症治疗药物已通过大量临床实验[16-20].故本实验选用HSP90抑制剂AUY为受试药物,采用不同实验对AUY进行全面的体外单用和联合FCZ抗真菌活性研究.本实验为抗真菌药物联合应用奠定基础,同时也为拓展现有抗真菌药物应用提供依据.
1 材料与方法
1.1 主要材料
1.1.1 实验菌种
耐药白念珠菌103、白念珠菌SC5314、光滑念珠菌、近平滑念珠菌、克柔念珠菌、热带念珠菌、新生隐球菌(上海市长海医院检验科).
1.1.2 实验药品试剂及培养基配制
HSP90抑制剂AUY(上海凯睿生物科技有限公司);FCZ(默克集团);二甲基亚砜、碳酸氢钠及氢氧化钠(天津市天力化学试剂有限公司);蛋白胨(北京奥博星生物技术有限责任公司);葡萄糖(天津市科密欧化学试剂有限公司);3-(N-吗啡啉)丙磺酸/MOPS(源叶生物).0.1 M磷酸盐缓冲液(PBS)(NaCl 8.0 g,KCl 0.4 g,Na2HPO40.133 g,KH2PO40.35 g,NaHCO30.35 g,加三蒸水至1 000 mL溶解,高压灭菌,4 ℃保存).
SDA平板(40 g葡萄糖、10 g蛋白胨加三蒸水至1 000 mL搅拌溶解,加18 g琼脂粉混匀,121 ℃高温灭菌20 min,倒平皿4 ℃储存);YPD培养液(酵母提取物10 g、蛋白胨20 g、葡萄糖20 g加三蒸水至1 000 mL,混匀分装,121 ℃高压灭菌20 min,4 ℃保存);RPMI 1640液体培养液(RPMI 1640 10 g、NaHCO32.0 g、MOPS 34.5 g加三蒸水溶解,用NaOH调pH至7.0,加水至1 000 mL,除菌,4 ℃保存).
1.1.3 实验设备
LDZX-75KBS型立式压力蒸汽灭菌锅(上海申安医疗器械厂);101-2AB型电热鼓风干燥箱(天津市泰斯特仪器有限公司);V0RTEX-5型涡旋仪(海门市其林贝尔仪器制造有限公司);SW-CJ-JFD型洁净工作台(苏州安泰空气技术有限公司);YP202N电子天平(上海天美天平仪器有限公司);BCD-160TMPQ海尔冰箱(青岛海尔股份有限公司);THZ-98C型恒温振荡箱及GP-9080型隔水式培养箱(上海一恒科学仪器有限公司).
1.2 实验方法
1.2.1 实验菌悬液制备
将实验各菌株接种至液体YPD培养基中培养过夜.离心收集菌体,PBS洗涤,加YPD培养基调整菌浓度至1.0×106cells/ml,混匀待用.
1.2.2 HSP90抑制剂AUY单用时抗真菌活性的初探究
取无菌96孔板,每排1号孔加等量RPMI 1640液体培养基作空白对照,12号孔不加药物作阳性对照.采用倍比稀释法[21]对2-11号孔进行倍比稀释,保证各孔的药物终浓度依次为64μg/mL、32μg/mL、16μg/mL、8μg/mL、4μg/mL、2μg/mL、1μg/mL、0.5μg/mL、0.25μg/mL、0.125μg/mL且孔中DMSO的含量均低于1%.35 ℃恒温培养,于24 h、48 h两个时间点进行观察记录,得对应最小抑菌浓度(minimal inhibit concentration,MIC).MIC值选用记录方法:当MIC值高于64μg/mL记为“>64μg/mL”;等于或低于最低浓度时均记为“≤0.125μg/mL”.上述实验均平行操作两次,当观察所得MIC值能准确重复或只差一个浓度时视为有效结果,并取较高浓度为最终确定值,否则重新实验直到数据符合要求.
1.2.3 AUY与FCZ联用抗真菌活性的探究
(1)棋盘式微量液基稀释法[22]
取无菌96孔板,每排1号孔加RPMI 1640液体培养基作空白对照,12号孔加入对应编号不含药剂的稀释菌液作阳性对照.对2-11号孔进行倍比稀释,使各孔的药物终浓度依次为64μg/mL、32μg/mL、16μg/mL、8μg/mL、4μg/mL、2μg/mL、1μg/mL、0.5μg/mL、0.25μg/mL、0.125μg/mL且孔中DMSO的含量均低于1%.35 ℃恒温培养,于24 h、48 h两个时间点进行观察记录对应MIC值.评价联合用药的两种药物相互作用方式的主要参数是部分抑菌浓度指数FICI,为每个药物联合抑菌时所需要最低抑菌浓度(MIC)和单用时MIC的比值之和.当FICI≤0.5时,相互作用是协同作用;0.5
(2)生长实验
取等量稀释菌悬液装入灭菌玻璃管,并依次编号1-8.1号管不加药物作为空白对照.2号管FCZ终浓度8μg/mL,3号管内AUY终浓度16μg/mL,4-8号管内FCZ+AUY终浓度依次为(8+1)μg/mL、(8+2)μg/mL、(8+4)μg/mL、(8+8)μg/mL、(8+16)μg/mL.35 ℃、200 rpm恒温振荡培养24 h拍照记录.
(3)时间-杀菌曲线实验
八组玻璃管依次编号1-8号.药品添加后35 ℃、200 rpm恒温振荡培养,于0、6 h、12 h、24 h、48 h五个时间点分别取样,用PBS稀释不同浓度,涂布于SDA平板,35 ℃恒温培养48 h后数克隆数并计算CFU数.
(4)琼脂纸片扩散实验
吸取500μL菌液平铺于SDA平板,静置3~4 h,挥干表面,放置6 mm纸片,添加相应药物,35 ℃恒温培养48 h后观察拍照.
(5)菌丝生长实验
挑取菌克隆于YPD中培养过夜.3 000 rpm,离心5 min,去上清.PBS洗3次.用RPMI 1640重悬,使菌终浓度为1×106cells/mL.取无菌6孔板各孔加等量菌悬液,第一排1号孔为空白组,2号孔FCZ终浓度8μg/mL,3号孔AUY终浓度16μg/mL,使4-6号孔FCZ+AUY终浓度依次为(8+2)μg/mL、(8+8)μg/mL、(8+16)μg/mL.35 ℃恒温培养,在0 h、1 h、2 h、3 h时显微拍照记录.
2 结果与讨论
2.1 HSP90抑制剂AUY单用时对真菌的作用
以AUY化合物为受试药物,FCZ为阳性对照药,7种真菌为受试菌株进行药敏试验,得到了AUY对七种真菌作用24 h、48 h的MIC值.由表1可知,AUY对热带念珠菌、敏感白念珠菌SC5314、耐药白念珠菌103及新生隐球菌的MIC值范围为16~64μg/mL,具有中等到弱的抑菌活性,对光滑念珠菌、克柔念珠菌、近平滑念珠菌未表现抑菌活性.

表1 AUY对7种真菌的MIC值(μg/mL)
2.2 AUY与FCZ合用对真菌的协同作用
2.2.1 AUY与FCZ合用对真菌的MIC值
以化合物AUY为受试药物,以FCZ为阳性对照药,六种真菌为受试菌株,进行联合抗真菌药敏实验,其结果如表2所示.分析可知,AUY与FCZ合用48 h时,对于耐药白念珠菌103和热带念珠菌的FIC值小于0.5,表现为协同作用;对于光滑念珠菌、克柔念珠菌、近平滑念珠菌和白念珠菌SC5314表现为无关作用.

表2 化合物AUY与FCZ合用后对各种
2.2.2 AUY与FCZ联用对2种真菌生长的影响
由联合抗真菌药敏实验结果,以化合物AUY为受试药物,选用耐药白念珠菌103、热带念珠菌为受试菌株,进行生长实验.由图1可知,对于耐药白念珠菌103、热带念珠菌,各实验组中菌液澄清度由浊到清(抑菌力由弱到强)依次为对照组、AUY单用组、FCZ单用组、联合用药组.FCZ和AUY联合用药的五个实验组中,当FCZ浓度不变,随着AUY浓度增加,其菌液澄清度愈高,抑菌效果越好.

图1 化合物AUY与FCZ合用对 2种真菌生长的影响
2.2.3 AUY与FCZ联用对2种真菌的时间-杀菌曲线
(1)FCZ和AUY联用对热带念珠菌存活的影响
由表3和图2可知,单用时AUY(16μg/mL)抑菌能力弱于FCZ(8μg/mL);两种药物单用抑菌效果小于联合用药各组;48时联合用药各组的存活菌落数为0;联合用药组在FCZ浓度为8μg/mL时,随着AUY浓度提高,相同时间下存活菌落数越少,抑菌能力越强.分析表明,不同浓度的AUY与FCZ合用对热带念珠菌表现协同抗菌甚至杀真菌活性,且在48 h时,两药合用后表现完全杀菌作用.

表3 FCZ和AUY联合作用对热带念珠菌不同

图2 FCZ和AUY联合作用对热带 念珠菌的时间-杀菌曲线
(2)FCZ和AUY联合用药对耐药白念珠菌103存活的影响
由表4和图3可知,单用AUY和FCZ时,FCZ(8μg/mL)抑菌能力强于AUY(16μg/mL),两种药物单用抑菌效果小于联合用药各组;当FCZ浓度为8μg/mL时,随着合用的AUY浓度提高,其抑菌能力增强.结果分析表明,当受试菌株为耐药白念珠菌103时,不同浓度的AUY与FCZ合用对耐药白念珠菌103表现协同甚至杀真菌活性.

表4 FCZ和AUY联合作用对耐药白念珠菌103
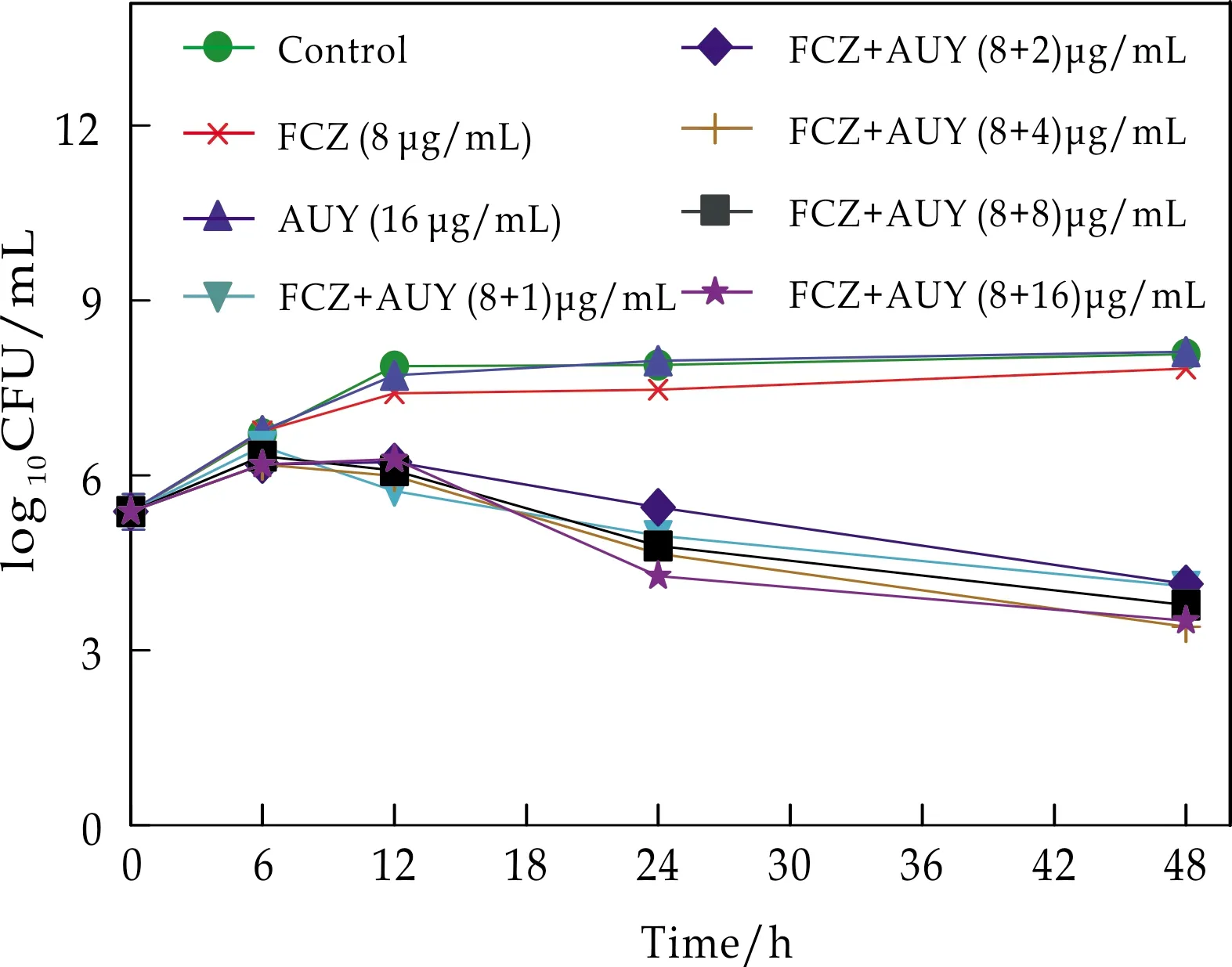
图3 FCZ和AUY联用作用于耐药 白念珠菌103的时间-杀菌曲线
2.2.4 AUY与FCZ联用对2种真菌的抑菌圈
(1)AUY与FCZ联用对热带念珠菌的抑菌圈
如图4所示,FCZ(8μg/mL)的抑菌圈较模糊,单用AUY(16μg/mL)时无明显抑菌圈.FCZ+AUY(8+2)μg/mL、(8+8)μg/mL、(8+16)μg/mL这三组有明显的抑菌圈,对应抑菌圈直径依次为2.2 cm、2.3 cm、2.5 cm.综上分析可得,当受试菌株为热带念珠菌时,FCZ与AUY联用具有明显的协同抗真菌作用;且当FCZ浓度为8μg/mL时,随着AUY浓度的提升,联合用药组的抑菌作用愈加明显.

图4 FCZ和AUY联用对热带念珠菌 的抑菌圈
(2)AUY与FCZ联用对耐药白念珠菌103的抑菌圈
如图5所示,FCZ(8μg/mL)抑菌圈较模糊,单用AUY(16μg/mL)时无明显抑菌圈.FCZ+AUY(8+2)μg/mL、(8+8)μg/mL、(8+16)μg/mL三组有明显的抑菌圈,对应抑菌圈直径依次为2 cm、2.2 cm、2.3 cm.综上分析可得,当受试菌株为耐药白念珠菌103时,FCZ与AUY联用具有一定的协同抑菌作用;且当FCZ浓度为8μg/mL时,随着AUY浓度的提升,联合抑菌作用愈加明显.

图5 FCZ和AUY联用对耐药白念珠菌 103的抑菌圈
2.2.5 AUY与FCZ联用对真菌菌丝形成的影响
(1)化合物AUY与FCZ联用对白念珠菌SC5314菌丝形成的影响
由图6可知,空白组随时间推移,菌体细胞形态延长,部分细胞间出现间隔,呈假菌丝形态;FCZ组未生长出菌丝;AUY组菌丝形成且数量较多;FCZ+AUY(8+2)μg/mL组中,菌丝消失且细胞生长收抑;FCZ+AUY(8+8)μg/mL与FCZ+AUY(8+16)μg/mL组情况类似.结果分析表明,化合物AUY与FCZ联用对白念珠菌SC5314的菌丝形成无协同抑制作用.
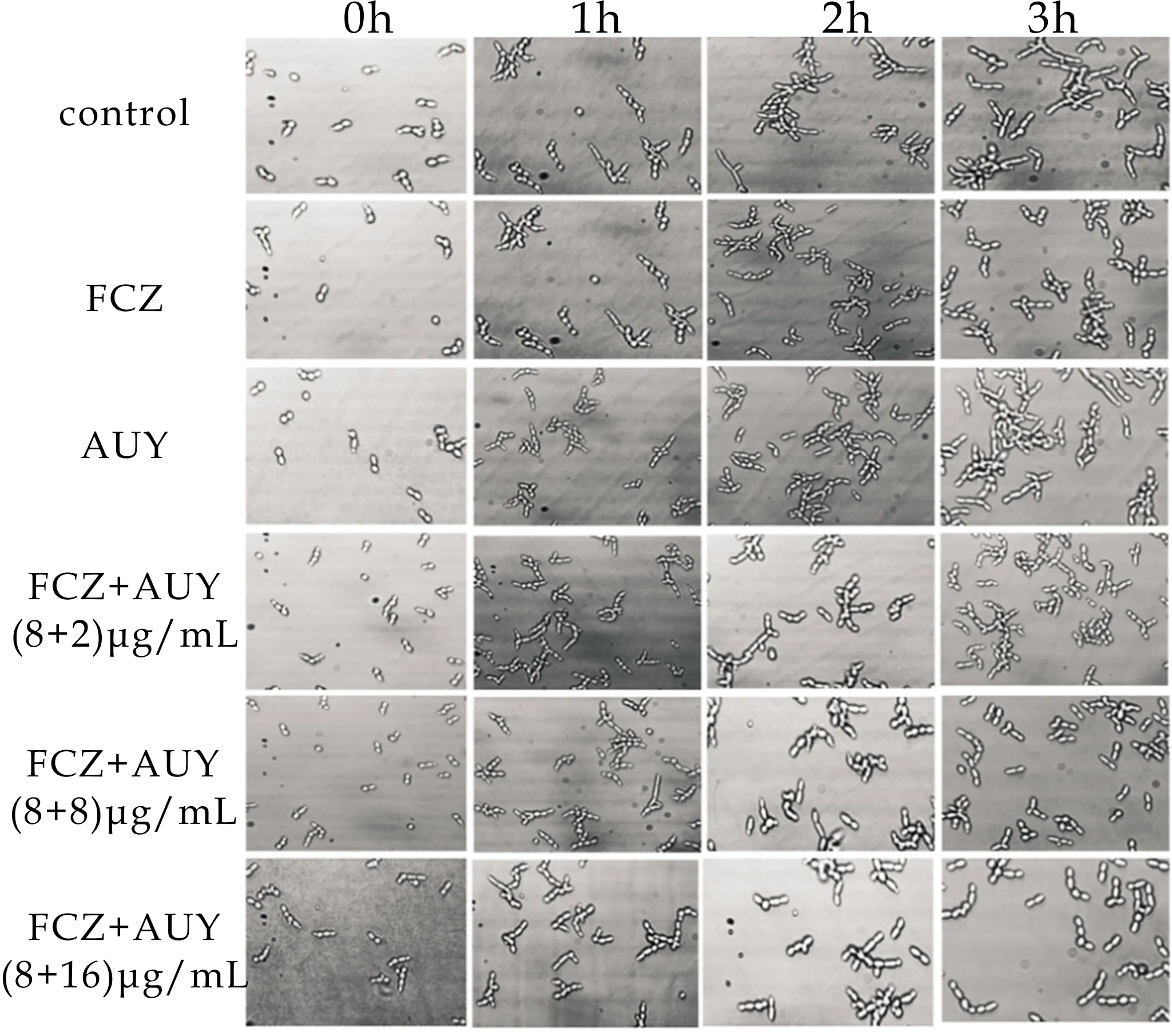
图6 AUY和FCZ联用对敏感白念珠菌 SC5314菌丝形成的影响
(2)化合物AUY与FCZ联用对耐药白念珠菌菌丝形成的影响
由图7可知,空白组菌丝细长,FCZ和AUY组菌丝较为细小;FCZ+AUY(8+2)μg/mL、FCZ+AUY(8+8)μg/mL、FCZ+AUY(8+16)μg/mL三组中,FCZ+AUY(8+16)μg/mL组中菌丝生长收抑制,比剩余各组菌丝更为细小.综上分析可得,化合物AUY与FCZ联用后对耐药白念珠菌103的菌丝形成抑制作用强于两药体外单用.
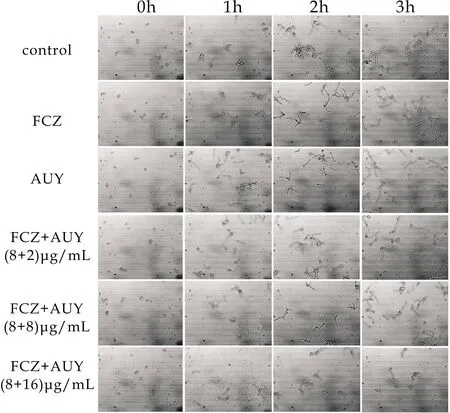
图7 AUY和FCZ联用对耐药白念珠菌 103菌丝形成的影响
3 结论
真菌感染类疾病因其对传统唑类等治疗药物耐药性的逐步提升,成为了现代医疗发展绕不开的难题.以HSP90作为药物靶点的研究方向逐渐成为新型抗真菌药物研发的重心.故本实验选用HSP90抑制剂AUY为受试药物,采用不同实验对AUY进行全面的体外单用和联合FCZ抗真菌活性研究.借助药敏试验测定了FCZ和AUY体外单用时对七种真菌的MIC值.通过棋盘式微量稀释法进一步证实FCZ和AUY联用对热带念珠菌和耐药白念珠菌具有抑菌或杀菌作用.后期通过生长实验、时间-杀菌曲线实验、菌丝生长等实验综合评价不用浓度的AUY和FCZ联用时的抗真菌活性强弱及其抗菌谱.
综合各实验结果得出以下结论:AUY体外单用时对热带念珠菌、敏感和耐药白念珠菌、新生隐球菌有中等到弱的抑菌活性(MIC值为16~64μg/mL);AUY单用时对于真菌抑菌能力弱于同等浓度下的FCZ;AUY与FCZ合用时对耐药白念珠菌和热带念珠菌表现明显的协同抗菌甚至杀菌活性;AUY和FCZ联用时对热带念珠菌的抗真菌活性最优,耐药白念珠菌次之;且随着时间的延长和药物浓度的增大,其协同抗菌能力增加.
后续进一步将研究AUY与FCZ体内协同抗真菌活性和作用机制.另一方面也将开展对于AUY的结构改造优化,以期望发现新型抗真菌先导化合物或候选药物.

