油橄榄叶提取物的抑菌抗炎作用研究
陈文东, 朱秀娟, 陈耀年, 叶文斌, 韩 强
(1.陇南师范高等专科学校 农林技术学院, 甘肃 成县 742500; 2.陇南特色农业生物资源研究开发中心, 甘肃 成县 742500; 3.成县狗博士动物医院, 甘肃 成县 742500)
0 引言
油橄榄(OleaeuropaeaL.)原种植于地中海地区,又称洋橄榄,属木犀科木樨属油料作物,我国自1956年开始引种油橄榄,种植区域主要分布在甘肃、四川、云南、广东和广西等地[1,2],甘肃武都区作为我国最大的油橄榄种植基地之一,已被《国家地理标志产品保护规定》(2015年)重点保护[3].油橄榄果实中榨取的橄榄油含有丰富的不饱和脂肪酸、类胡萝卜素、维生素、角鲨烯和多酚等活性物质,可以保持健康的肠道菌群、养肤护肤、预防慢性疾病,被誉为“植物油皇后"和"液体黄金”[4].
随着橄榄油市场需求的不断增加,每年各地产出大量油橄榄果实附属产物,油橄榄叶作为附属产物之一,却未被充分合理利用,有研究发现,油橄榄叶中含有多种酚类化合物生物活性物质,包括裂环烯醚帖类、黄酮类化合物、咖啡酰苯乙醇苷类、木脂素类和简单酚类等[5],具有抗病毒、抗肿瘤、抗真菌、抗氧化、降血糖和保护心血管等功效[6,7].
本研究以油橄榄叶提取物(Oliveleavesextract,OLE)和常见四种病原菌为研究对象,初步探讨油橄榄叶提取物的抑菌抗炎作用,为研究和开发替代抗生素的高效、低毒、低残留纯中药制剂提供理论依据.
1 材料与方法
1.1 药物、菌种和培养基
油橄榄叶提取物,陇南田园油橄榄科技开发有限公司;阿司匹林,拜耳医药;舒泰50,法国维克;大肠埃希氏菌、粪肠球菌、溶血性链球菌和克雷伯氏肺炎菌,均来自腹泻灰鹤的泄殖腔;营养肉汤培养基和普通琼脂平板,上海博微生物科技有限公司,按微生物教材配制.
1.2 试剂和仪器
伊文斯兰,Sigma;二甲苯,无水乙醇,乙酸,均购自天津大茂化学试剂厂;分析天平,上海精密科学仪器;分光光度计,上海屹谱;旋转蒸发仪,上海亚荣;鼓风干燥箱,泰州天泰;电热式压力蒸汽灭菌器,上海新丰.
1.3 实验动物
SPF级BALB/c小鼠,体重30~35 g,雌雄各半,购自兰州兽医研究所.
1.4 实验方法
1.4.1 OLE水煎液制备
将50 g油橄榄叶提取物浸泡于500 mL蒸馏水内半小时,电炉煮沸后继续熬制30 min,将煎煮好的药液分装入10 mL离心管,2 500 r/min离心,将上清液保存,沉淀物再次熬制.混合两次上清液并浓缩至50 mL,此时药液含药量为1 g/mL,121 ℃条件下高压蒸汽灭菌20 min,密封,置于4 ℃冰箱备用.
1.4.2 OLE对四种病原菌的抑制作用
(1)细菌悬液浓度的调整
超净台内无菌操作,将已培养18 h的细菌悬液倍比稀释,再将各浓度的细菌悬液分别涂布到普通琼脂培养基上,恒温培养箱内培养24 h,精确数取各培养基内的菌落数,根据培养基内菌落个数调整细菌悬液浓度至5×106CFU/mL.
(2)OLE对细菌的MIC和MBC
超净台内无菌操作,在九支试管内分别加入3 mL普通肉汤培养基,然后在第一支试管内加入3 mL OLE,混合均匀后,吸取3 mL液体至第二支试管,以此类推,梯度稀释至第八支试管,第九支试管不加OLE,另取一支试管只加OLE 3 mL.最后在前九支试管内分别加入上述已调整好浓度的菌液100μL,第十支试管加0.9%NaCl 100μL,旋涡混合器上混合均匀,37 ℃培养24 h,观察各试管浑浊情况,记录结果.以试管内液体清亮透明为OLE的MIC,将确定MIC及与该试管前后相邻试管内的液体涂布于普通琼脂培养基内,培养计数,以普通琼脂培养基内不超过5个菌落的试管浓度为OLE的MBC.
(3)OLE的抑菌圈
超净台内无菌操作,在普通琼脂培养基上涂布100μL调整好浓度的细菌悬液,然后再将三个牛津杯置于培养基上,每个牛津内加OLE浓度为1 g/mL、0.5 g/mL、0.25 g/mL的药液250μL,37 ℃培养24 h后测定抑菌圈直径.直径≥20 mm为细菌对OLE极敏感;20 mm>直径≥15 mm为细菌对OLE高度敏感;15 mm>直径≥10 mm为细菌对OLE中度敏感;直径<10 mm为细菌对OLE无效.
1.4.3 OLE体内抗炎作用
(1)OLE对小白鼠毛细血管通透性的影响
取50只小白鼠,雌雄各半,平均分成五组,第一组为高剂量组,每日灌胃0.2 g/mL OLE,第二组为中剂量组,每日灌胃0.1 g/mL OLE,第三组为低剂量组,每日灌胃0.05 g/mL OLE,第四组为阳性对照组,每日灌胃0.001 g/mL阿司匹林,第五组为空白对照组,每日灌胃0.1 g/mL 0.9%NaCl,各组灌胃量均为0.01 mL/g,连续灌胃7日.末次灌胃12 h后,将Evans blue溶液注入小白鼠血管内,然后倒提小白鼠将冰乙酸注入腹腔,使小白鼠自由活动半小时后,断颈致死,再将5 mL 0.9%NaCl注入小白鼠腹腔,按摩后,解剖小白鼠,移液器吸腹腔内液体到离心管中,2 500 r/min离心10 min,用紫外分光光度计在590 nm波长下测上清液吸光度,记录数据并计算通透性抑制率.通透性抑制率=(空白组吸光值-药物组吸光值)/空白组吸光值×100%.
(2)OLE对小白鼠耳肿胀的影响
小白鼠分组及灌胃方法同1.4.3(1),末次灌胃12 h后,在小白鼠一侧耳廓的上下两面分别滴涂10μL二甲苯,另一侧耳廓作空白对照,半小时后将小白鼠断颈致死,用打孔器将小白鼠左、右相同位置的耳廓打下,电子分析天平称重,记录数据并计算耳肿胀抑制率和肿胀度.
小白鼠耳肿胀度=滴二甲苯侧耳廓质量-空白对照侧耳廓质量;肿胀抑制率=(对照组平均肿胀度-滴二甲苯组平均肿胀度)/对照组平均肿胀度×100%.
(3)OLE对小白鼠棉球肉芽肿的影响
小白鼠分组同1.4.3(1),小白鼠注射舒泰50麻醉,将小白鼠一侧腹股沟背毛剃光,碘伏消毒后用剪刀剪一小口,然后用镊子将灭菌后的脱脂棉球塞入皮下,常规缝合,12 h后灌胃给药,灌胃方法同1.4.3(1),末次灌胃12 h后,断颈致死小白鼠,解剖出腹股沟皮下的脱脂棉球,置于烘箱内干燥至恒重,记录数据并计算肉芽肿质量和增生抑制率.
肉芽肿质量=棉球肉芽肿质量-原棉球质量;增生抑制率=(空白对照组肉芽肿平均质量-OLE组肉芽肿平均质量)/空白对照组肉芽肿平均质量×100%[8].
(4)统计学分析
运用SPSS26.0对数据进行分析,数据用“平均数±标准差(±SE)”表示;用单因子方差分析(One- way ANOVA,LSD)进行差异显著性检验.
2 结果与讨论
2.1 体外抑菌作用
三个浓度的OLE分别作用于大肠埃希氏菌、粪肠球菌、溶血性链球菌和克雷伯氏肺炎菌.结果表明,1 g/mL、0.5 g/mL、0.25 g/mL的OLE对大肠埃希氏菌、粪肠球菌和溶血性链球菌具有一定的抑制作用,且浓度越高,抑菌效果越好,1 g/mL OLE对大肠埃希氏菌、粪肠球菌和溶血性链球菌的抑菌圈直径分别为15.28 mm、17.59 mm和18.37 mm,均为高度敏感(如表1所示).OLE对大肠埃希氏菌的MIC和MBC为0.125 g/mL和0.25 g/mL,对粪肠球菌和溶血性链球菌的MIC和MBC均为0.062 5 g/mL和0.125 g/mL,OLE对克雷伯氏肺炎菌无抑制作用.表明OLE对三种病原菌具有一定的抑菌和杀菌作用(如表2所示).

表1 OLE抑菌直径 (mm)

表2 OLE的MBC和MIC (mg/mL)
2.2 抗炎作用
2.2.1 OLE对小白鼠毛细血管通透性的影响
OLE对小白鼠毛细血管通透性升高抑制作用(如表3所示),高、中、低剂量和阳性对照组对毛细血管通透性升高抑制率分别为49.15%、35.88%、23.30%和53.40%.与空白对照组相比,阳性对照和OLE高剂量组对小白鼠毛细血管通透性的影响差异极显著(P<0.01),中剂量组对小白鼠毛细血管通透性的影响差异显著(P<0.05),OLE低剂量组与阳性对照存在显著性差异(P<0.05),其余各组之间相比无统计学意义,差异不显著.

表3 OLE对小白鼠毛细血管通透性的影响
2.2.2 OLE对小白鼠耳肿胀的影响
OLE对小白鼠耳肿胀有抑制作用(如表4所示),阳性对照和高、中、低剂量组的耳肿胀抑制率分别为59.63%、53.00%、31.34%和9.03%.与空白对照组相比,阳性对照和OLE高、中剂量组对小白鼠耳肿胀抑制作用极显著 (P<0.01),与阳性对照相比,OLE中、低剂量组抑制小白鼠耳肿胀作用极显著(P<0.01),OLE高剂量组与中剂量组存在显著差异(P<0.05),与低剂量组存在极显著差异(P<0.01),OLE中剂量组与低剂量组之间存在显著性差异(P<0.05),OLE高剂量组与阳性对照、低剂量组与空白对照组相比无统计学意义,差异不显著.

表4 OLE对小白鼠耳肿胀的影响
2.2.3 OLE对小白鼠棉球肉芽肿的影响
OLE对小白鼠棉球肉芽肿增生有抑制作用(如表5所示),高、中、低剂量组和阳性对照组对小白鼠肉芽肿增生抑制率分别为55.27%、29.39%、23.96%和57.83%.与空白对照组相比,OLE高剂量组和阳性对照对小白鼠棉球肉芽肿增生有极显著的抑制作用(P<0.01),与低剂量组相比,阳性对照和高剂量组对小白鼠棉球肉芽肿增生有显著的抑制作用(P<0.05),其余各组之间相比无统计学意义,差异不显著.
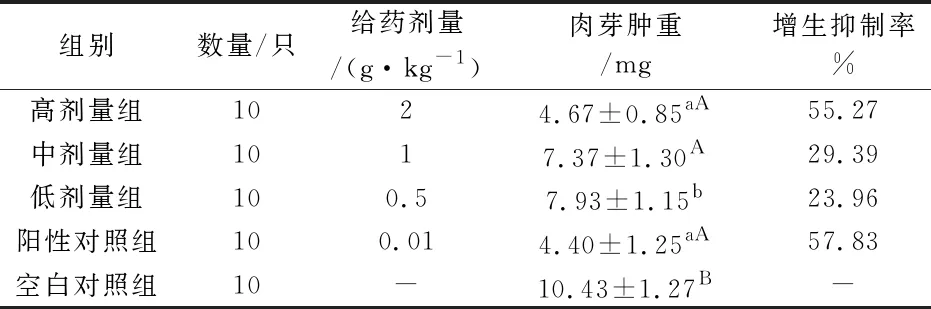
表5 OLE对小鼠棉球肉芽肿的影响
近年来,由于兽医临床上抗生素滥用现象严重,导致细菌产生耐药性情况急剧恶化,而我们研发新药物的能力远赶不上细菌耐药性产生的速度[9,10],细菌耐药性的产生严重危害人类和畜禽养殖业健康,已经成为全球公认的一大公共卫生问题.Trotter A J等[11]预计如果不及时制止细菌耐药性产生,到2050年全球因细菌耐药性而死亡的人数将达到1 000万.因此,寻找一种高效、低毒、低残留、无副作用的纯中药制剂来替代抗生素称为当前热门议题.炎症是机体对致炎因素引起的损伤所产生的以防御反应为主的免疫应答性反应,常发生于各种组织,是十分常见而复杂的病理过程,临床上动物传染病、动物寄生虫病、动物内科病及外科病等都以炎症为基础[12].研究表明,白藜芦醇、葛根素、姜黄素和苦参碱等天然化合物可改善肺部疾病哮喘[13],中药黄连的提取物黄连素能介导NF-κB信号通路缓解哮喘的呼吸道炎症反应[14],也能减轻香烟烟雾引起的急性肺部炎症[15,16].本研究以OLE和致四种病原菌为研究对象,初步探讨OLE的抑菌抗炎作用,为研究和开发能替代抗生素的高效、低毒、低残留、无副作用的纯中药制剂提供理论依据;为畜牧养殖业健康发展,促进动物绿色健康生产提供科学依据.
3 结论
本研究以OLE和四种常见病原菌为研究对象,用试管二倍稀释法和牛津杯法检测OLE对病原菌的MIC、MBC和抑菌活性.结果表明,OLE对四种病原菌中的三种有一定的抑制生长作用,抗炎效果随着药物剂量的增加而增加.OLE对大肠埃希氏菌的MIC和MBC为0.125 g/mL和0.25 g/mL,对粪肠球菌和溶血性链球菌的MIC和MBC均为0.062 5 g/mL和0.125 g/mL.1 g/mLOLE对大肠埃希氏菌、粪肠球菌和溶血性链球菌的抑菌圈直径分别为15.28 mm、17.59 mm和18.37 mm,均为高度敏感,OLE对克雷伯氏肺炎菌无抑制作用.
通过小白鼠毛细血管通透性试验、小白鼠耳肿胀试验和小白鼠棉球肉芽肿增生试验测定OLE抗炎作用,分别测定通透性抑制率、小白鼠耳肿胀抑制率和棉球肉芽肿增生抑制率,评价OLE的抗炎效果.试验结果表明,OLE对三种验证模型均有抑制作用,且抗炎作用随着OLE水煎液剂量的增大而增强.OLE水煎液高剂量组(2 g/kg)毛细血管通透性抑制率为49.15%,小白鼠耳肿胀抑制率53.00%,小白鼠棉球肉芽肿增生抑制率为55.27%,与空白对照组和阳性对照组相比存在极显著性差异(P<0.01),表明OLE有较好的抗炎作用,但抗炎效果不如阿司匹林.

