芬戈莫德预处理对局灶性脑缺血再灌注大鼠脑组织炎症反应的影响
李 娜,张 磊,王建楠,李 静,乔嘉璐,王奕丹,隋汝波
脑缺血性卒中,是指各种原因所致脑部血液供应障碍,导致局部脑组织缺血、缺氧性坏死,而出现相应神经功能缺损的一类临床综合征[1]。其已成为我国居民死亡的首要原因[2]。目前治疗手段中,不论是急性期的静脉溶栓、机械取栓,还是后续的抗栓、他汀类药物降脂稳定斑块治疗,仍有26%~43%的患者病情进展加重[3],目前考虑可能与水肿、持续低灌注及缺血再灌注损伤等相关。静脉溶栓及机械取栓虽然在治疗上可直接疏通阻塞血管,实现血管再通,但此种治疗方法的关键问题——治疗时间窗很大程度上限制了治疗的进行,同时,脑缺血再灌注损伤亦不容忽视[4],而目前临床应用清除氧自由基、神经保护剂等治疗效果欠佳,积极控制血压可能有效,但目前具体控制范围尚不明确[5]。所以深入探讨有效治疗手段势在必行。
芬戈莫德(FTY720)为一种新型口服免疫抑制剂,在神经系统疾病治疗中的作用机制有FTY720对神经细胞的直接保护作用、促进微血管形成、减少淋巴细胞从淋巴结的流出及促进淋巴细胞归巢、阻止病灶处小胶质细胞激活、通过mTOR/p70S6K通路降低神经元自噬、减少帕金森病相关蛋白及多巴胺能神经元丢失等诸多方面。目前FTY720已被批准用于治疗多发硬化[6]。有研究报道FTY720对大鼠脑出血继发神经损伤具有保护作用[7];在大鼠自闭症模型中,FTY720可改善大鼠空间障碍、学习障碍[8],说明其具有神经保护作用;近年研究指出FTY720亦可减轻急性缺血性卒中损伤模型动物的症状。其机制可能与外周淋巴细胞迁徙及中枢胶质细胞活化进而引发炎症反应相关。基于目前研究表明的缺血性卒中存在炎症反应机制,FTY720或可作为一种新药物应用于脑血管疾病。
炎症因子升高机制研究表明p38MAPK(mitogen-activated protein kinase,MAPK)磷酸化可能与此过程相关[9,10]。p38MAPK在下游可与NF-κB通路聚集,调控其炎症介质的产生和作用[11,12]。p38MAPK通路在缺血损伤脑组织中显著升高,有报道提到结扎大鼠双侧颈总动脉致缺血7 min后再灌注,发现大鼠海马区小胶质细胞内p38MAPK活性增强,并且p38MAPK抑制剂可有效减少神经元死亡[13],其机制可能与直接降低下游炎症反应相关以及与小胶质细胞表型转化相关(见图1)。由此我们想探讨FTY720能否改善局灶性缺血再灌注模型神经缺损症状及减轻神经元损伤,而这一保护作用是否与p38MAPK通路和炎症因子相关。

图1 脑缺血性卒中后免疫反应
1 材料与方法
1.1 实验材料
1.1.1 实验动物 8 w龄(250~300 g)SD大鼠雌雄各半。锦州医科大学实验动物中心提供,饲养于锦州医科大学SPF实验动物中心。
1.1.2 主要试剂 硫酸氢氯吡格雷片(赛诺菲);芬戈莫德(Sigma公司);TTC染料(南京生物建成有限公司)、组织蛋白提取试剂盒(Bestbio);BCA蛋白浓度测定试剂盒(Bestbio);IL-1βELISA试剂盒(云克隆生物技术有限公司)、IL-6 ELISA试剂盒(云克隆生物技术有限公司)。p-p38MAPK抗体(Afinity Biosciences)、NF-κB抗体(Afinity Biosciences)。
1.2 实验方法
1.2.1 分组及给药 实验分为假手术组、空白对照组、氯吡格雷组及FTY720组;氯吡格雷组给予硫酸氢氯吡格雷7.71 mg/(kg·d)1次灌胃,FTY720组给予硫酸氢氯吡格雷7.71 mg/kg+FTY720 0.6 mg/(kg·d)1次灌胃,空白对照组及假手术组给予同体积生理盐水日1次灌胃,给药时间为造模前连续7 d及造模后24 h内给药1次。
1.2.2 建模及取材 实验动物采用改良的Longa法建立脑缺血卒中模型,术前12 h给予大鼠禁食水处理,术前应用25 g/L的水合氯醛进行大鼠腹腔内注射麻醉,大鼠仰卧位固定,作颈正中切口,分离出右侧颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA),在近颅底处将翼腭动脉剥离,并将其起始部结扎,在ECA残端剪一小孔,将鱼线经小孔插入ECA至ICA,插入约18 mm可感受轻微受阻,表明线头端触及大脑前动脉(ACA)近端壁,将大脑中动脉(MCA)起始部阻断。造模成功标准:大鼠有前肢为重的偏瘫及右侧Horner征。假手术组操作至剥离翼颚动脉结束。栓塞2 h后实行再灌注。再灌注24 h后每组取大鼠经右侧颈内动脉灌注0.9%生理盐水及4%多聚甲醛固定脑组织(n=12),断头取脑后泡入多聚甲醛存于4 ℃留用;断头冰上活取海马组织(n=6取材时间控制在1 min左右)。
1.2.3 指标测定
1.2.3.1 行为学指标 Longa评分 0分:未见相关行为障碍;1 分:瘫痪侧前爪无力;2分:行走向瘫痪侧倾斜、转圈;3分:行走向患侧歪倒;4分:无肢体活动、意识丧失。
1.2.3.2 TTC染色 取-20 ℃冻存20~30 min左右脑组织质地略硬的大鼠大脑组织,应用刀片冠状面方向将整个脑组织平均切成5个切片,每层约2~3 mm厚,将其放入预先配置完成并于37 ℃水浴锅中预热的染料中染色20~30 min,观察染色情况。
1.2.3.3 HE染色 取大脑海马组织经脱水、透明、浸蜡与包埋,将蜡块常规切片,HE染色观察大鼠海马组织形态学改变。
1.2.3.4 ELISA法测定IL-1β、IL-6水平 取适量组织块,在预冷PBS中(0.01 mol/L,pH=7.0~7.2)中清洗去除血液,切成小块,均匀的放入放置在冰上的装有新鲜裂解缓冲液中(质量体积比1∶20~1∶50),将得到的悬浊液经超声处理至澄清,匀浆液10 000 r/min离心5 min,取上清。实验前按说明书标准品、实际准备;加样100 μl,37 ℃孵育1 h;甩干,加检测液A 100 μl,37 ℃孵育1 h;洗板3次;加检测液B 100 μl,37 ℃孵育1 h;洗板5次;加TMB底物90 μl,37 ℃孵育10~20 min;加终止液50 μl,立即450 nm读数。
1.2.3.5 Western Blot测定p-p38MAPK、NF-κB水平 将样品去根蛋白提取试剂盒提取蛋白,复合物以12,000 r/min(10 min,4 ℃)离心后,获取上清。用BCA蛋白质测定试剂盒测定裂解物中的蛋白质水平后,用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离40 μg蛋白质,并转移到聚偏二氟乙烯膜上。用含0.1%Tween-20的TBS中的1%牛血清白蛋白在室温下封闭膜2 h,TBST洗涤3次,用下列一抗溶液:抗p-p38MAPK抗体(1∶1000)抗NF-κB抗体(1∶1000),4 ℃孵育过夜,TBST洗涤3次,第二抗体室温孵育2 h。使用ChemiDoc-ItTMTS2成像仪(UVP,LLC,Upland,CA,USA)显影,并使用ImageJ2x软件程序(National Institute of Health,Bethesda,MD,USA)进行分析。
2 实验结果
2.1 行为学指标结果 假手术组无神经功能缺失表现;FTY720治疗组神经功能缺失评分与空白对照组(P<0.01)及氯吡格雷组(P<0.01)明显降低(见图2、图3)。

注:与假手术组比较 △P<0.01;与空白对照组比较#P<0.01
2.2 TTC染色结果 假手术组大鼠脑组织未见梗死病灶,FTY720组大鼠梗死灶较空白对照组明显减小(P<0.01),较氯吡格雷组明显减小(P<0.01)(见图3、图4)。

图3 各组大鼠脑组织梗死情况
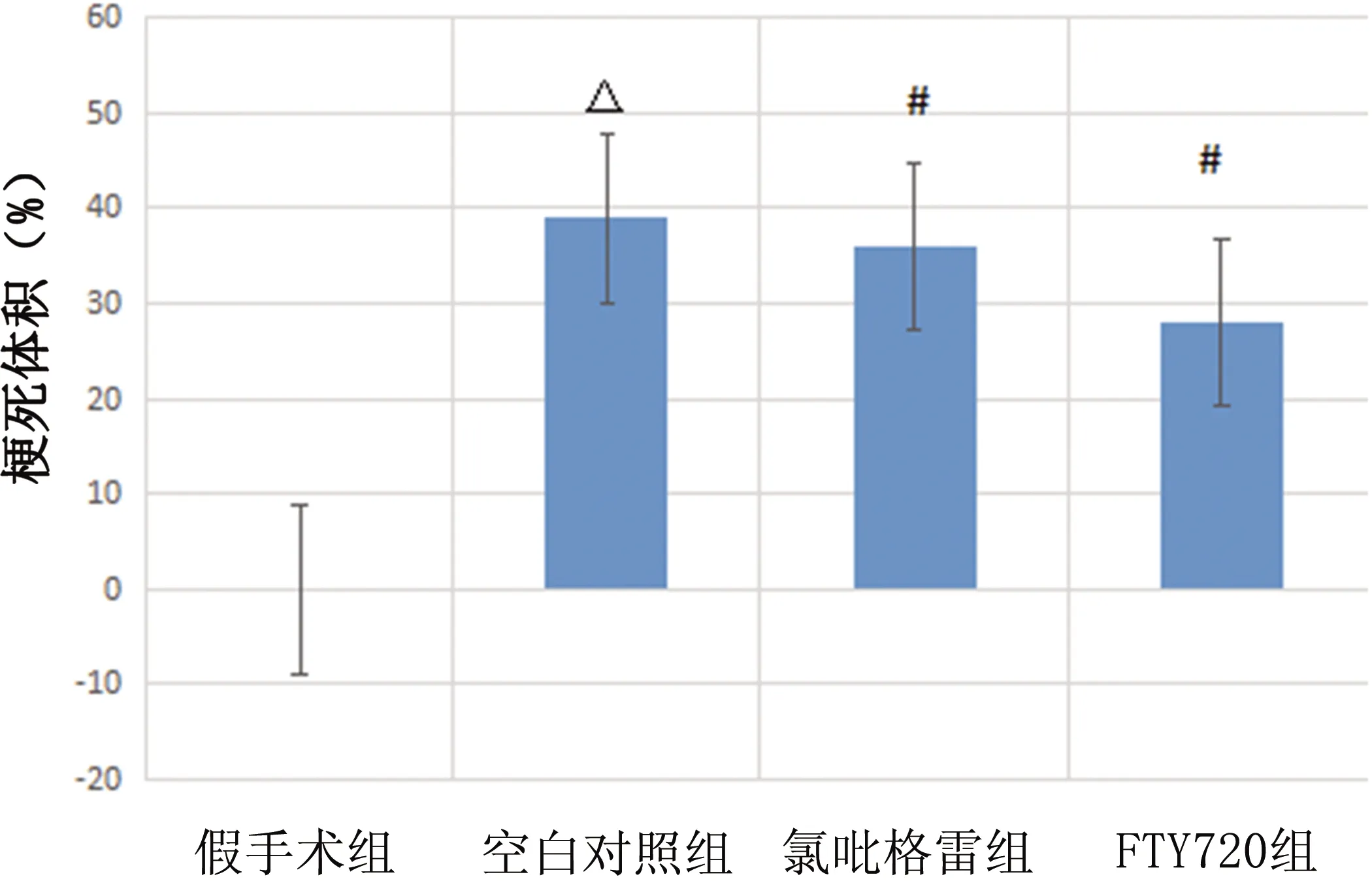
注:与假手术组比较 △P<0.01;与空白对照组比较#P<0.05
2.3 HE染色结果 假手术组大鼠海马各区神经元形态相对完整且饱满,排列致密而有序,空白对照组、氯吡格雷治疗组及FTY720治疗组中发现C3区神经元出现细胞萎缩,排列紊乱且稀疏,核固缩等现象,且可见有淋巴细胞浸润,但FTY720组细胞改变程度及淋巴细胞浸润明显小于空白对照组及氯吡格雷组(见图5)。

注:A:假手术组;B:对照组;C:氯吡格雷治疗组;D:FTY720组
2.4 ELISA法测定海马组织IL-1β及IL-6含量结果 FTY720组大鼠海马组织IL-1β及IL-6含量较空白对照组(P<0.01)及氯吡格雷治疗组均降低(P<0.01);氯吡格雷组IL-1β、IL-6含量较空白对照组无明显差异(P=0.452,P=0.133)(见图6)。

注:与假手术组比较 △P<0.01;与空白对照组比较#P<0.01
2.5 Western-blot法测定海马组织p-p38MAPK、NF-κB水平结果 FTY720组p-p38MAPK(P<0.01)及NF-κB(P<0.01)较空白对照组及氯吡格雷组明显降低,氯吡格雷组较空白对照组p-p38MAPK及NF-κB水平明显降低(P<0.01)(见图7、图8)。

注:A:假手术组;B:对照组;C:氯吡格雷组;D:FTY720组

注:与假手术组比较 △P<0.01;与空白对照组比较#P<0.01
3 讨 论
脑缺血再灌注损伤机制错综复杂,国内外学者研究结果迥异,如缺血脑组织炎症因子释放、氧化应激、神经元凋亡等均影响缺血性卒中的预后,目前具体通过何种机制尚无明确定论。近年来在脑缺血卒中机制研究中,发现炎症因子扮演着重要角色,脑缺血发生后,一方面,外周淋巴组织释放淋巴细胞分泌炎症因子,淋巴细胞及炎症因子向中枢迁徙,破坏血脑屏障,造成神经组织损伤;另一方面,脑缺血后,释放趋化因子,促使IL-1、IL-6及黏附分子等释放[14],引发炎症反应,进一步损伤脑组织,实验证明通过药物减少IL-6、IL-23等炎症因子的释放,可减轻脑缺血性卒中动物模型的神经缺损症状及脑组织结构变化[15,16]。早期实验发现p38MAPK/NF-κB通路是调节机体炎症因子释放的关键通路之一[9,10,17],同时,如前所述,p38MAPK参与小胶质细胞的表型转化,从而影响炎症反应。大量实验证明在脑缺血卒中过程中p38MAPK水平明显升高[18],且有报道指出,应用姜黄素、丁苯酞等药物治疗脑缺血卒中可改善神经缺损症状,且相应脑组织中p38MAPK明显降低[19,20],由此可知,p38MAPK通路在脑缺血性卒中发生过程中的重要地位,此过程可能与炎症反应相关。
本实验中,FTY720治疗组大鼠的神经功能评分明显较空白对照组及氯吡格雷组高,在宏观症状上说明其可改善缺血性卒中动物的神经症状。有文献曾指出FTY720可改善脑出血模型神经缺损症状[7,8]、自闭症模型的记忆、行为等症状[11],本实验结果验证了FTY720可改善脑缺血再灌注损伤模型神经功能,从个体水平验证了FTY720的神经保护作用。此外,FTY720治疗组动物模型中脑组织HE染色显示细胞形态变化及淋巴细胞浸润程度较轻,其从细胞水平上对FTY720的神经保护作用提供了证据。
FTY720的神经保护作用已得到验证,为明确其神经保护作用的可能机制,本实验测定了大鼠海马组织IL-1β、IL-6水平FTY720治疗组较空白对照组及氯吡格雷组明显降低,提示FTY720可降低缺血脑组织IL-1β、IL-6水平。大量实验证明炎症反应参与脑缺血卒中过程,IL-1β、IL-6水平在脑缺血卒中模型脑组织中明显增高[14],而另有实验应用大黄酚[21]、葛根素等[22]药物治疗后缺血卒中模型动物脑组织炎症因子明显减少,且改善模型动物脑缺血症状。本实验中FTY720组实验动物神经功能得到改善,因此,本实验验证了FTY720可通过减轻炎症反应从而对局灶性缺血再灌注损伤起到保护作用。
p38MAPK信号通路在缺血性卒中脑组织中水平明显升高,而应用p38MAPK抑制剂、姜黄素等药物干预后[23,24],缺血性卒中动物模型神经缺损症状得到改善,脑梗死面积缩小。p38MAPK/NF-κB通路是公认的引起下游炎症因子释放的一个关键通路,且近年研究发现p38MAPK与小胶质细胞表型转化相关[25]。本实验中FTY720治疗组p-p38MAPK及NF-κB水平较空白对照组及氯吡格雷组明显降低,氯吡格雷组二者水平较空白对照组降低,但炎症因子水平变化不具统计学意义,因p38MAPK既存在于胶质细胞亦存在于神经元,考虑氯吡格雷的抗血小板聚集作用降低了由于手术操作内皮损伤再栓塞,从而减少了神经元损伤的可能,而FTY720组变化更为明显提示FTY720与氯吡格雷二者合用既有抗血小板作用又联合抗炎作用,从而达到更显著的治疗作用。由此可见FTY720改善缺血再灌注大鼠神经功能及降低炎症反应可能与p38MAPK途径相关。
根据本实验得到的结果,FTY720可减轻缺血造成的神经功能缺损及中枢炎症反应,炎症反应减轻的中枢机制一方面为p38MAPK通路对炎症反应的影响,另一方面为小胶质细胞表型转化对炎症反应的影响,而小胶质细胞表型转化的机制目前尚不完善,文献研究可能与p38MAPK通路、STAT3通路等相关[26],本实验中p38MAPK水平变化虽与小胶质细胞表型转化趋势一致,但尚不能得出二者存在必然联系的结论,有待于进一步研究探讨。

