绞股蓝总皂苷经PI3K/Akt/Bax 信号通路对脓毒症大鼠脑损伤的改善作用
邱名耀吴梅秋张玮芳林明霞林先萍
(1.海南医学院第一附属医院急诊科,海口 570102; 2.海南医学院第一附属医院ICU,海口 570102;3.中南大学湘雅医学院附属海口医院肿瘤化疗科,海口 570208;4.海南医学院第一附属医院血透科,海口 570102)
脓毒症是重症监护中最重大的挑战之一,常引起多器官功能障碍,约一半以上患者可能并发脓毒症相关性脑病(sepsis associated encephalopathy,SAE),可影响神经功能,引起患者癫痫、昏迷,严重者导致死亡。大脑的海马区为主要认知功能区,SAE 的发生与海马功能区血管功能障碍、细胞损伤、氧化应激等有关[1-2],其中磷脂酰肌醇3 激酶(phosphatidylinositol 3 kinase, PI3K)/蛋白激酶 B(protein kinase B, Akt)通路与细胞凋亡和氧化应激反应密切相关[3]。Wang 等[4]发现,外源给予重组人促红细胞生成素可激活PI3K/Akt 通路,促进Akt磷酸化,降低促凋亡Bad 蛋白表达,进而减轻海马神经元凋亡,改善 SAE 大鼠脑功能障碍,提示PI3K/Akt 通路可能是SAE 的治疗靶标之一。以往临床上主要采取液体支持及抗生素治疗脓毒症,然而死亡率居高不下,因此,抗氧化等其他方案被逐渐重视。绞股蓝总皂苷(gypenosides, GYPs)为提取自传统中药绞股蓝Gynostemma pentaphyllum的皂苷类物质总称,具有抗氧化、调节免疫、抑制炎症等药理功能,近年国内外研究发现,GYPs 可通过降低炎症因子水平、提高抗氧化活性,有效减轻脂多糖诱导的小鼠炎症反应,改善帕金森小鼠记忆和学习认知功能[5-6],然而其对SAE 的治疗作用尚不清楚。本研究通过盲肠结扎穿孔术建立SAE 大鼠模型并通过分析海马组织PI3K/Akt 通路蛋白表达,初步探究GYPs 治疗SAE 的作用机制,以期为临床治疗提供参考。
1 材料和方法
1.1 实验动物
6 周龄雄性健康 SD 大鼠 69 只,SPF 级,购自广东省医学实验动物中心[SCXK(粤)2018-0002],体重180 ~200 g,于海南医学院第一附属医院动物房[SYXK(粤)2018-0004]常规饲养1 周,本研究经海南医学院第一附属医院伦理委员会IACUC 批准(MDK-20190316),并遵守3R 保护原则进行实验。
1.2 主要试剂与仪器
绞股蓝总皂苷(原料药,纯度≥98%,批号:52705-19)购自广州杨叶生物科技有限公司;PI3K抑制剂GNE-317(纯度:99.26%,批号:HY-12763)购自美国 MEC 公司;PI3K、半胱氨酸蛋白酶-3(caspase-3)、凋亡调节因子Bax 小鼠源抗体(批号:sc-365290、sc-56053、sc-70405)购自美国 Santa cruz 公司;Akt、凋亡调节因子 Bad、p-Akt 兔源抗体、羊抗 鼠 IgG 二 抗 ( 批 号: ab179463、 ab62465、ab38449、ab205718)购自美国 Abcam 公司;β-actin小鼠源抗体(批号:3700S)购自美国CST 公司;脂质氧化丙二醛(malonydialdehyde,MDA)、苏木素伊红(HE)染色、超氧化物歧化酶(superoxide dismutase,SOD)、TUNEL 凋亡试剂盒(批号:S0131M、C0105、S0101M、C1098) 购自碧云天(上海) 有限公司;PR4100 型酶标仪、1658001 型电泳仪均购自美国BioRad 公司;CX43 型光学显微镜购自日本奥林巴斯公司;Tanon 4100 型凝胶成像系统购自上海天能科技有限公司等。
1.3 实验方法
1.3.1 大鼠分组及模型制备
参照文献[7]采用盲肠结扎穿孔术制备SAE 大鼠,术后12 h 血压明显降低且脑电图异常表明SAE模型制备成功。造模过程中7 只死亡,2 只未观察到脑损伤,共造模成功48 只SAE 大鼠,按随机数表法分为:SAE 组、GYPs 组,GNE-317 组,GYPs+GNE-317 组,每组12 只。另取12 只大鼠剖腹术后未结扎或刺破,仅拨动盲肠作为假手术(Sham)组。于造模后2 h,GYPs 组灌胃给予200 mg/kg GYPs 溶液(溶剂:0.2% Tween 80 生理盐水)[8]、GNE-317 组灌胃给予 40 mg/kg GNE-317 溶液(溶剂同上)[9]、GYPs+GNE-317 组灌胃给予200 mg/kg GYPs 溶液+40 mg/kg GNE-317 溶液,灌胃体积2 mL,Sham 组及SAE 组给予等体积生理盐水,连续给药3 d,每天1 次。
1.3.2 反射实验评价大鼠神经行为
末次给药12 h 后观察大鼠一般情况,并分别采用耳廓反射、捏尾反射、角膜反射、逃逸反射、翻正反射对大鼠神经行为进行评分[10]。无反射为0 分,弱反射(10 s 内无反应)为1 分,正常反射为2 分,各项得分相加为总分,最高为10 分。
1.3.3 HE 染色观察大鼠海马组织病理损伤
反射实验结束,腹腔注射100 mg/kg 戊巴比妥钠麻醉处死大鼠,各组随机取3 只,经心脏依次灌注生理盐水、含4%多聚甲醛的磷酸缓冲液后,取脑、分离海马组织,制备石蜡切片(每片5 μm),部分切片采用HE 试剂盒染色后置于光学显微镜下观察;剩余9 只迅速断头取脑、分离海马组织,生理盐水洗净、切碎后装入冻存管,液氮中速冻1 d 后保存在-80℃冰箱。
1.3.4 TUNEL 实验检测大鼠海马中细胞凋亡情况
取1.3.3 中海马切片,按照TUNEL 试剂盒说明书,依次处理切片,最后用苏木精复染色,置于光学显微镜下观察。
1.3.5 试剂盒检测海马组织 MDA 水平和 SOD活性
取出1.3.3 中冷冻海马组织,加入磷酸缓冲液于冰上匀浆,离心收集上清液,按照MDA、SOD 试剂盒说明书依次加入工作液孵育后,分别于535 nm、450 nm 处检测各孔吸光值,对照标准曲线计算各样品中MDA 水平和SOD 活性。
1.3.6 免疫印迹法(Western blot)检测海马组织PI3K/Akt/Bax 通路蛋白表达情况
取出1.3.3 中冷冻海马组织,采用液氮研磨法粉碎,加入含蛋白酶抑制剂的蛋白裂解液,提取其中蛋白质。BCA 法测定蛋白浓度后,分别取20 μg蛋白与5×SDS 上样缓冲液混匀并煮沸,经SDS-聚丙烯酰胺凝胶电泳分离后,依次转膜、洗膜,5%质量分数脱脂牛奶封闭 1 h,加入 PI3K、Akt、Bax、p-Akt、Bad、caspase-3 及 β-actin 一抗(稀释倍数均为 1 ∶1000)孵育过夜,然后加入羊抗鼠IgG 二抗(1 ∶5000稀释)孵育2 h,洗膜后加入增强化学发光液,采用凝胶成像系统拍照并分析。
1.4 统计学方法
采用SPSS 25.0 进行统计学分析,计量数据均采用平均数±标准差(±s)表示,多组间比较行单因素方差分析,进一步两两比较采用SNK-q检验。P<0.05 差异有统计学意义。
2 结果
2.1 GYPs 对大鼠海马组织病理损伤的影响
Sham 组大鼠海马神经元可见正常的形态,具有完整细胞核、囊泡核等结构;SAE 组大鼠海马大部分核染色质皱缩成团块,细胞质凝缩,细胞碎裂,表现为弥漫性神经元损伤;GYPs 组大鼠海马神经元损伤明显减轻,形态趋于正常;GNE-317 组大鼠海马神经元损伤比SAE 组更严重;GYPs+GNE-317 组大鼠海马神经元总体形态同SAE 组相似,比GYPs 组严重。见图1。
2.2 GYPs 对大鼠一般情况及神经行为评分的影响
Sham 组大鼠毛色正常,饮食及活动等一般情况良好;SAE 组大鼠毛色无光泽,表现出嗜睡、自发活动缺乏、肢体协调降低等症状;GYPs 组大鼠毛色趋于正常,活动增加。相较于Sham 组,SAE 组大鼠神经行为评分降低(P<0.05);GNE-317 组大鼠一般情况比 SAE 组更差;GYPs+GNE-317 组同 SAE 组相近。相较于SAE 组,GYPs 组大鼠神经行为评分增高,GNE-317 组降低(P<0.05);相较于 GYPs 组,GYPs+GNE-317 组大鼠神经行为评分降低(P<0.05);相较于 GNE-317 组,GYPs+GNE-317 组大鼠神经行为评分增高(P<0.05)。见表1。
2.3 GYPs 对大鼠海马组织细胞凋亡的影响
Sham 组、SAE 组、GYPs 组、GNE-317 组、GYPs+GNE-317 组大鼠海马凋亡细胞比例依次为(8.12±0.59)%、 (29.87 ± 3.39)%、 (11.34 ± 2.76)%、(41.08±3.81)%、(27.61±3.54)%,相较于 Sham组,SAE 组大鼠凋亡细胞比例增高(P<0.05);相较于SAE 组,GYPs 组大鼠凋亡细胞比例降低,GNE-317 组增高(P<0.05);相较于 GYPs 组,GYPs+GNE-317 组大鼠凋亡细胞比例增高(P<0.05);相较于GNE-317 组,GYPs+GNE-317 组大鼠凋亡细胞比例降低(P<0.05)。见图2。
2.4 GYPs 对大鼠海马组织MDA 水平及SOD 活性的影响
相较于Sham 组,SAE 组大鼠MDA 水平增高、SOD活性减弱(P<0.05);相较于SAE 组,GYPs 组大鼠MDA水平降低、SOD 活性增强,GNE-317 组MDA 水平增高、SOD 活性减弱(P<0.05);相较于GYPs 组,GYPs+GNE-317 组大鼠 MDA 水平增高、SOD 活性减弱(P<0.05);相较于GNE-317 组,GYPs+GNE-317 组大鼠MDA 水平降低、SOD 活性增强(P<0.05)。见表2。
2.5 GYPs 对大鼠海马组织PI3K/Akt 通路蛋白表达的影响
相较于 Sham 组,SAE 组大鼠 PI3K 蛋白及 p-Akt 水平降低,cleaved-caspase-3、Bax、Bad 蛋白表达增高(P<0.05);相较于SAE 组,GYPs 组大鼠PI3K蛋白及 p-Akt 水平增高,GNE-317 组降低(P<0.05),cleaved-caspase-3、Bax、Bad 蛋白表达降低,GNE-317 组增高(P<0.05);相较于 GYPs 组,GYPs+GNE-317 组大鼠 PI3K 蛋白及 p-Akt 水平降低,cleaved-caspase-3、Bax、Bad 蛋白表达增高;相较于GNE-317 组,GYPs+GNE-317 组 PI3K 蛋白及 p-Akt水平增高,cleaved-caspase-3、Bax、Bad、蛋白表达降低(P<0.05)。见表3、图3。

注:图中黑色箭头所指为损伤神经元。图1 大鼠海马组织HE 染色Note.The black arrows indicate the damaged neurons.Figure 1 HE staining of rat’s hippocampus
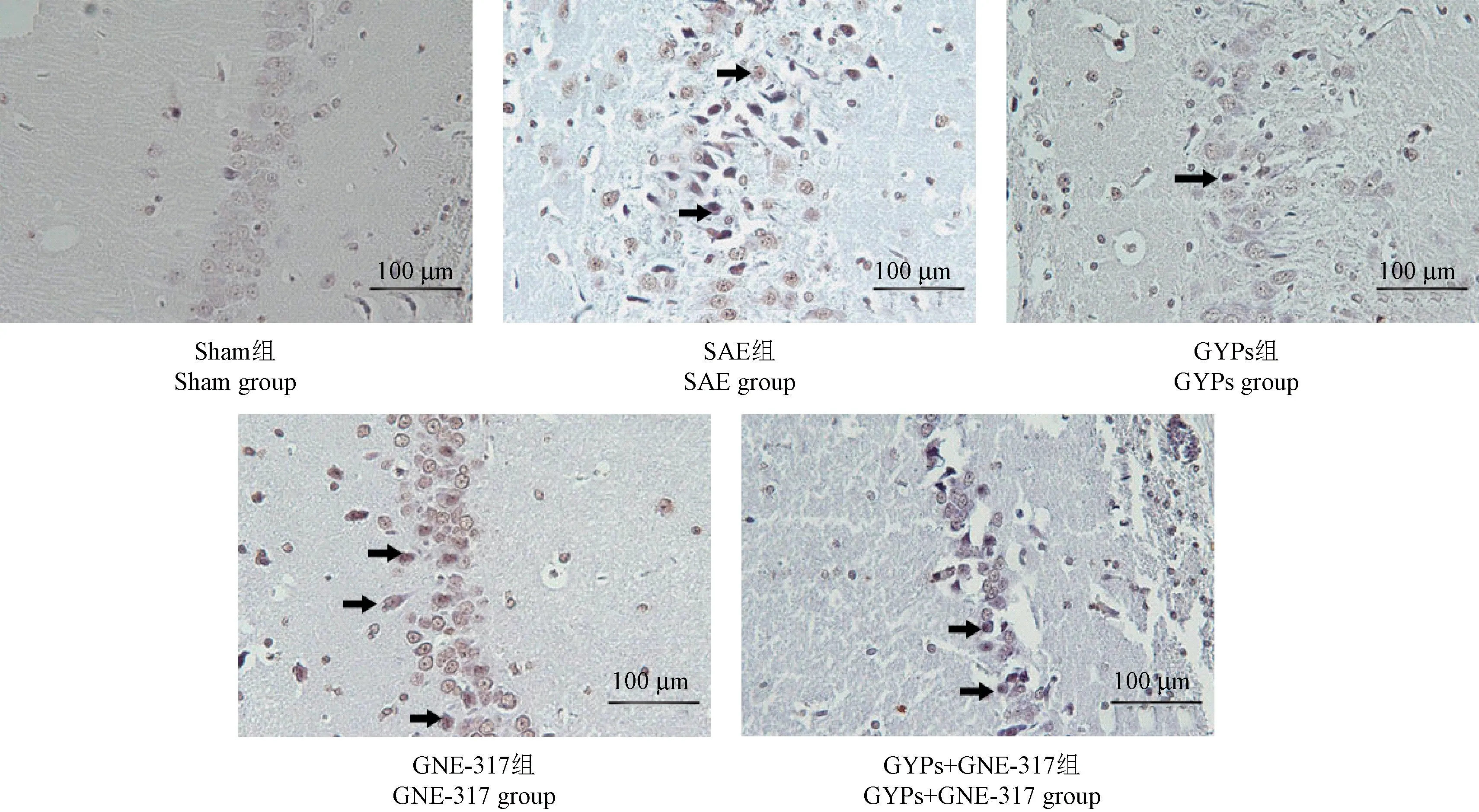
注:图中黑色箭头所指为TUNEL 阳性细胞即凋亡细胞。图2 大鼠海马组织TUNEL 染色Note.The black arrows indicate TUNEL positive apoptotic cells.Figure 2 TUNEL staining of rat’s hippocampus
表1 5 组大鼠神经行为评分比较( ±s,n=12)Table 1 Comparison of rat’s neurobehavior scores of 5 groups

表1 5 组大鼠神经行为评分比较( ±s,n=12)Table 1 Comparison of rat’s neurobehavior scores of 5 groups
注:与Sham 组比较,aP<0.05;与SAE 组比较,bP<0.05;与GYPs 组比较,cP<0.05;与GNE-317 组比较,dP<0.05。Note.Compared with Sham group, aP<0.05.Compared with SAE group, bP<0.05.Compared with GYPs group, cP<0.05.Compared with GNE-317 group, dP<0.05.
组别Groups神经行为评分(分)Neurobehavioral score (score)Sham 组Sham group 10.00±0.00 SAE 组SAE group 6.13±0.41a GYPs 组 GYPs group 8.36±0.55b GNE-317 组 GNE-317 group 4.71±0.23bc GYPs+GNE-317 组 GYPs+GNE-317 group 6.06±0.43cd
表2 5 组大鼠海马组织MDA 水平及SOD 活性比较( ±s,n=9)Table 2 Comparison of MDA level and SOD activity in rat’s hippocampus of 5 groups

表2 5 组大鼠海马组织MDA 水平及SOD 活性比较( ±s,n=9)Table 2 Comparison of MDA level and SOD activity in rat’s hippocampus of 5 groups
注:与Sham 组比较,aP<0.05;与SAE 组比较,bP<0.05;与GYPs 组比较,cP<0.05;与GNE-317 组比较,dP<0.05。Note.Compared with Sham group, aP<0.05.Compared with SAE group, bP<0.05.Compared with GYPs group, cP<0.05.Compared with GNE-317 group, dP<0.05.
组别Groups MDA(μmol/mg) SOD(U/mg)Sham 组 Sham group 4.42±0.91 103.05±8.64 SAE 组 SAE group 16.26±1.53a 81.24±7.25a GYPs 组 GYPs group 9.17±1.68b 196.63±9.57b GNE-317 组 GNE-317 group 27.04±9.52bc 72.32±5.06bc GYPs+GNE-317 组 GYPs+GNE-317 group 15.52±2.08cd 80.17±9.43cd
表3 5 组大鼠海马组织PI3K/Akt 通路蛋白表达比较( ±s,n=9)Table 3 Comparison of PI3K/Akt pathway protein expression in rat’s hippocampus of 5 groups

表3 5 组大鼠海马组织PI3K/Akt 通路蛋白表达比较( ±s,n=9)Table 3 Comparison of PI3K/Akt pathway protein expression in rat’s hippocampus of 5 groups
注:与Sham 组比较,aP<0.05;与SAE 组比较,bP<0.05;与GYPs 组比较,cP<0.05;与GNE-317 组比较,dP<0.05。Note.Compared with Sham group, aP<0.05.Compared with SAE group, bP<0.05.Compared with GYPs group, cP<0.05.Compared with GNE-317 group, dP<0.05.
组别Groups PI3K p-Akt/Akt cleaved-caspase-3/caspase-3 Bax Bad Sham 组 Sham group 0.98±0.05 0.83±0.03 0.09±0.01 0.21±0.02 0.36±0.03 SAE 组 SAE group 0.51±0.04a 0.47±0.02a 0.38±0.03a 0.49±0.03a 0.56±0.04a GYPs 组 GYPs group 0.65±0.05b 0.89±0.04b 0.07±0.01b 0.25±0.01b 0.18±0.02b GNE-317 组 GNE-317 group 0.32±0.04bc 0.22±0.01bc 0.87±0.03bc 0.59±0.02bc 1.21±0.05bc GYPs+GNE-317 组 GYPs+GNE-317 group 0.49±0.02cd 0.45±0.02cd 0.35±0.03cd 0.43±0.03cd 0.54±0.04cd

注:A:Sham 组;B:SAE 组;C:GYPs 组;D:GNE-317 组;E:GYPs+GNE-317 组。图3 大鼠海马组织PI3K/Akt 通路蛋白印记图Note.A, Sham group.B, SAE group.C, GYPs group.D, GNE-317 group.E, GYPs+GNE-317 group.Figure 3 Western blot of PI3K/Akt pathway-related protein in rat’s hippocampus
3 讨论
随着医学的进步,重症监护室中病人存活率逐年增高,然而脓毒症尤其是SAE 依然为导致死亡的重要因素,因此寻找可有效治疗SAE 的药物很有必要。本研究通过盲肠结扎穿孔术模拟脓毒症发生过程,结果发现SAE 组血压明显降低且脑电图异常,毛色无光泽,嗜睡,自发活动、肢体协调及神经行为评分降低,表明SAE 模型制备成功。脑病理学发现,SAE 可导致脑组织出现白质出血和血凝过多,微脓肿形成,桥脑中枢髓鞘溶解,代谢变化,缺血性变化和细胞凋亡等损伤[11]。另有研究发现,SAE 大鼠脑损伤与氧化损伤和细胞凋亡密切相关[12]。本研究结果显示,Sham 组大鼠海马神经元细胞核、囊泡核等完整,形态正常,SAE 组大鼠海马核染色质皱缩成团块,细胞碎裂,出现弥漫性神经元损伤,且相较于Sham 组,SAE 组海马中凋亡细胞比例及MDA 水平增高,SOD 活性减弱,表明SAE 大鼠海马组织处于高水平氧化应激状态,细胞结构异常,凋亡增加。据《中华本草》记载绞股蓝具有增强体液和细胞免疫、抗氧化、改善脂质代谢、保护中枢神经等作用,被广泛用作长期治疗多种疾病的安全有效天然草药,具有较高口服生物利用度且可穿越血脑屏障进入大脑发挥作用[13]。Keilhoff 等[14]在心肺复苏模型大鼠中研究发现,GYPs 可增强海马区神经元活力,激活呼吸链,保护心脏骤停引起的神经元死亡。本研究结果显示,给于 GYPs 后,GYPs 组大鼠海马神经元损伤明显减轻,形态趋于正常,凋亡细胞比例及MDA 水平降低,神经行为评分及SOD 活性增强,表明GYPs 可降低海马组织氧化应激水平,减少细胞凋亡,改善神经功能,减轻脑损伤。
PI3K 为p85 调节亚基和p110 催化亚基组成一种异聚蛋白质,可催化许多下游激酶(如Akt)磷酸化,活化后的Akt 可调节细胞增殖、细胞骨架组织、囊泡转运、细胞代谢、氧化应激等生物过程;还可抑制Bad、Bax 等促凋亡蛋白转录翻译,抑制凋亡。研究发现,病原物感染可导致脑部炎症反应,脑内PI3K 水平降低,影响PI3K/Akt 通路活性,进而影响脑内神经元等多种细胞的代谢和存活[15]。过往研究发现,脓毒症与PI3K/Akt 通路抑制、细胞凋亡及氧化应激增加有关[16-18]。本研究中,相较于Sham组,SAE 组大鼠海马中 PI3K 蛋白及 p-Akt 水平降低,cleaved-caspase-3、Bax、Bad 蛋白表达增高,进一步表明SAE 大鼠海马组织中PI3K/Akt 通路被抑制,且下游促凋亡因子水平升高。研究发现,神经珠蛋白可通过激活PI3K 蛋白,增加Akt 磷酸化,抑制Bax 蛋白释放,逆转脓毒症诱导的大鼠脑损伤[19]。Yin 等[20]亦发现,通过激活 AKT 信号通路,右美托咪定可抑制神经元损伤,保护SAE 大鼠神经功能。以上研究提示PI3K/Akt 通路可能为治疗SAE 的靶标。本研究中发现,给予GYPs 治疗后,大鼠海马组织中 PI3K 蛋白及 p-Akt 水平增高,cleaved-caspase-3、Bax、Bad 蛋白表达降低,推测GYPs 对SAE 大鼠脑损伤的改善作用与促进PI3K/Akt 通路激活,抑制促凋亡因子释放有关。进一步研究显示,相较于GPYs 组,GYPs+GNE-317 组大鼠海马组织损伤严重,神经行为评分、SOD 活性、PI3K蛋白及p-Akt 水平降低,凋亡细胞比例、MDA 水平cleaved-caspase-3、Bax、Bad 蛋白表达增高,表明PI3K 抑制剂 GNE-317 可阻滞 GYPs 对 PI3K/Akt 通路的激活作用,抵抗其对SAE 大鼠的保护作用。
综上所述,GYPs 可促进海马PI3K/Akt 通路活化,抑制下游促凋亡因子释放,降低氧化应激,改善SAE 大鼠脑损伤,另外GYPs 副作用少,可能应用于临床治疗SAE。然而SAE 进展迅速,机制复杂,过程中涉及多种通路,GYPs 对SAE 的治疗作用可能涉及其他机制,值得进一步探讨。

