鹅源星状病毒TaqMan 荧光定量PCR 检测方法的建立及初步应用
苏世博蒲路莎陈肖韩赵丽丽陈洪岩
(中国农业科学院哈尔滨兽医研究所/兽医生物技术国家重点实验室/黑龙江省实验动物与比较医学重点实验室/国家禽类实验动物资源库,哈尔滨 150069)
禽类星状病毒(avian astroviruses,AAstVs)属于星状病毒科(astroviridae,AstV),其基因组长度介于7 kb到8 kb 之间,该病毒为单股正链RNA 病毒,无囊膜结构,粒子直径为28 ~30 nm,呈二十面体星状结构[1]。禽星状病毒多发于养殖禽和少数鸟类,如火鸡(TAstV)、鸭子(DAstV)、鸡(CAstV)、珍珠鸡(GFAstV)、鸽子(PiAstV)以及少数野生水生和陆栖鸟类[2]。据报道,通常情况下感染星状病毒的禽类主要表现为病毒性胃肠炎、肝炎以及间质性肾炎[3-5]。然而自2017 年来,中国多个省份的鹅场都发现并报道了一种以致命的内脏和关节痛风为主要临床特征的水禽传染性疾病,该病多发于雏鹅,且具有高度致死性,死亡率为30%~50%[6]。病死雏鹅剖检通常表现心、肝等主要脏器的痛风症状,其表面附着大量白色尿酸盐颗粒,肾及肠系膜充血肿胀,严重者全身肌肉关节处均表现痛风。该病给禽养殖业带来严重经济损失[7]。经过病原学检测,研究者们从各个地区临床样本中相继分离并鉴定出一种与已报道的禽星状病毒遗传学差异较大的新型星状病毒[8-12],并命名为鹅源星状病毒(gooseorigin astrovirus,GoAstV)。与其他种属星状病毒基因组结构类似,鹅源星状病毒基因组包含三个主要的开放阅读框架(ORF1a、ORF1b 和ORF2),以及一个短的 5’非编码区(UTR)、一个 3’UTR 和一个PolyA 尾巴[13-14]。ORF1 编码非结构蛋白,在病毒复制中发挥作用,且较编码病毒粒子衣壳蛋白(Cap)的 ORF2 序列更为保守。自 2018 年以来,黑龙江省[15]也出现了该病的大规模流行,其发病率高达80%,死亡率高达50%,这表明这种新型病毒正在向中国东北地区迅速传播。经鉴定和测序分析发现该病毒与已报道的鹅源星状病毒同源性高度相近,均不低于96.0%,遗传进化分析表明它们属于同一分支。但与其他禽类星状病毒具有较明显差异,其全基因组同源性仅为44.7%~60.5%。
早期,研究者仅能使用电子显微镜进行禽类星状病毒的诊断[16],不利于大规模的临床检验。由于该新型星状病毒缺乏体外培养细胞系,且无血凝作用,使血清学检测方法相对较少。普通RT-PCR 方法成为快速检测该病毒的主要方式之一,但该方法敏感性低,无法对病毒定量分析,因此建立荧光定量PCR 方法十分必要。目前有研究者建立了SYBR Green Ⅰ实时荧光定量PCR 方法[17],并探究了该病毒的组织嗜性。但相比于该方法,TaqMan 探针荧光定量在对目的基因进行绝对定量方面优势明显[18],于是本实验以前期分离到的GoAstV HLJ01 株为毒种,利用参考毒株序列进行比对,并选取ORF1a 中的保守片段设计并合成特异性引物及探针,通过对反应条件的优化,建立标准曲线,并进行一系列的灵敏性、重复性及特异性实验,最终建立一种更加高效特异的TaqMan 探针荧光定量PCR 方法,该方法将对GoAstV 的早期检测及后期流行病学调查提供技术支撑,对该疾病的治疗和预防更具指导意义。
1 材料和方法
1.1 实验材料
GoAstV HLJ01 株(GenBank 登录号:MN175321.1)为本实验室2018 年从黑龙江省大庆市某鹅场病死雏鹅肝、肾组织分离获得。新城疫病毒(NDV)、禽流感病毒(AIV) H1、H5、H9 的 HI 试验标准抗原购自哈尔滨维科生物技术有限公司。鸭坦布苏病毒(DTMUV)、鸭肠炎病毒(DEV)、鹅细小病毒(GPV)、鸭肝炎病毒 1 型和 3 型(DHV-1、DHV-3)等由本实验室保存。临床样品采自黑龙江省部分地区疑似发病的鹅养殖场5 月龄霍尔多巴吉鹅,共50份肛拭子。
1.2 主要试剂与仪器
TIANamp Virus RNA Kit 购于天根生化科技有限公司;Plasmid Mini Kit、Gel Extraction Kit 均购自美国 OMEGA BioTek 公司;2×Taq PCR StarMix 购自GenStar 公司; T4 DNA 连接酶、pMD19-T 载体均购自于宝生物工程(大连)有限公司;DH5α 感受态细胞、TransStart Probe qPCR SuperMix、2,000 bp DNA Marker 购自北京全式金有限公司;组织研磨仪购自德国 QIAGEN 公司; 三槽 模块 PCR 仪购 自SensoQuest 公司;Bio-Rad IQ5 荧光定量 PCR 系统购自于美国伯乐公司;凝胶成像分析系统购自美国Alpha technoch 公司;电泳仪购自北京六一仪器厂;超微量紫外分光光度计购自于德国IMPLEN 公司。
1.3 实验方法
1.3.1 引物的设计和合成
从GenBank 中下载 GoAstV 参考序列,使用DNA STAR 软件进行序列比对分析,并用Primer 5软件对ORF1a 阅读框中的保守区域设计一对扩增产物大小在400 bp 标准品引物(AstV-F-1050/AstVR-1428),利用其扩增产物制备标准品,在标准品序列中再选取一段长度为107 bp 的保守片段,设计荧光定量PCR 引物(PPF/PPR),同时设计一条5’端荧光基团为FAM,3’端淬灭基团为TAMRA 的特异性探针(Probe)。上述两对引物及一条探针均由吉林库美生物科技有限公司合成(表1)。
1.3.2 质粒标准品的制备
按照病毒RNA 提取试剂盒的说明书提取GoAstV HLJ01 株病毒RNA,并依照反转录试剂盒的说明以病毒RNA 为模板依次进行基因组DNA 的清除和病毒cDNA 的合成。以得到的cDNA 为模板,利用引物AstV-F-1050/AstV-R-1428 对标准品目的片段进行 RT-PCR 扩增。反应体系:2×Taq PCR StarMix 10 μL,上游引物(10 μmol/L)1 μL,下游引物(10 μmol/L)1 μL,cDNA 模板 1 μL,ddH2O 补充至 20 μL;反应条件:94℃ 5min;94℃ 30 s,56℃ 30 s,72℃40 s,34 cycles;72℃ 10 min;12℃终止。将 PCR 产物核酸胶电泳后在紫外凝胶成像系统下切取目的片段进行回收纯化,并按照pMD-19T 连接体系连接克隆载体后转化至大肠杆菌DH5α 感受态细胞,挑取单菌落于LB 培养基中过夜培养,经菌液PCR 鉴定正确后提取阳性质粒送测序,将测序结果与理论相符的阳性质粒命名为pMD-19T-G,-80℃保存备用。测定pMD-19T-G 浓度,并进行10 倍的倍比稀释,将其作为TaqMan 荧光定量PCR 方法的标准品。
1.3.3 荧光定量PCR 反应条件的优化
首先分别将引物(PPF/PPR)和探针稀释至10 μmol/L,以总反应体系 20 μL、模板量 1μL、探针量0.4μL 为基础,进行 TaqMan 荧光定量 PCR 反应,根据CT 值及曲线状况摸索上下游引物的加样量[19]。再以此浓度的上下游引物为标准,控制模板量不变,分别加入 0.2 μL、0.4 μL、0.8 μL 的探针摸索最佳的工作浓度[19]。
1.3.4 荧光定量PCR 标准曲线的建立
将标准品pMD-19T-G 进行10 倍梯度稀释得到8 个稀释度的质粒标准品(每微升1.50×102~1.50×109拷贝)作为模板,每个模板均做3 个重复,在优化得到的反应条件进行荧光动力学扩增,根据扩增曲线确定阈值并利用CT 值及模板起始拷贝数的对数之间的线性关系制作标准曲线并得出标准方程[19],同时以无菌水为模板设置阴性对照。
1.3.5 特异性实验
为验证该方法的特异性,提取GoAstV HLJ01 株、NDV、(AIV) H1、H5、H9、DTMUV、DHV-1 和 DHV-3的病毒基因组RNA,反转录合成cDNA;用病毒DNA试剂盒提取 GPV、DEV 和 MDPV 的基因组 DNA。利用上述建立的方法对提取的各种水禽病毒进行荧光定量PCR 反应,以无菌水为模板作空白对照。
1.3.6 敏感性实验
鉴定该方法的灵敏度,使用DEPC 水10 倍梯度稀释标准品质粒得到每微升1.50×109~1.50×102拷贝的质粒模板并进行敏感性检测,采用无菌水作为模板作空白对照。检测方法的灵敏度为以CT<35 且出现标准的S 型扩增曲线的最低浓度[20]。
1.3.7 重复性实验
选取3 个稀释度质粒标准品(10-2、10-4、10-6)进行检测,并分别进行三次重复实验;使用相同模板样品在3 个不一致的时间点来进行批间重复性实验。据以上两批实验得到的CT 值计算各自批内和批间的变异系数,以此来判定该方法的可靠性[21]。
1.3.8 临床样品检测
使用普通RT-PCR 方法与本研究建立的探针法定量检测样品方法分别对从黑龙江部分地区发病鹅场采集的50 份疑似发病雏鹅的肛拭子进行检测,利用检测结果计算其符合率并判断新方法的优越性。
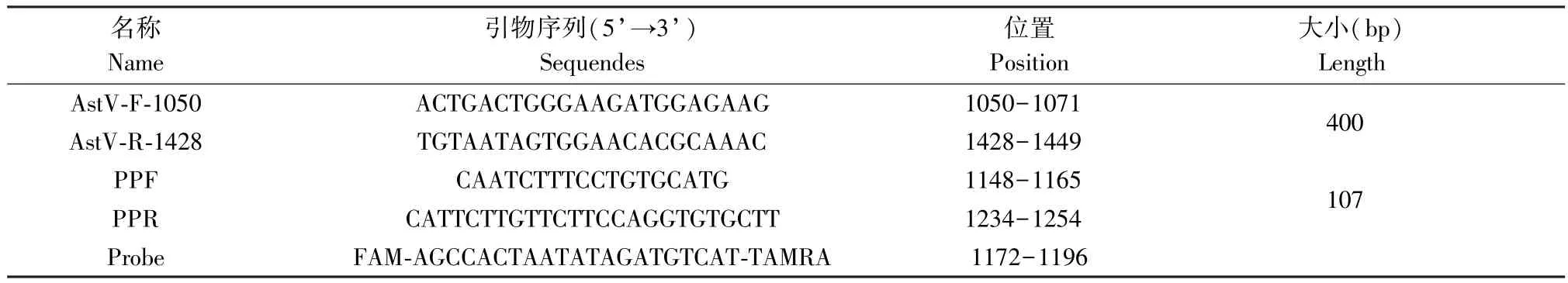
表1 荧光定量PCR 相关引物Table 1 The primers used for the fluorogrnic quantitative PCR
2 结果
2.1 质粒标准品的构建
利用 AstV-F-1050、AstV-R-1428 引物对 HLJ01株进行常规RT-PCR 反应,获长度400 bp 的单一条带(图1)。产物经胶回收纯化后克隆、测序,结果与预期完全一致,将构建成功的阳性质粒命名为pMD-19T-G,-80℃保存备用。使用分光光度计测定质粒标准品 OD 值为:50.8 ng/μL。据公式得出 pMD-19T-G 标准品的拷贝数为每微升1.50×1010拷贝。
2.2 荧光定量PCR 反应条件的优化
经过多次试验摸索后得到荧光定量PCR 最佳反应体系:2×Probe qPCR SuperMix 10 μL、探针(10μmol/L) 0.4 μL、上游引物(10μmol/L) 0.4 μL、下游引物(10μmol/L)0.4 μL、模板 1 μL、Nucleasefree Water 7.8 μL,总体系 20μL。反应条件为:94℃30 s;94℃ 5 s,60℃ 30 s,45 个循环;4℃终止反应。
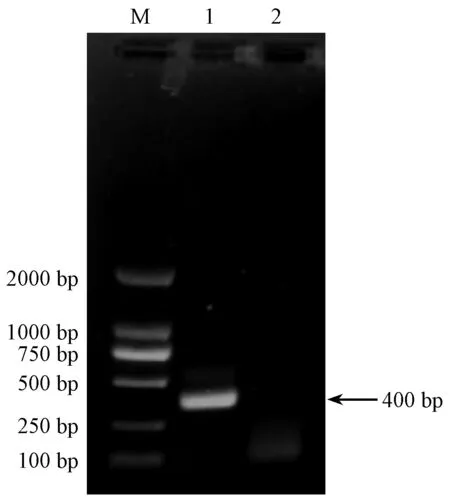
注:M:DL2000 DNA Marker;1:目的基因; 2:阴性对照。图1 目的片段PCR 结果Note.M,DL 2000 marker;Line 1,Objective fragments;Line 2,Negative control.Figure 1 Amplification products of the PCR test
2.3 标准曲线的建立
以稀释好的8 个浓度梯度(1.5×102至1.5×109copies/μL)的质粒标准品作为模板,且每个梯度做4个重复进行荧光定量PCR 反应。分析扩增结果,分别以质粒模板量的对数值作为制作标准曲线的横坐标,以荧光信号达到阈值时的循环数(CT)为纵坐标,绘制标准曲线,曲线方程为:Y=-3.179x+42.066。如图2 所示每个浓度梯度的样本均准确位于曲线上,体现了良好的线性关系,且相关系数(R2)为0.999,重复性良好。
2.4 特异性实验结果
对 GoAstV、NDV、(AIV)H1、H5、H9、DHV-1、DHV-3、DTMUV、GPV、DEV、MDPV 进行荧光动力学扩增,结果只有GoAstV 检测出阳性,其他供试病原均为阴性(图3)。结果表明该方法具有良好的特异性。
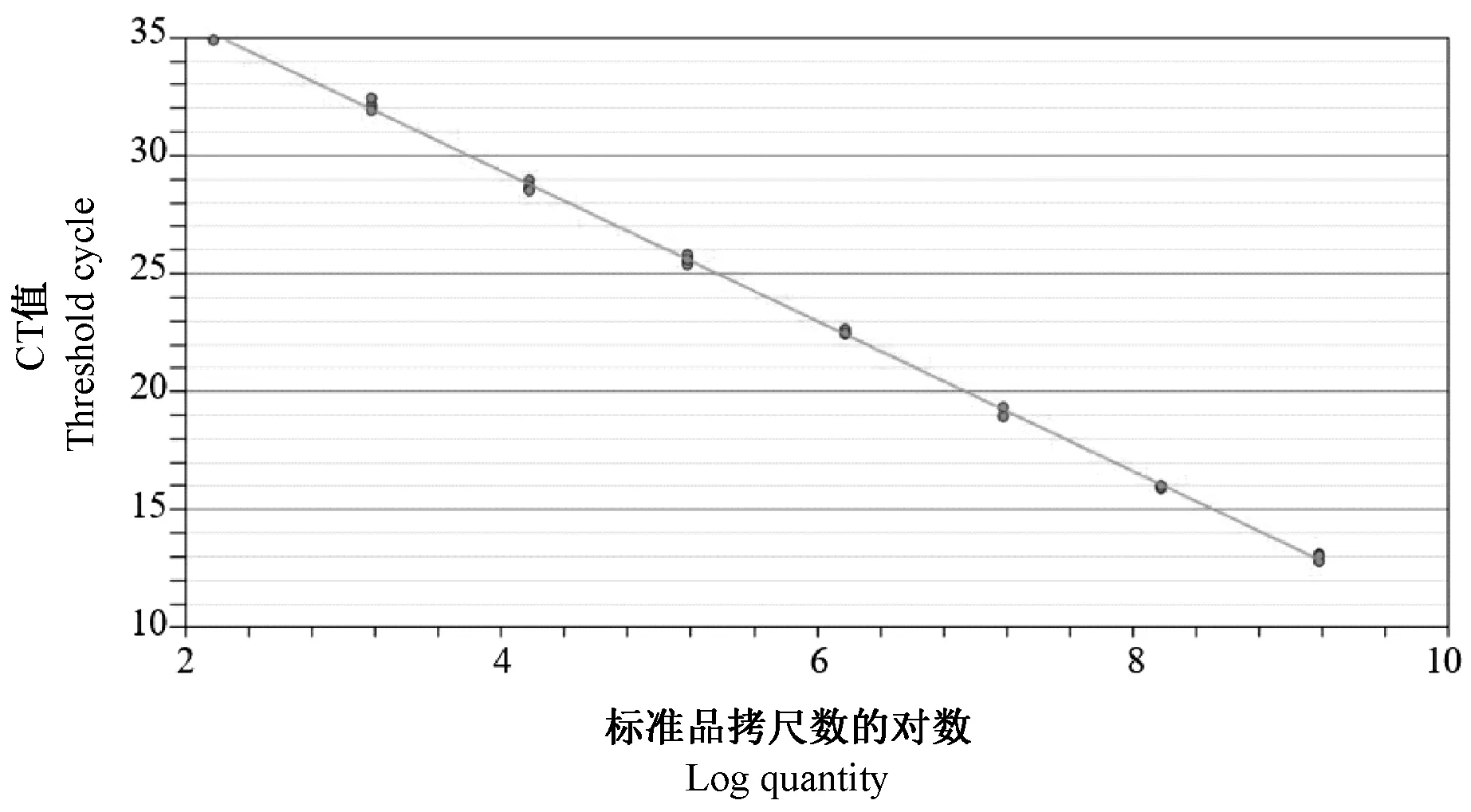
图2 GoAstV 荧光定量PCR 标准曲线Figure 2 The standard curve of GoAstV Real-time PCR
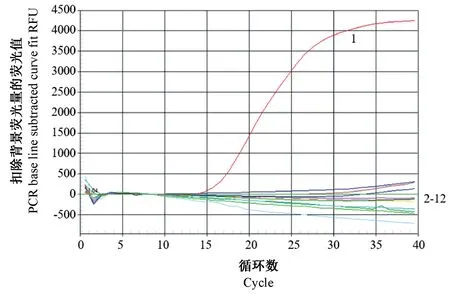
注:1:GoAstV;2-11: NDV、H9、H1、H5、DHV-1、DHV-3、DTMUV、MDPV、GPV、DEV;12:阴性对照。图3 TaqMan 荧光定量PCR 特异性实验结果Note.1, GoAstV.2-11, NDV/H9/H1/H5/DHV-1/DHV-3/DTMUV/MDPV/GPV/DEV.12, Negative control.Figure 3 Results of specific test of TaqMan real-time PCR
2.5 敏感性实验结果
对于敏感性实验,将构建的标准质粒进行10 倍梯度稀释(每微升1.50×109拷贝至1.50×102拷贝)用作荧光动力学检测的模板,并以CT<35 的情况下呈现标准扩增曲线作为判定该方法的灵敏度的依据。如图4 所示,该方法的检出限低至每微升1.5×102拷贝。
2.6 重复性实验结果
选取3 个稀释度的标准质粒样品(1.50×104copies /μL、1.50×106copies /μL、1.50×108copies /μL)分别进行批内和批间的重复性实验。根据反应结果中CT 值分别计算平均值、标准差及变异系数。结果如表2 可知批内实验变异系数小于0.5%,批间试验变异系数均小于4%,证明该方法的重复性良好且具有较高的可靠性。
2.7 临床样品的检测结果
本实验以常规RT-PCR,TaqMan 荧光定量PCR两种方法对该50 份疑似发病雏鹅的肛拭子进行检测,分析结果使用荧光定量PCR 检出所有样品均为GoAstV 阳性(50/50),而 RT-PCR 方法的 GoAstV 阳性率为84%(42/50),两者阳性符合率和吻合度达84%,再次证明该方法较RT-PCR 方法灵敏度更高。
3 讨论
GoAstV 由我国科学家于2017 年首次报道,此后该病毒引发的雏鹅内脏痛风病在我国东部省份广泛流行,是近几年严重危害养鹅业的重要疾病。目前常用RT-PCR 检测。然而,该方法灵敏度不高且需要凝胶电泳,不适合大量临床样本的快速检测。此外RT-PCR 检测只能做定性分析,不能准确定量。随着分子生物学检测技术的发展,SYBR Green I 实时荧光定量PCR 方法和TaqMan 探针荧光定量PCR 方法相继出现。近年来,先后有研究者选取GoAstV ORF1b 的RdRp 基因构建了GoAstV 荧光定量PCR 检测方法[17,22-23],临床应用证实,其方法能快速、有效地检测GoAstV,但SYBR Green I 荧光定量PCR 方法只能做到相对定量,TaqMan 探针法则可以做到病毒载量的绝对定量,且TaqMan 探针在引物特异的基础上再次提高了检测的特异性[24]。
本实验室在此基础上也建立了针对GoAstV ORF1a 基因保守区域的GoAstV 高灵敏度强特异性的TaqMan 探针荧光定量PCR 检测平台,并将该方法初步应用于临床样品。首先通过对反应条件的优化,最终确立了该方法的最佳反应条件。其次,构建相应的标准质粒,并以梯度稀释的质粒标准品为模板进行绝对定量扩增反应,结合CT 值和初始模板量成功绘制横纵坐标相关性良好的标准曲线。以此为基础进行一系列实验验证该方法的特异性、灵敏性和稳定性。特异性实验结果显示,除GoAstV出现标准的S 型扩增曲线外,其他水禽病毒均未发现明显信号的特异性扩增。敏感性试验结果显示,CT 值与标准质粒在每微升1.50×109拷贝至1.50×102拷贝之间呈良好的线性关系,102copies/μL 为荧光定量PCR 检测方法的最小检测模板浓度为。此方法批内及批间实验结果重复性均比较好,其中批内试验变异系数小于0.5%,较前人建立的SYBR Green Ⅰ实时荧光定量 PCR 方法稳定性更高。本方法为GoAstV 检测提供了更多的选择,为后期病毒在宿主体内定植规律的研究和流行病学调查研究提供了技术支撑。
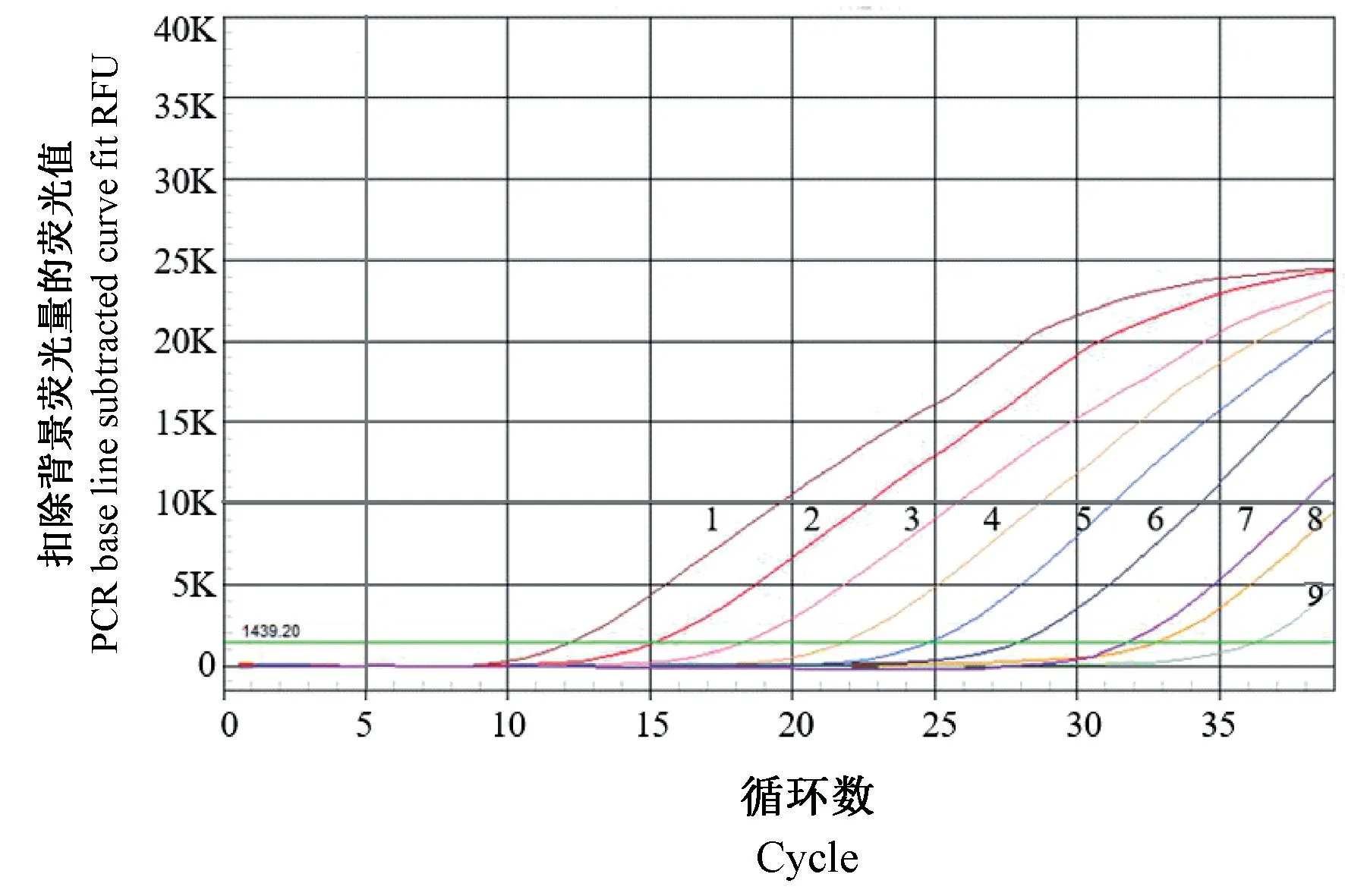
注:1-8:每微升1.50×109拷贝至1.50×102 拷贝;9:阴性对照。图4 荧光定量PCR 敏感性实验Note.1-8, 1.50×109 copies/μL to 1.50×102 copies/μL.9, Negative control.Figure 4 Sensitive test of fluorescence quantitative PCR
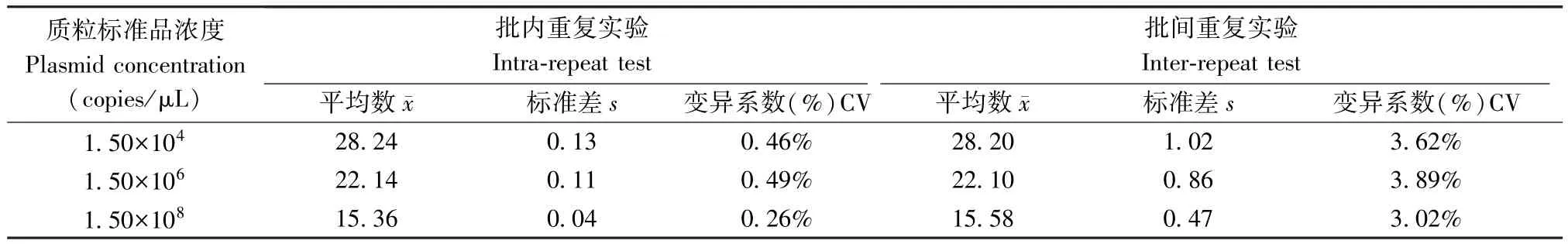
表2 批内和批间重复性实验结果Table 2 Test results of intra-group and inter-group repeatability

