灵芝三萜酸经Pnpla3 基因的降脂效果体外试验
——基于长爪沙鼠肝原代细胞的脂变模型
刘月环么春艳吴旧生
(1.杭州医学院(浙江省医学科学院),杭州 310013; 2.浙江大学,杭州 310058)
Pnpla3 ( patatin-like phospholipase domaincontaining 3,patatin 样磷脂酶域蛋白3,又叫做甘油酯O-酰基转移酶,即脂肪滋养蛋白adiponectin),能够通过将溶血磷脂酸转化磷脂酸促进细胞脂质合成,同时具有水解脂肪酶和转移酰基酶的活性[1]。Pnpla3 在代谢相关组织(如脂肪、肾上腺和肝)中高表达,且低纤维高碳水化合物饮食很容易引起其表达的下调。Pnpla3 基因在人群中具有多态性,这个多态性可能引起肝脂肪沉着和炎症[2]。然而目前对于Pnpla3 基因多态性影响非酒精性脂肪肝病(NAFLD)发病与脂代谢的具体分子机制还不清楚,有些研究结果还互相矛盾,如通过RNAi 机制沉默Pnpla3 基因以及在小鼠中敲除Pnpla3 并没有影响甘油三酯的水解,也未能获得脂肪肝表型[3]。将Pnpla3(I148 M)通过腺病毒载体或GalNAc(三价N-乙酰半乳糖胺)-siRNA 感染小鼠肝,能影响甘油三酯的降解水平并增加肝中脂肪的积累[4-5]。目前认为小鼠缺失野生型Pnpla3 基因并不会引起脂肪肝,而敲入人的148 M 等位基因小鼠会出现肝脂肪堆积[6-7],这提示Pnpla3 基因及其多态性在NAFLD 中的作用机制比人们想象的要复杂,其作用靶器官和生理机制也不完全清楚,因此为配合Pnpla3 基因功能的研究,可以考虑扩大模型的范围和种类。
笔者通过多年的研究发现,长爪沙鼠活体模型与人类NAFLD 特征相似(病理谱包括了单纯脂肪肝,脂肪性肝炎,肝纤维化,肝硬化四个阶段),具有病程持续进展的可控性且成模时间短等优势[8],从而为NAFLD 的研究增添了一个选择。目前该动物模型已形成了一套固定的造模方法,然而由于NAFLD 领域的快速发展、相关药物筛选又对体外模型产生了迫切的需要,为此我们在前期分离培养长爪沙鼠肝实质细胞的基础上[9],用棕榈酸(PA)诱导原代肝细胞形成肝脂变模型(对应于活体的脂肪肝阶段),并用其对自行分离制备的化合物灵芝三萜酸(GLTA)的降脂效果进行了观察。
1 材料和方法
1.1 实验动物
清洁级3 月龄雄性长爪沙鼠3 只,体重 50 ~70 g,购自浙江省实验动物中心[SCXK(浙)2019-0002],动物饲养于浙江省实验动物中心(杭州医学院实验动物中心)[SYXK(浙)2019-0011],经本单位实验动物伦理委员会批准同意(2018-094),并满足动物实验中的3R 要求),用于分离培养肝实质细胞。
1.2 主要试剂与仪器
阳性药物蛋氨酸的工作浓度为1 mg/mL(7 μmol/L),自行制备的灵芝三萜酸 GLTA(专利ZL201510933865.8),三个剂量的工作浓度分别是0.01 μmol/L,0.1 μmol/L,1 μmol/L。DMEM 培养基(Hyclone,货号SH30243.01);胎牛血清(四季青,11011 - 8611); Trypsin 0.25% ( 1 ×) Solution( Hyclone, SH30042.01 )、 Lipofectamine2000(invitrogen,货号 11668-027)、SYBR Green qPCR 试剂盒(康为世纪,货号CW2601);逆转录试剂盒(康为世纪,货号 CW2569);GAPDH 及 Western blot 相关二抗(华安生物,60004-1-1 g);Pnpla3 抗体(affinity,货号 DF2942)。
1.3 实验方法
1.3.1 两步灌流法分离培养沙鼠肝原代实质细胞
长爪沙鼠经CO2麻醉、消毒后固定于操作台,打开腹腔,暴露门静脉。用眼科镊轻轻剥离门静脉周围系膜,在游离的门静脉处插入静脉留置针,用动脉夹固定。剪开下腔静脉,先用无钙灌流液开放灌流至肝呈土黄色,再用含钙的0.025%胶原酶液灌流至肝柔软塌陷、压之留痕。分离肝,用含5%新生牛血清的DMEM 培养液终止消化反应,用眼科镊和眼科剪轻柔撕开肝被膜、抖落肝细胞。之后分别用100 目、200 目钢筛过滤,收集肝细胞滤液,室温静置15 min 后弃上清,加入含5%新生牛血清的HBSS 洗涤肝,反复离心洗涤4 次备用。
1.3.2Pnpla3 siRNA 筛选
(1)Pnpla3 siRNA 载体设计、合成
siRNA 干扰的基因参考序列为 Gene ID:110545027,主要针对三个外显子进行干扰RNA 引物设计,从三个载体中筛选出一个干扰效率高的载体作为后续实验用siRNA。实验操作时分为空白组、siRNA 对照组、siRNA 1 组、siRNA 2 组、siRNA 3组,结果判断以相对于对照组来说,PA 造模24 h 脂滴含量最少,Pnpla3 表达量最低(mRNA 表达水平显著降低(P<0.05 或P<0.01),干扰效率高于70%)为准。引物设计及合成由上海吉玛公司完成,序列如下,详见表1。
(2)siRNA 转染沙鼠肝细胞
取生长状态良好的长爪沙鼠肝原代实质细胞,以 5×105/孔接种到 12 孔板中,37℃、5% CO2细胞培养箱24 h→每一管siRNA 中加入125 μL DEPC水配置成20 μmol/L→用50 μL 无血清培养基稀释siRNA 为 100 nmol/L 混匀;用 50 μL 无血清培养基稀释1 μL 转染试剂Lipofectamine 2000 脂质体混匀后室温下静置50 min→混合转染试剂和siRNA 稀释液,混匀后室温下静置20 min→转染复合物加入12 孔板中,前后轻摇细胞板混合均匀→转染后,培养4~6 h 后更换新鲜培养基→继续培养至18~48 h后,收取各组的细胞沉淀。在检测出最佳Pnpla3 最佳干扰siRNA 后,以48 h 为最大转染时间,每样三个重复。
(3)QPCR
取培养细胞1000 r/min 离心5 min 弃上清收集管底细胞抽提RNA 后立即进入反转录阶段,反转录反应总体积为 20 μL,包括 4 μL 的 dNTP Mix(2.5 mmol/L Each),引物混合物2 μL,5×RT Buffer 4 μL,DTT(0.1 mol/L)2 μL,HiFiScript(200 U/ μL)1 μL,RNA 模板 1 μL,双蒸水(RNase Free)6 μL。反应条件:42℃,15 min;85℃,5 min。反应结束后产物作为cDNA 模板进入 QPCR 阶段。qRT-PCR 所用引物序列(Gene ID: 110545027)信息如表2。
实时荧光定量PCR 反应总体积20 μL,其中包括 2×UltraSYBR Mixture (Low ROX) 10 μL,PCR Forward Primer (10 μmol/L) 1 μL, PCR Reverse Primer(10 μmol/L) 1 μL,cDNA 模板 2 μL,双蒸水(RNase Free)6 μL。用漩涡振荡器将管中溶液彻底混合均匀,短暂低速离心。反应条件:95℃,10 min变性;95℃,15 s;60℃,60 s;40 个循环,每样三个重复。反应结束后收集数据计算转录水平的表达量(2-ΔΔCt方法)。
(4)Western blot
收集细胞1000 r/min 离心5 min 弃上清→600 μL 的RIPA 裂解液(含PMSF 和蛋白酶抑制剂)冰上匀浆裂解30 min→离心管12000 r/min 4℃离心5 min→取上清测浓度并标准化→ Loading buffer(β-巯基乙醇=50 ∶3)(体积比为 Loading buffer:样品=1∶4),沸水煮 5 min 变性→室温冷却-20℃→SDSPAGE 电泳(浓缩胶5%,分离胶10%)后转 PVDF膜,经过封闭→TBST 洗3 次→一抗过夜→TBST 洗3 次→二抗→TBST 洗3 次→ECL 法显影定影→拍照分析。
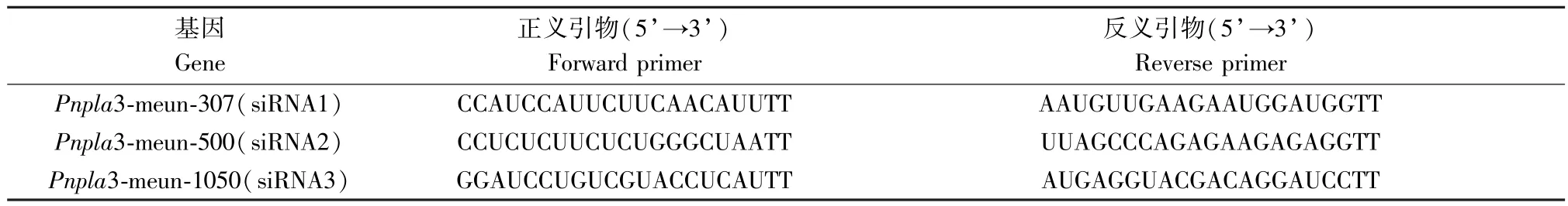
表1 Pnpla3 siRNA 的引物序列Table 1 Primer sequence of Pnpla3 siRNA

表2 Pnpla3 基因引物序列Table 2 Primers sequence of Pnpla3 gene
1.3.3 棕榈酸PA 诱导的长爪沙鼠肝脂变模型的建立
使用自行配制的PA,母液为10 mmol/L,取对数生长期沙鼠肝细胞接种于6 孔板中,每孔共3×105个细胞,每孔2 mL 培养基含PA 的终浓度梯度设定为 100 μmol/L、200 μmol/L、400 μmol/L、800 μmol/L,每个浓度3 个重复。时间到后弃去培养基,用PBS 轻柔清洗1 次,4%多聚甲醛固定15 min;吸弃多聚甲醛,PBS 清洗1 次,60%异丙醇润洗3 min,PBS 清洗1 次,加入油红O 工作液染色过夜,用蒸馏水洗2 次,风干后光学显微镜观察拍照,诱导分为12 h,24 h 两个时间点,产生的脂滴较多且细胞形态正常者为最佳的造模浓度。
1.3.4 灵芝三萜酸(GLTA)对敲减(干扰)Pnpla3后的肝细胞内TG 的影响
将细胞接种入12 孔板,分为十组,分别是A:空白对照组;B:肝细胞+PA 组;C:肝细胞+PA+siRNA组;D:肝细胞+PA+药物低剂量组;E:肝细胞+PA+药物低剂量组+siRNA 组;F:肝细胞+PA+药物中剂量组;G:肝细胞+PA+药物中剂量组+siRNA 组;H:肝细胞+PA+药物高剂量组;I:肝细胞+PA+药物高剂量组+siRNA 组;J:肝细胞+PA+阳性药物蛋氨酸组,每组三个重复。将细胞悬液过滤,3500 r/min 离心15 min,取上清液,-20℃保存,48 h 内采用全自动生化分析仪测定细胞上清液的TG 含量。
1.4 统计学方法
采用SPSS 16.0 统计软件进行数据分析,所有数据以平均数±标准差(±s)表示,P<0.05 为差异有统计学意义。组间两两比较,方差齐性者采用两独立样本t检验,方差不齐者采用Kruskal-WallisH检验,同时用Graphpad prism5.0 软件进行统计学分析校验及作图。
2 结果
2.1 siRNA 筛选的结果
2.1.1 PA 浓度的筛选
因肝实质细胞体外培养时具有有限的旺盛期,综合考虑Pnpla3 基因干扰的时间和药物作用时间,造模时间为PA 诱导后12~24 h,随着PA 给药浓度的增加及造模时间延长,沙鼠肝细胞内可见脂质沉积增多,细胞轮廓变圆,细胞间结合紧密度下降,结果见图1。因此选所以选择诱导24 h 内,细胞脂滴增加的较多且大多数细胞形状正常的PA 200 μmol/L,PA 400 μmol/L 均为合适的工作浓度。
2.1.2Pnpla3 siRNA 干扰对沙鼠肝细胞脂肪沉积的影响
siRNA 干扰Pnpla3 基因48 h 后,对长爪沙鼠肝实质细胞进行油红染色和形态学观察,结果见图2,对照组细胞内可见较多脂质沉积,以小脂滴沉积为主,PA 浓度定为400 μmol/L 为干扰后造模的合适工作浓度,并以此浓度造模,每组重复3 孔,进行药物效果试验。
2.1.3 干扰Pnpla3 基因后qPCR 结果
由图3 可以看出,三组干扰载体转染后Pnpla3基因表达量的QPCR 的结果表明,与空白组相比,siRNA2 组表达量最低(P<0.01),其次是siRNA3组(P<0.05),siRNA1 没有差异(P>0.05)因此,siRNA2 组为最佳干扰载体。
2.1.4 干扰Pnpla3 基因后Western blot 结果
根据图3 和图4 可得,与空白组相比,siRNA 对照组沙鼠肝细胞Pnpla3 蛋白表达水平和mRNA 表达水平无显著变化(P>0.05),Pnpla3 siRNA 转染后,与siRNA 对照组比较,各组沙鼠肝细胞Pnpla3 蛋白表达水平均显著降低(P<0.05 或P<0.01),siRNA2 组和siRNA3 组mRNA 表达水平显著降低(P<0.05 或P<0.01),其中siRNA2 组敲减效果最好,干扰效率高于70%,因此选取siRNA2 组进行实验。

注:造模后肝实质细胞的生长形态列于 A~E。A:对照组;B~E:加入 100 μmol/L,200 μmol/L,400 μmol/L 和 800 μmol/L PA 后的细胞形态。图1 PA 造模浓度的筛选Note.Growth status of hepatocyte after modeling are listed in A~E.A, Control group.B~E,100 μmol/L,200 μmol/L,400 μmol/L and 800 μmol/L PA, respectively.Figure 1 Screening of PA model concentration
2.2 灵芝三萜酸降脂效果
加入药后,细胞继续培养48 h,检测TG 含量,根据图5 可知,与空白对照组相比,肝细胞+PA 组与肝细胞+PA+siRNA 组肝细胞TG 含量极显著升高(P<0.01);与肝细胞+PA 组相比,肝细胞+PA+药物低剂量组+siRNA 组、肝细胞+PA+药物中剂量组、肝细胞+PA+药物中剂量组+siRNA 组、肝细胞+PA+药物高剂量组、肝细胞+PA+药物高剂量组+siRNA 组与肝细胞+PA+阳性药物蛋氨酸组肝细胞TG 含量显著降低(P<0.05 或P<0.01);与肝细胞+PA+siRNA 组相比,肝细胞+PA+药物中剂量组+siRNA组与肝细胞+PA+药物高剂量组+siRNA 组肝细胞TG 含量显著降低(P<0.05 或P<0.01)。这个结果提示干扰Pnpla3 基因可以起到降低TG 含量的作用,单独加入中、高剂量的灵芝三萜酸有明显的降脂效果,干扰Pnpla3 基因与加入灵芝三萜酸具有累积降脂效应。
3 讨论
目前用于复制肝脂变模型的细胞主要有L02、QSG-7701[10]、HepG2[11],及小鼠肝细胞 AML[12],造模单用油酸(OA,硬脂酸)、单用棕榈酸(PA,软脂酸)及棕榈酸与油酸配合法(1 ∶2)来诱导,所造成肝细胞损伤与NAFLD 的病变相似[13-14]。本研究获得了长爪沙鼠原代肝细胞最佳成模型时间和棕榈酸的剂量,明确了最佳干扰(敲低)Pnpla3 的时间和载体(外显子序列),发现敲低Pnpla3 可减轻脂滴形成,提示我们Pnpla3 基因与 TG 的合成与积累有关[15],而敲除野生型Pnpla3 基因的小鼠模型没有相关表型或许与小鼠特殊的脂清除机制有关[16]。因此,仅采用PA 诱导就达到了相同的效果,所需要的条件与人的肝细胞(L02,HepG2,有永生化特征),小鼠的肝细胞(AML,有永生化特征)相当,且使用新鲜分离的肝原代细胞,减少了由于永生化等造成基因突变的影响,最大限度地模拟了活体肝细胞的状态。干扰Pnpla3 基因后,长爪沙鼠肝细胞表现出的甘油三酯含量的改变与人Pnpla3 基因效应的研究结果一致,也与沙鼠用高脂饲料造模2 周出现脂肪肝的结果相吻合,同时再次证实了NAFLD 沙鼠模型在细胞水平的特色。

注:A:对照siRNA;B:Pnpla3 siRNA。图2 Pnpla3 siRNA 干扰对长爪沙鼠肝实质细胞脂肪沉积的影响Note.A, NC siRNA.B, Pnpla3 siRNA.Figure 2 Effect of Pnpla3 siRNA interference on fat deposition in the parenchymal liver cells of Mongolian gerbils
注:A:空白组;B:siRNA 对照组;C:siRNA1;D:siRNA2;E:siRNA3。与空白组比较,▲P<0.05,▲▲P <0.01。图3 qPCR 检测Pnpla3 siRNA 转染后沙鼠肝实质细胞中Pnpla3 mRNA 表达水平( x_ ±s,n=3)Note.A, control group.B, siRNA control.C, siRNA1.D, siRNA2.E, siRNA3.Compared with the control group,▲ P<0.05, ▲▲ P <0.01.Figure 3 qPCR detection of Pnpla3 mRNA expression level in parenchymal liver cells of Mongolian gerbils after Pnpla3 siRNA transfection

注:A:空白组;B:siRNA 对照组;C:siRNA1;D:siRNA2;E:siRNA3。与空白组比较,▲P<0.05,▲▲P <0.01。图4 Western blot 检测Pnpla3 siRNA 转染后长爪沙鼠肝实质细胞中Pnpla3 蛋白表达水平( x_ ±s,n=3)Note.A, control group.B, siRNA control.C, siRNA1.D,siRNA2.E, siRNA3.Compared with the control group,▲P<0.05, ▲▲ P <0.01.Figure 4 Western blot detects Pnpla3 protein expression level in gerbil liver cells after Pnpla3 siRNA transfection
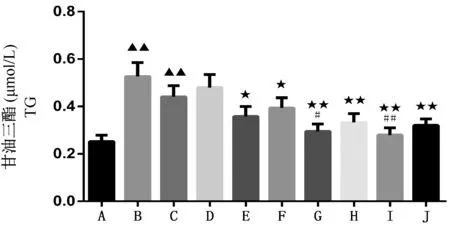
注:A:空白对照组;B:肝细胞+PA 组;C:肝细胞+PA+siRNA组;D:肝细胞+PA+药物低剂量组;E:肝细胞+PA+药物低剂量组+siRNA 组;F:肝细胞+PA+药物中剂量组;G:肝细胞+PA+药物中剂量组+siRNA 组;H:肝细胞+PA+药物高剂量组;I:肝细胞+PA+药物高剂量组+siRNA 组;J:肝细胞+PA+阳性药物蛋氨酸组。与空白对照组比较,▲P<0.05,▲▲P <0.01;与肝细胞+PA 组相比,★P<0.05,★★P<0.01;与肝细胞+PA+siRNA 组相比,#P<0.05,##P<0.01。图5 沙鼠肝细胞中甘油三酯(TG)含量变化情况( ±s,n=3)Note.A, control.B, liver cell+PA group.C, liver cell+PA+siRNA group.D, liver cell+PA+ low (0.01 μmol/L) dose group.E, liver cell+PA+ low (0.01 μmol/L) dose +siRNA group.F,liver cell+PA+medium(0.1 μmol/L).G,liver cell+PA+ medium (0.1 μmol/L) dose +siRNA group.H, liver cell+PA+high (1 μmol/L) group.I,liver cell+PA+high (1 μmol/L) dose +siRNA group.J, liver cell+PA+ methionine group.Compared with the control group, ▲P<0.05,▲▲ P <0.01.Compared with the hepatocyte+PA group, ★P<0.05,★★ P<0.01.Compared with the hepatocyte+PA+siRNA group, #P<0.05,##P<0.01.Figure 5 Changes of TG content in parenchymal liver cells of Mongolian gerbils
除灵芝多糖研究较多外,灵芝三萜类物质明确降脂机理的研究较少。本实验中通过设置灵芝三萜酸(GLTA)的高中低三个剂量梯度、干扰(敲低)Pnpla3 及阳性药物蛋氨酸对TG 含量的观察,结果表明低剂量GLTA 并对TG 含量没有影响,但当干扰Pnpla3 表达之后却能够降低TG 含量,提示单独使用小剂量GLTA 对TG 含量影响较小,经Pnpla3敲低后才能明显发挥影响TG 的作用。这一点我们从单独使用的阳性药蛋氨酸的降脂效果可以对比确认。而提高GLTA 浓度后表明中高剂量GLTA 及干扰Pnpla3 均能够显著影响减少TG 含量,且存在明显的量效关系,即GLTA 对干扰Pnpla3 基因后的长爪沙鼠肝细胞中TG 的含量有明显的抑制或减轻作用,这提示GLTA 降脂效应与Pnpla3 相关。我们之前的结果显示长爪沙鼠NFALD 模型Pnpla3 与磷脂代谢相关2 个通路(ko00561,ko00564)中Pnpla3上调10 倍以上[17],而GLTA 可能通过Pnpla3 表达发挥影响脂肪合成及代谢的作用。另外,本研究结果也提示了GLTA 类似的化合物治疗NAFLD 的潜在机制。
综上所述,建立长爪沙鼠原代肝实质脂变细胞模型,并初步验证了干扰Pnpla3 的降脂效应,在一定程度上说明了GLTA 的一种降脂原因,但如想说明GLTA 是通低调节Pnpla3 的表达量而起作用还需要严谨地验证,因此本课题组准备在后期的研究中增加Pnpla3 基因高表达组并且通过检测GLTA加入后对Pnpla3 基因的表达是否有直接影响来证明。

