薯蓣皂苷对肝癌细胞Bel-7402 和正常人肝细胞LO2 增殖和凋亡的影响
梁玉琼黄 庆梁天坚汪 磊覃日宏盘 涌滕丽娟罗彩神
(1.广西中医药大学赛恩斯新医药学院实验中心,南宁 530222; 2.广西中医药大学第一附属医院药学部,南宁 530023; 3.广西壮瑶药技术研究中心,南宁 530200)
薯蓣皂苷是一种天然甾体皂苷,广泛存在于豆科、薯蓣科、百合科等多种药用植物,是某些中药复方的主要活性成分,如维奥欣片、地奥心血康、穿龙刺骨片。药理研究表明,薯蓣皂苷具有多种生物活性,包括抗肿瘤、抗真菌、调节免疫、抗血小板聚集、改善心血管作用等[1-2]。有趣的是,近年来越来越多研究报道称,薯蓣皂苷对多种癌细胞具有抗癌作用,如人类白血病 K562、人类肺癌 A549 和肝癌Huh7、HepG2[3-4]。但是,薯蓣皂苷对 Bel-7402 肝癌细胞的影响及机制尚未阐明。另外,临床使用发现,长期口服薯蓣皂苷片,患者肝功能指标ALT 及AST 倍增,停药并均给予益肝灵、联苯双酯降肝酶及注射还原型谷胱甘肽护肝治疗(36±8)d 后,肝酶恢复正常,提示长期使用薯蓣皂苷片可能导致肝功能损伤[5]。本课题组前期研究同样发现,中药黄药子总皂苷中的主要成分薯蓣皂苷也对正常大小鼠肝具有损害作用[6-7]。因此,薯蓣皂苷被认为是一把“双刃剑”,其在发挥抗肝癌作用的用时,亦对肝细胞具有一定的毒性作用,这应引起我们的关注。本研究拟选用肝癌细胞 Bel-7402 和正常人肝细胞LO2,比较相同给药时间和相同给药剂量条件下薯蓣皂苷对这两种细胞增殖和凋亡的影响及可能机制,为开发其抗肝癌作用和临床安全合理用药提供科学依据。
1 材料和方法
1.1 实验细胞
正常人肝细胞LO2 由广西中医药大学中药药效研究重点实验室谢金玲惠赠,人肝癌细胞Bel-7402 购自中国科学院上海细胞库。
1.2 主要试剂与仪器
薯蓣皂苷(纯度≧98%),白色粉末结晶,批号:Y06D9Z76750,上海源叶科技有限公司提供。二甲基亚砜(DMSO)完全溶解薯蓣皂苷后,0.22 μm 滤器过滤除菌,配制薯蓣皂苷母液浓度为20 μmol/L,-20℃保存。实验前取薯蓣皂苷母液加入DMEM 单培配制成所需浓度。胎牛血清(批号:1912660C)、DMEM 培养基(批号:8115119)、RPMI1640 培养基(批号:8119071),均购自美国GIBCO 公司;胰蛋白酶-EDTA 消化液(批号:20190430)、MTT(批号:M8180),均购自北京Solarbio 公司;Hoechst33258 染色液(批号:C0003-2)、线粒体膜电位检测试剂盒(JC-1)(批号:040319190715),均购自碧云天生物技术研究所;RIPA Lysis Buffer(批号:3E083E08)、BCA 蛋白浓度测定试剂盒(批号:08E02A46),购自武汉博士德生物技术有限公司;β-actin mouse monoclonal antiby (批 号: 1619501)、 BAX Rabbit PolyAb(批号:50599-2-1 g)、BCL-2 Rabbit PolyAb(批号:12789-1-AP)、goat anti-rabbit IgG(批号:SA00001- 2) 及 Anti-Mouse IgG(H +L) (批号:SA00001-2),均购自美国 Proteintech 公司;ECL 发光液(批号:OC183596),购自美国 thermo 公司;其他试剂均为国产分析纯。
倒置显微镜(TS100,日本Nikon);倒置相差荧光显微镜(日本 Nikon);电子天平(千分之一)(BSA423S-CW,德国赛多利斯科学仪器有限公司);离心机(LDZ5-2,北京医用离心机厂);高速冷冻离心机(ALLEGRA X-15R,美国贝克曼);CO2培养箱(HERAcell 150,德国Thermo);低温冰箱(HYCD-282,Haier Bio-MEDICAL);BioTek 酶标仪,(美国BioTek 公司);电泳仪、半干转膜仪及凝胶成像系统(美国Bio-Rad 公司);-80℃冰箱(美国 Thermo 公司)。
1.3 实验方法
1.3.1 细胞培养
LO2 肝细胞在含10%灭活胎牛血清的DMEM完全培养液中,置于37℃,5% CO2培养箱中常规培养。待细胞长满培养皿的80%后,用0.25%胰蛋白酶消化并传代继续培养,并取对数生长期、生长状态良好的LO2 肝细胞进行实验。同样的方法处理和培养Bel-7402 肝癌细胞,注意选用含有10%浓度的灭活胎牛血清的RPMI-1640 完全培养液。
1.3.2 MTT 法检测薯蓣皂苷对Bel-7402 肝癌细胞及LO2 肝细胞增殖能力的影响
取对数生长期、生长状态良好的Bel-7402 肝癌细胞,0.25%胰酶消化,收集细胞,调整细胞密度至每毫升 3×104个,按每孔 200 μL 接种于 96 孔板,置于37℃,5% CO2培养箱中培养24 h。细胞贴壁后,吸弃培养基,各孔加入适量已预温至37℃的PBS 以除去死细胞,再加入薯蓣皂苷使其终浓度为0.5,1,2,4,6,8,10,16 μmol/L,并设不加药的阴性对照组。每组设6 个复孔,置于37℃,5% CO2培养箱中培养24 h 后,去除培养基,每孔加入 10 μL MTT(5 mg/mL,PBS 配制),37℃,5% CO2培养箱中孵育4 h。孵育结束后,吸弃 MTT 上清。每孔加入 200 μL 二甲基亚砜,水平摇床上摇匀10 min 以使甲瓚充分溶解,酶标仪于波长490 nm 测定吸光度A。同样的方法处理LO2 肝细胞。细胞活力=(药物组平均A-调零孔A)÷(对照组平均A-调零孔A)×100%。
1.3.3 薯蓣皂苷对Bel-7402 肝癌细胞及LO2 肝细胞形态学的影响
取对数生长期、生长状态良好的Bel-7402 肝癌细胞,0.25%胰酶消化,收集细胞,调整细胞密度至每毫升1.0×104个,按每孔2 mL 接种于6 孔板中。孵育24 h 后分别以含0,1,2 μmol/L 薯蓣皂苷处理细胞,每组设3 个复孔,置于37℃,5% CO2培养箱中。给药24 h 后,倒置显微镜下观察细胞的生长状况,并拍照记录细胞形态变化。同样的方法处理LO2 肝细胞。
1.3.4 Hoechst33258 染色观察细胞凋亡
同1.3.3 对Bel-7402 肝癌细胞进行处理,孵育24 h 后,待细胞贴壁后,各孔加入适量已预温至37℃的 PBS 以除去死细胞,给药组加入含 1,2 μmol/L 薯蓣皂苷处理细胞,阴性对照组加入等量无血清培养液,每组设3 个复孔,继续置于培养箱中培养。24 h 后,吸弃培养液,用 PBS 洗两次,每次10 min,吸弃液体,每孔加入500 μL 固定液,固定20 min。去除固定液,用PBS 洗两次,每次5 min,每孔加入500 μL Hoechst33258 染色液,手动晃动染色5 min,吸弃,用PBS 洗三次,每次5 min。每孔滴适量抗荧光淬灭封片液,使用荧光倒置显微镜观察。同样的方法处理LO2 肝细胞。
1.3.5 薯蓣皂苷对Bel-7402 肝癌细胞及LO2 肝细胞线粒体膜电位的影响
取对数生长期Bel-7402 肝癌细胞接种于6 孔板上,细胞分组及干预同1.3.3。按照试剂盒说明书对线粒体膜电位进行检测。干预24 h 后的Bel-7402 肝癌细胞经消化离心收集后,重悬于0.5 mL RPMI-1640 完全培养液中,加入0.5 mL JC-1 染色工作液,混匀后置于37℃孵育20 min。孵育结束后,5000 r/min 4℃离心4 min,弃上清,细胞用预先冰浴JC-1 染色缓冲液(1X)洗涤2 次,重悬后使用荧光分光光度计检测。以红绿荧光相对比值作为衡量线粒体去极化程度。同样的方法处理LO2 肝细胞。
1.3.6 Western blot 蛋白质印迹法检测Bel-7402 肝癌细胞及LO2 肝细胞Bcl-2、Bax 蛋白表达
同1.3.3 对Bel-7402 肝癌细胞进行处理,孵育24 h 后分别以含1,2 μmol/L 薯蓣皂苷处理细胞,同时设不加药的阴性对照组,每组设6 个复孔,继续置于培养箱中培养。薯蓣皂苷干预24 h 后,吸弃培养液,再使用PBS 洗涤培养板中的细胞,每次平放轻轻摇动1 min 以洗涤细胞,弃去洗涤液。重复以上操作两次,将PBS 洗净的培养皿置于冰上。加入300 μL 含 PMSF 的 RIPA,摇匀置于冰上,使用干净的刮棒快速将细胞刮下,然后收集刮下的细胞碎片和裂解液。最后,将收集的脱落细胞裂解液与培养皿中裂解液混合,于 4℃下 12000 r/min 离心 10 min,取适量上清按照BCA 蛋白浓度试剂盒说明书检测蛋白浓度,其余加等体积的加样缓冲液,置于水浴锅中100℃变性15 min,所得的蛋白置于-80℃保存待测。
按照实验室前期所用检测方法测定Bel-7402肝癌细胞中 Bcl-2 及Bax 蛋白表达[8]:取20 μg 蛋白上样,电泳40 mA 1.5 h,转膜100 V 1.5 h,将蛋白从胶上转移到PVDF 上。5%脱脂奶粉封闭2 h,1×TBST 洗膜 10 min×3 次。加入一抗(Bcl-2 兔抗血清,1 ∶2000;Bax 兔抗血清,1 ∶2000;β-actin 羊抗血清为内参照,1 ∶2000)4℃孵育过夜后,移去一抗,1×TBST 洗膜 10 min×3 次。加入二抗(1 ∶2000)室温孵育 1.5 h,移去二抗,1×TBST 洗膜 10 min×3 次后,将PVDF 膜放入Bio-Rad ChemiDoc XRS+化学发光成像系统进行ECL 显影。用Image J 软件分析各组平均条带积分吸光度。
同样的方法处理LO2 肝细胞。
1.4 统计学方法
所有实验重复≥3 次,结果取3 次平均值,实验数据以平均数±标准差( _x ± s)表示。采用 SPSS 17.0 软件进行数据处理统计分析。组间比较采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 薯蓣皂苷对Bel-7402 肝癌细胞及LO2 肝细胞增殖能力的比较
MTT 法检测结果显示,与各自阴性对照组比较,薯蓣皂苷作用于Bel-7402 肝癌细胞及LO2 肝细胞24 h 后,可表现出显著的细胞增殖抑制作用,呈剂量依赖性;但在同一浓度下,薯蓣皂苷对两种细胞的增殖抑制能力没有显著差异。其中Bel-7402肝癌细胞的 IC50 为 2.04 μmol/L,LO2 肝细胞的IC50 为 2.76 μmol/L, 因 此 本 实 验 后 期 选 择1 μmol/L、2 μmol/L 薯蓣皂苷干预 Bel-7402 肝癌细胞及LO2 肝细胞,观察其对这两种细胞增殖和凋亡的影响,结果见图1。
2.2 薯蓣皂苷对Bel-7402 肝癌细胞及LO2 肝细胞形态影响的比较
倒置显微镜观察显示,阴性对照组细胞呈不规则多边形、细胞间分界清晰、表面光滑;1 μmol/L 薯蓣皂苷处理24 h 后,Bel-7402 肝癌细胞及LO2 肝细胞分布密度稍微降低,偶见少数细胞变圆脱落死亡,细胞边界模糊;而在2 μmol/L 薯蓣皂苷浓度下,两种细胞分布密度显著降低,大量细胞出现变圆、皱缩,结果见图2。
2.3 薯蓣皂苷对Bel-7402 肝癌细胞及LO2 肝细胞凋亡形态学影响的比较
荧光染色显示,阴性对照组未发生凋亡,细胞形态完整,细胞核染色均匀,呈低强度蓝色荧光,未见致密浓染、核膜破裂。与阴性对照组比较,1 μmol/L 薯蓣皂苷干预Bel-7402 肝癌细胞及LO2 肝细胞后细胞发生凋亡,细胞核染色质呈致密浓染,细胞核膜破裂,发出蓝色荧光;而2 μmol/L 薯蓣皂苷对Bel-7402 肝癌细胞的促凋亡作用高于LO2 肝细胞,结果见图3。
2.4 薯蓣皂苷对Bel-7402 肝癌细胞及LO2 肝细胞线粒体膜电位影响的比较
JC-1 染色后,当线粒体膜电位水平较高时发出红色荧光,当线粒体膜电位水平下降较低时发出绿色荧光。与各自阴性对照组比较,1、2 μmol/L 薯蓣皂苷干预Bel-7402 肝癌细胞及LO2 肝细胞24 h 后,红色荧光减少绿色荧光增多,红色荧光/绿色荧光比例下降,说明线粒体膜电位水平均显著降低(P<0.01),且呈浓度依赖效应。说明薯蓣皂苷可降低Bel-7402 肝癌细胞及LO2 肝细胞的线粒体膜电位,结果见图4。
2.5 薯蓣皂苷对Bel-7402 肝癌细胞及LO2 肝细胞中Bcl-2、Bax 蛋白表达的影响
实验结果显示,1、2 μmol/L 薯蓣皂苷作用Bel-7402 肝癌细胞及LO2 肝细胞后,均可抑制两种细胞中Bcl-2 蛋白的表达,上调Bax 蛋白的表达;但薯蓣皂苷抑制Bel-7402 肝癌细胞Bcl-2 及升高Bax 蛋白表达的作用均高于同浓度薯蓣皂苷作用于LO2 肝细胞,且呈剂量相关性,结果见图5。
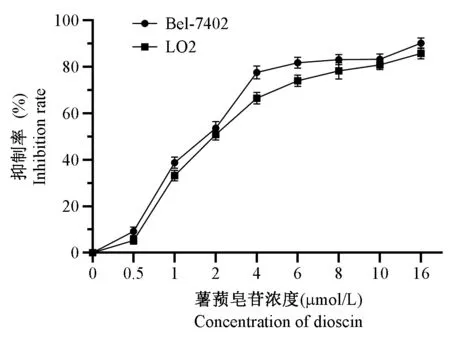
图1 薯蓣皂苷对Bel-7402 肝癌细胞及LO2肝细胞增殖的抑制作用( ±s,n=6)Figure 1 Inhibitory effect induced by dioscin in Bel-7402 and LO2 cells

注:箭头指示代表损伤细胞。图2 薯蓣皂苷对细胞形态的影响Note.Arrows represent injured cells.Figure 2 Morphological changes induced by dioscin in Bel-7402 and LO2 cells
3 讨论
肝癌恶性程度高,发病隐匿,其病死率是占据世界第3 位、我国第2 位的恶性肿瘤[9]。肝癌的复发转移已经成为制约患者长期生存的瓶颈。究其原因,在于肝癌的发病机制尚未明确,各种治疗方法均未切中其“要害”。因此,探求肝癌的发病机制,对于肝癌的诊断、预防及提高生存率具有重要现实意义。
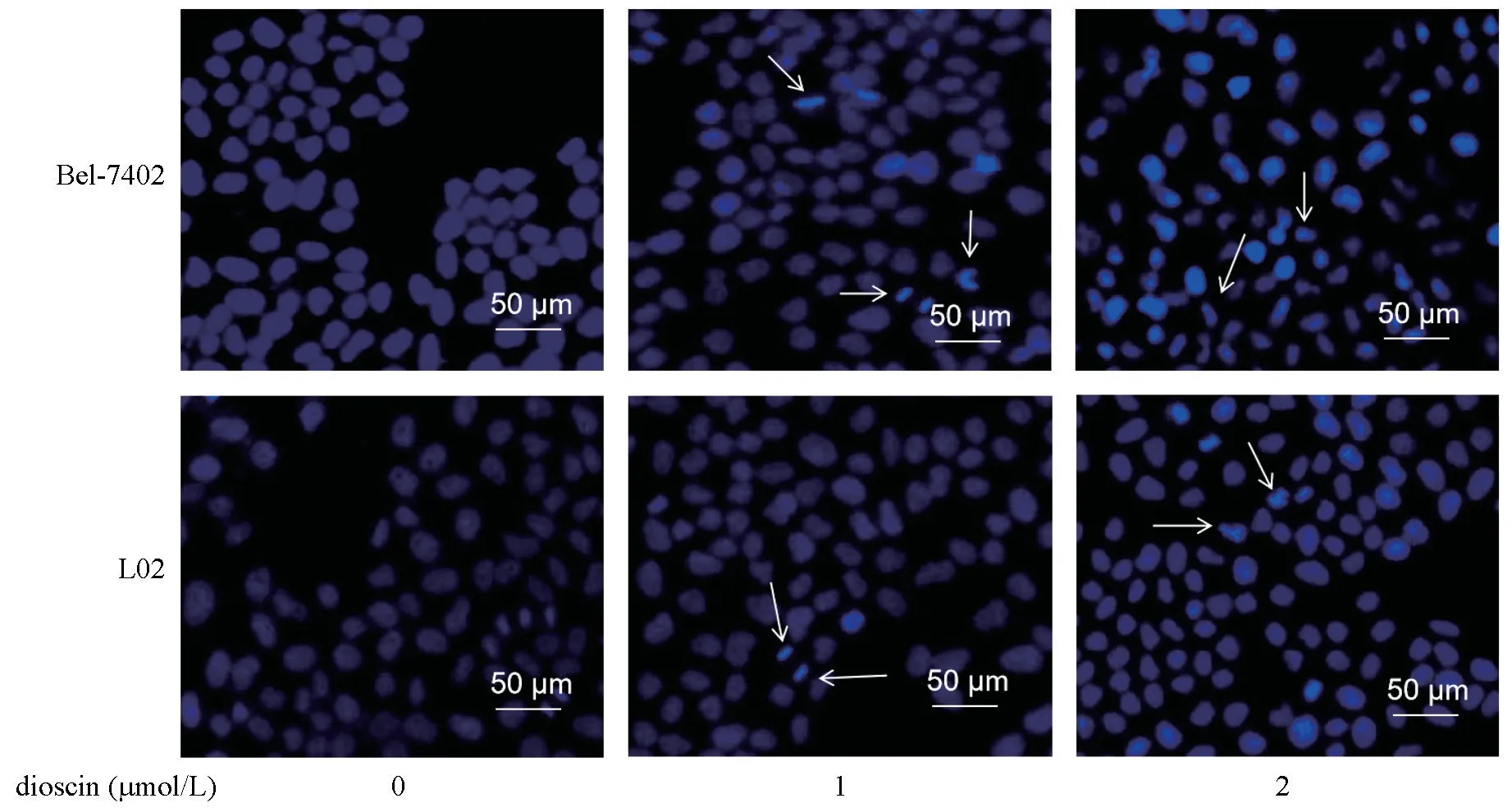
注:箭头指示代表凋亡细胞。图3 薯蓣皂苷对Bel-7402 肝癌细胞及LO2 肝细胞凋亡形态的影响Note.Arrows represent apoptotic cells.Figure 3 Effect of apoptosis features induced by various doses of dioscin in Bel-7402 and LO2 cells stained with Hoechst 33258
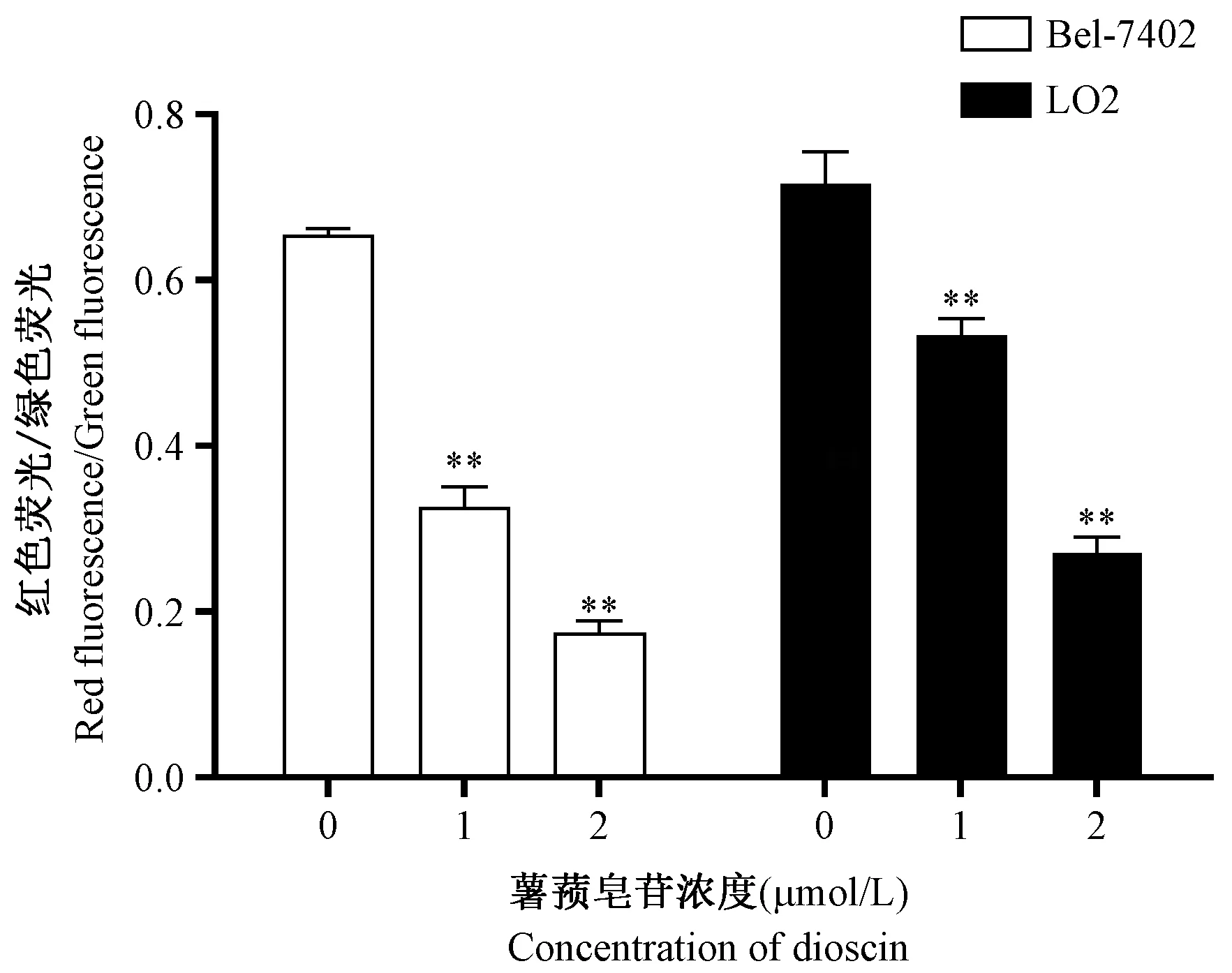
注:与阴性对照组比较,∗∗P<0.01。图4 薯蓣皂苷对Bel-7402 肝癌细胞及LO2肝细胞线粒体膜电位影响( ±s,n=3)Note.Compared with the negative control group,∗∗P<0.01.Figure 4 Effect of mitochondrial membrane potential induced by various doses of dioscin in Bel-7402 and LO2 cell
薯蓣皂苷既有抗肝癌作用,也是一种致肝毒性的成分,其毒-效差异仍有待深入探讨。本文以薯蓣皂苷为研究对象,比较0,1,2 μmol/L 薯蓣皂苷在24 h 内对Bel-7402 肝癌细胞和LO2 正常人肝细胞的增殖抑制及凋亡作用。实验结果显示,薯蓣皂苷能够明显抑制Bel-7402 肝癌细胞及LO2 肝细胞的增殖,但在同一给药浓度下,薯蓣皂苷对Bel-7402肝癌细胞的抑制率均高于LO2 肝细胞。Hoechst 染色结果显示,1 μmol/L 薯蓣皂苷干预24 h 后,两种细胞数量逐渐减少、变圆,且当薯蓣皂苷剂量达到2 μmol/L 时,大量细胞死亡。细胞凋亡是导致细胞死亡的重要途径之一,凋亡异常也是肿瘤诱发的关键因素。故应用Hoechst33258 荧光染色检测发现薯蓣皂苷干预Bel-7402 肝癌细胞及LO2 肝细胞后细胞发生凋亡,细胞核染色质呈致密浓染,细胞核膜破裂,发出蓝色荧光,但2 μmol/L 薯蓣皂苷对Bel-7402 肝癌细胞的促凋亡作用高于LO2 肝细胞。以上结果说明,薯蓣皂苷可抑制Bel-7402 肝癌细胞和LO2 肝细胞增殖并诱导凋亡,提示薯蓣皂苷作为抗肝癌候选药物的同时,亦表现出一定的肝细胞损伤作用。因此,由于薯蓣皂苷潜在的肝毒性作用,临床应用相关药物时应注意监测肝功能变化,并避免长期、超剂量用药。
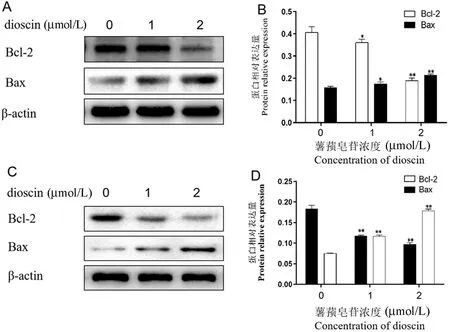
注:A:Bel-7402 肝癌细胞蛋白表达条带;B:Bel-7402 肝癌细胞内各蛋白相对表达量;C:LO2 肝细胞蛋白表达条带;D:LO2 肝细胞内各蛋白相对表达量。与阴性对照组比较 ∗P <0.05,∗∗P<0.01。图5 薯蓣皂苷对Bel-7402 肝癌细胞及LO2 肝细胞中Bcl-2、Bax 蛋白表达的影响( _x ± s,n=6)Note.A, Protein expression band of Bcl-2,Bax in Bel-7402 cells.B, Relative protein expression of Bcl-2, Bax in Bel-7402 cells.C,Protein expression band of Bcl-2, Bax in LO2 cells.D, Relative protein expression of Bcl-2,Bax in LO2 cells.Compared with the negative control group, ∗P<0.05, ∗∗P<0.01.Figure 5 Effect of dioscin on protein expression of Bcl-2,Bax in Bel-7402 and LO2 cells
临床报道,高血压患者常规口服薯蓣皂苷片(80 mg,每天3 次)三个半月后,即总服用剂量达25.2 g,出现转氨酶升高,停用一个多月后,ALT、AST 恢复正常[5]。另有研究证实,小鼠连续尾静脉注射给予10 mg/kg 薯蓣皂苷7 d 后,血清AST、LDH升高,肝细胞水肿并偶见巨核肝细胞现象[10]。上述研究结果与本文研究结果一致,均证明薯蓣皂苷具有潜在的肝毒性作用。因此,临床使用含薯蓣皂苷相关药物(如维奥欣)时,应注意监测肝功能变化,并避免长期、超剂量用药,建议薯蓣皂苷口服用药剂量累计应低于25.2 g。
线粒体膜电位下降是细胞凋亡的早期标志,线粒体膜电位随着细胞凋亡程度的加深而降低甚至消失。JC-1 染色结果发现,与各自阴性对照组比较,1、2 μmol/L 薯蓣皂苷干预 Bel-7402 肝癌细胞及LO2 肝细胞24 h 后,线粒体膜电位水平均显著降低,且呈浓度依赖效应。与此同时,细胞凋亡是一种程序性死亡过程,它已经在各种疾病,包括肝癌中显现出它的重要性[11]。Bcl-2 是一种细胞凋亡的调节因子[12-13]。Bax 是Bcl-2 家族中促进细胞凋亡的因子,编码的Bax 能够与Bcl-2 形成异二聚体,阻抑Bcl-2 蛋白的表达。研究发现,Bcl-2/Bax 蛋白的比值对细胞凋亡的抑制起关键性作用[14]。Western blot 结果显示,随着薯蓣皂苷给药浓度从1 μmol/L增加至2 μmol/L,Bel-7402 肝癌细胞及LO2 肝细胞中的Bcl-2 蛋白表达下降,Bax 蛋白表达均升高。
综上所述,薯蓣皂苷能抑制Bel-7402 肝癌细胞和LO2 肝细胞的体外增殖,降低线粒体膜电位,上调Bax 蛋白的表达、抑制低Bcl-2 蛋白的表达,可初步推断其机制可能是通过线粒体途径降低线粒体膜电位,抑制 Bcl-2 蛋白表达,上调 Bax 蛋白的表达,从而诱导细胞发生凋亡。同时,也提示薯蓣皂苷在发挥抗肝癌作用的同时亦对肝细胞具有损伤作用。目前本研究仅从体外细胞实验探讨薯蓣皂苷的抗肝癌及肝毒性作用,故为保证薯蓣皂苷的开发应用,还需从动物实验研究其“量-效”、“毒-效”差异关系及分子机制。

