与南方水稻黑条矮缩病毒外壳蛋白P10互作的寄主因子筛选
张瑞芳 张合红 魏中艳 陈剑平 孙宗涛
(1 福建农林大学生命科学学院,福建 福州 350002; 2宁波大学植物病毒学研究所,浙江 宁波 315211)
水稻(Oryza sativaL.)在我国具有悠久的种植历史,是重要的粮食作物之一。近年来由于环境及气候的变化,水稻病毒病大面积爆发,严重威胁水稻产量[1]。南方水稻黑条矮缩病毒(southern rice black streak dwarf virus,SRBSDV) 是由介体白背飞虱(Sogatella furcifera,WBPH)进行传播的双链RNA 病毒[2-3],于2001年在广东省首次发现。水稻各个发育时期均可被该病毒侵染,发病症状为植株矮化、叶片颜色深绿、节部有气生须根及高节位分枝、茎秆表面有乳白色瘤状突起、根系不发达且须根少而短、一般不抽穗或抽包颈穗、结实率低[4-5]。
根据SRBSDV 基因组序列特性,将其归为呼肠孤病毒科(Reoviridae)斐济病毒属(Fijivirus)第二小组。其病毒粒子呈正二十面体球状对称结构,直径约75 ~80 nm,具有多层结构,病毒核心粒子(直径50 ~55 nm)光滑无刺突,病毒粒子的内衣壳有塔状B-刺突,外衣壳具有B-刺突和A-刺突。SRBSDV 病毒粒子对有机溶剂非常敏感,因此实验室使用氯仿处理纯化后可得到表面光滑的病毒粒子[6-7]。SRBSDV 在基因组序列水平上与水稻黑条矮缩病毒(rice black-streakeddwarf virus,RBSDV)最为相似,均由十条双链RNA 组成,根据它们在聚丙烯酰胺凝胶电泳中的迁移率,由慢到快,依次命名为S1 ~S10;该病毒的全基因组由29 106~29 115 bp 个核苷酸组成,其中S5、S7 和S9 均有2 个开放阅读框,共编码13 个蛋白,S10 大小为1 797 bp,编码P10 蛋白,大小为65.9 kDa,是病毒粒子的外壳蛋白[8]。在植物病毒中外壳蛋白是研究最早、最广泛的病毒蛋白之一[9]。前期研究发现,RBSDV P10 具有自互作[10-11],通过免疫荧光蛋白技术观察到RBSDV P10 定位在细胞核及质膜上[12]。在水稻中表达RBSDV P10 可介导植物的抗病毒能力[13],但关于P10 在SRBSDV 侵染过程的作用机制,以及对寄主因子的选择,国内外鲜见相关研究报道。基于此,本研究对SRBSDV P10 蛋白功能展开研究,通过对寄主因子功能的研究揭示P10 蛋白及其互作寄主因子在病毒侵染循环中的作用。酵母双杂交是一种用来筛选蛋白互作因子的常见技术手段,在分子生物学研究领域应用十分广泛。该技术不仅可以检测已知功能蛋白间的互作,还可以设计已知功能的蛋白质作为诱饵蛋白,从酵母文库中钓取与其互作的未知蛋白[14],或者用未知功能的蛋白质作为诱饵蛋白进行酵母文库筛选,通过研究已知功能的猎物蛋白推测诱饵蛋白的功能[15]。因此本研究通过DUAL膜系统(DUAL membrane system) 酵母双杂系统来筛选水稻中与SRBSDV P10 互作的寄生蛋白。
1 材料与方法
1.1 试验材料
水稻品种为日本晴,种植于山东省农业科学院实验田中,水稻幼苗自然感病SRBSDV 后,取样送上海欧易生物技术公司提取RNA,并构建酵母双杂交膜体系cDNA 文库;文库与酵母表达载体pBT3-SUC、pBT3-STE 以及pBT3-N 均来自上海海科生物科技有限公司;大肠杆菌感受态(DH5α)购自杭州雅邦生物科技有限公司;酵母感受态(NMY51)购自上海唯地生物技术有限公司。Trizol 购自生工生物工程(上海)股份有限公司;cDNA 合成试剂盒购自南京诺唯赞生物技术有限公司;KOD FX 高保真扩增酶购自日本TOYOBO公司;Thermo Scientific FastDigest Sfi1 购自加拿大Fermentas 公司;PEG-LiAc 购自南京百思禾生物科技有限公司;酵母质粒提取试剂盒购自北京天根生化科技有限公司;大肠杆菌质粒提取试剂盒购自美国Promega 公司。
1.2 诱饵表达载体的构建
根据SRBSDV P10 的编码序列(coding sequence,CDS)设计引物进行PCR 扩增,表1 为RT-PCR 基因扩增特异性序列。PCR 体系为50 μL:25 μL 2×PCR Buffer、5 μL 2 mmol·L-1dNTPs、引物-F 和引物-R 各1.5 μL、cDNA 模板和KOD FX 高保真扩增酶各1 μL、15 μL 无菌水补全体积。将上述试剂混匀后按以下程序进行PCR 扩增:94℃预变性3 min;94℃变性30 s,58℃退火30 s,72℃延伸2 min,共35 个循环;72℃终延伸10 min,然后进行琼脂糖凝胶电泳后切胶回收。

表1 RT-PCR 基因扩增特异性序列Table 1 RT-PCR gene amplification specific sequences
诱饵载体酶切位点为Sfi1,单酶切体系为50 μL:pBT3-SUC、pBT3-STE 或pBT3-N 质粒40 μL;10×Fast Green Buffer 5 μL;Sfi1 内切酶5 μL。混合均匀后于37℃水浴锅放置30 min 后进行琼脂糖凝胶电泳后切胶回收,回收产物即为pBT3-SUC、pBT3-STE 与pBT3-N 载体。将回收的PCR 产物与载体按10 μL 体系连接。于0.2 mL PCR 管中依次加入4.5 μL PCR 产物、2.5 μL 载体片段、2 μL 5×CEⅡBuffer、1 μL 重组酶,混合均匀后放入PCR 仪(德国Eppendof 公司),连接程序为37℃,30 min。将连接产物加到50 μL DH5α 感受态中,冰上放置30 min 后放入42℃水浴锅中热激90 s,加入无抗LB 液体培养基于37℃摇床培养1 h,5 000 r·min-1离心收菌涂布于LB(luria-bertani)固体培养基(加入Kan 抗生素),37℃培养箱培养12 h 后挑取单克隆进行测序,由杭州擎科梓熙生物有限公司完成。将测序结果正确的菌落进行扩大培养,提取质粒用于后续文库筛选。
1.3 酵母自激活检测和功能检测
取实验室已购酵母NMY51 菌株,划线于YPDA(yeast extract peptone dextrose adenine medium)固体培养基,30℃培养2~3 d,挑取生长旺盛的白色单克隆于4 mL 液体培养基,30℃、225 r·min-1振荡培养18~20 h(过夜),至OD600=4。转接YPDA 液体培养基,体积为50 mL,使初始OD600=0.2,30℃、225 r·min-1振荡培养4~5 h,至OD600=0.6,室温下4 000 r·min-1离心5 min收菌,弃上清。用20 mL 无菌水重悬菌体后混匀,室温下4 000 r·min-1离心5 min 收菌,弃上清。用5 mL 0.1 mol·L-1LiAc 重悬菌体混匀,室温下4 000 r·min-1离心5 min 收菌,弃上清。用500 μL 0.1 mol·L-1LiAc 重悬菌体后混匀,分装至1.5 mL 离心管,每个50 μL,依次加入400 μL PEG-LiAc、10 μL 鲑鱼精DNA、以下质粒各5 μL,共10 μL 组合:pNubG-Fe65 +PTSU2-APP(阳性对照)、pPR3N +PTSU2-APP(阴性对照)、PR3N +pBT3-STE-P10(自激活检测1)、pPR3N +pBT3-SUCP10(自激活检测2)、pPR3N+pBT3-N-P10(自激活检测3)、pOST1-Nub1 +pBT3-STE-P10(功能检测1)、pOST1-Nub1 +pBT3-SUC-P10(功能检测2)、pOST1-Nub1+pBT3-N-P10(功能检测3)用枪头吹打混匀。将混合液于30℃水浴孵育30 min,之后42℃水浴热激25 min,再30℃水浴复苏30 min。室温下4 000 r·min-1离心5 min 收菌,弃上清。每个转化用100 μL 无菌水重悬菌体,分别涂布SD-Trp/Leu、SD-Trp/Leu/His、SDAde/His/Leu/Trp 以及SD-Leu 缺陷型筛选平板。30℃恒温培养3~4 d,记录每块平板上的克隆数,并计算每个转化反应在缺陷平板上的转化子数量和生长率。
1.4 文库筛选
选择pBT3-SUC-P10 作为筛库诱饵质粒,从转化的SD-Leu 平板上挑取单克隆菌落接种于5 mL SD-Leu液体培养基中,30℃、225 r·min-1振荡培养18 h 后转接于200 mL YPDA 液体培养基中,30℃、225 r·min-1振荡培养4~5 h,至OD600=0.6。室温下4 000 r·min-1离心5 min 收菌,弃上清。用30 mL 无菌水重悬菌体,混匀后室温下4 000 r·min-1离心5 min 收菌,弃上清。用20 mL 0.1 mol·L-1LiAc 重悬菌体,混匀后室温4 000 r·min-1离心5 min 收菌,弃上清。用10 mL 0.1 mol·L-1LiAc 重悬菌体,混匀后室温4 000 r·min-1离心5 min 收菌,弃上清。向离心管中依次加入以下试剂:200 μL 鲑鱼精DNA、5 mL PEG-LiAc、25 μL cDNA 文库质粒,吹打混匀。30℃水浴孵育30 min,42℃水浴热激25 min,30℃水浴复苏1 h。室温下4 000 r·min-1离心5 min 收菌,弃上清,用4 mL 无菌水重悬菌体,温和混匀后涂SD-Trp/Leu/His +20 mmol·L-13-氨基-1,2,4 -三唑(3,amino-1,2,4-triazde,3AT),抑制酵母自激活)平板,每100 μL,共40 块。置于30℃恒温培养3~4 d,挑取酵母单克隆转至SD-Ade/His/Leu/Trp 平板,30℃培养2 ~3 d。将SD-Ade/His/Leu/Trp 平板上生长旺盛的酵母菌落转接至SD-Ade/His/Leu/Trp 液体培养基,30℃、225 r·min-1振荡培养18 h,准备提取酵母质粒。
1.5 酵母质粒的提取及回转验证
培养的酵母菌液于12 000 r·min-1离心1 min 后收菌并加入300 μL 的山梨醇缓冲液和50 U 的Lyticase溶壁酶,30℃振荡培养1 h;室温条件下12 000 r·min-1离心2 min,弃上清,加入250 μL 的YP1 溶液(加入RNaseA),旋涡振荡15 s 后转移至新的1.5 mL 离心管中;向管中加入250 μL 的YP2 溶液,温和的上下翻转3~5 次,室温放置6 min,以便充分裂解,此时溶液变得澄清透明,开盖会有拉丝现象;加入350 μL 的YP3 溶液,立刻温和的上下翻转6 ~8 次,管内产生白色絮状沉淀;12 000 r·min-1离心10 min;将上清液转移到吸附柱中,12 000 r·min-1离心1 min,重复过柱可提高吸附效率;加入500 μL 的去蛋白PD 溶液洗去多余的蛋白质,12 000 r·min-1离心1 min;加入650 μL 的PW 漂洗液,12 000 r·min-1离心1 min,重复1 次;将吸附柱空离心2 min 后开盖2 min,以便充分挥发残余的酒精;向吸附柱内加入适量的灭菌水,室温放置5 min 后12 000 r·min-1离心2 min,将酵母质粒充分洗脱在新的1.5 mL 离心管中。将提取的酵母质粒送杭州擎科梓熙生物有限公司测序,测序成功的质粒与诱饵质粒pBT3-SUC-P10 分别进行回转。
2 结果与分析
2.1 诱饵载体构建
本研究以南方黑条矮缩病毒侵染后的水稻为材料,提取总RNA 后反转为cDNA 作为模板,根据SRBSDV P10 序列设计上下游引物进行PCR 扩增,产物经琼脂糖凝胶电泳后,结果与预期一致,约在1 700 bp 处出现特异性条带,电泳结果如图1 所示。将克隆得到的SRBSDV P10 cDNA 片段连接到pBT3-SUC、pBT3-STE以及pBT3-N 载体中,构建pBT3-SUC-P10、pBT3-STEP10 以及pBT3-N-P10。测序结果表明,以上3 个载体的目的序列正确,成功获得了诱饵表达载体。
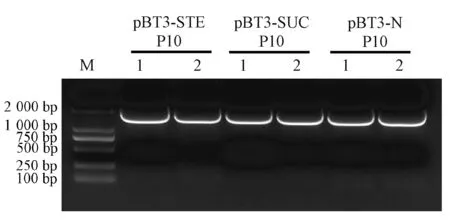
图1 RT-PCR 克隆P10 全长Fig.1 RT-PCR clone P10 full length
2.2 功能验证
在检测膜蛋白酵母双杂交系统的功能时,如果诱饵蛋白在酵母细胞内具有表达功能,便会依据诱饵蛋白在缺少3 种氨基酸的SD-Trp/Leu/His 和缺少4 种氨基酸的SD-Ade/His/Leu/Trp 筛选平板上有10%~100%的生长率,而自激活检测的SD-Trp/Leu/His 和SD-Ade/His/Leu/Trp 筛选平板上,应观察不到显著的生长。在表2 阳性对照反应中,pTSU2-APP 与pNubGFe65 具有较强的相互作用,而作为阴性对照的pTSU2-APP 与pPR3N 在SD-Trp/Leu/His 和SD-Ade/His/Leu/Trp 筛选平板上的生长明显少于阳性对照。检测诱饵基因功能时发现载体pBT3-N-P10 在SD-THL 筛选平板上生长较好,但在SD-Ade/His/Leu/Trp 筛选平板上生长较少;而pBT3-SUC-P10、pBT3-STE-P10 在SD-Ade/His/Leu/Trp 筛选平板上生长均较好,但在自激活检测时发现pBT3-STE-P10 存在自激活,不适合用于筛库。pBT3-SUC-P10 有功能,虽然存在轻微的自激活,但能被5 mmol·L-1的3AT 所抑制,因此选择其作为后续双杂交筛选试验的诱饵克隆。
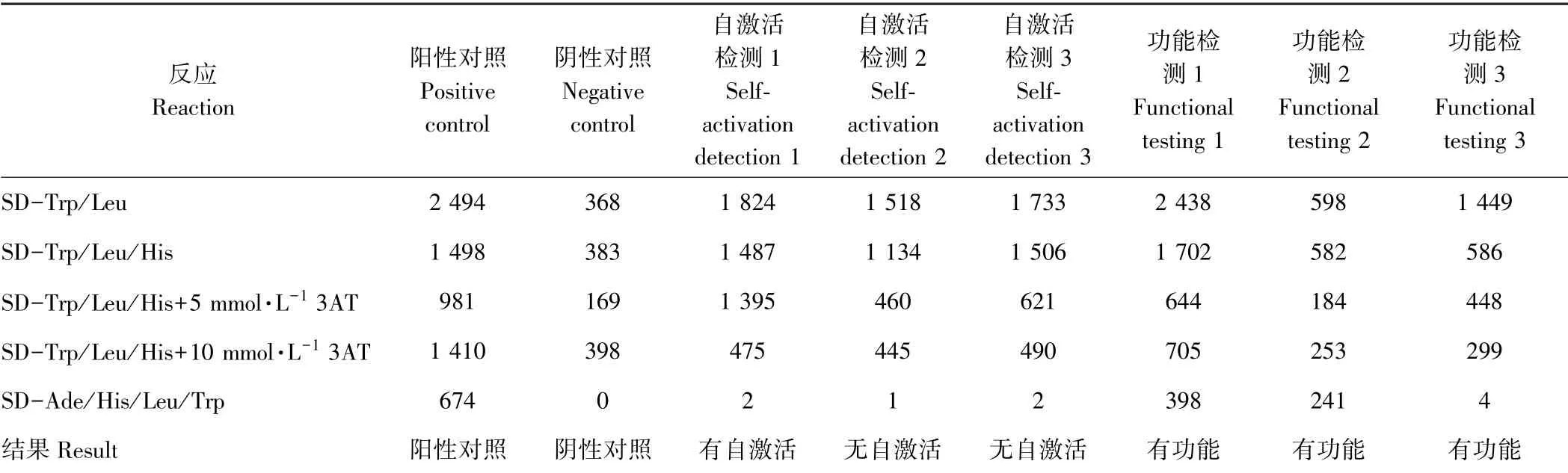
表2 各组酵母在不同培养基上生长克隆数统计分析Table 2 Statistical analysis of the number of colonies grown by different groups of yeast on different media
2.3 筛库结果
酵母双杂交膜体系是由酶切连接的方法实现建库,主要是基于分离的泛素介导膜蛋白互作信号的识别。将含有pBT3-SUC-P10 诱饵质粒的NMY51 酵母转化子作为受体菌制备感受态,将水稻文库质粒pPR3N-WYQ-Mus-LIV 转入其中,涂SD-Trp/Leu +5 mmol·L-13AT 缺陷平板上,培养到第3 天时,挑取生长正常的单克隆划线于SD-Ade/His/Leu/Trp 缺陷平板上(图2),培养3 d 后将阳性克隆酵母菌株分别提取质粒测序。
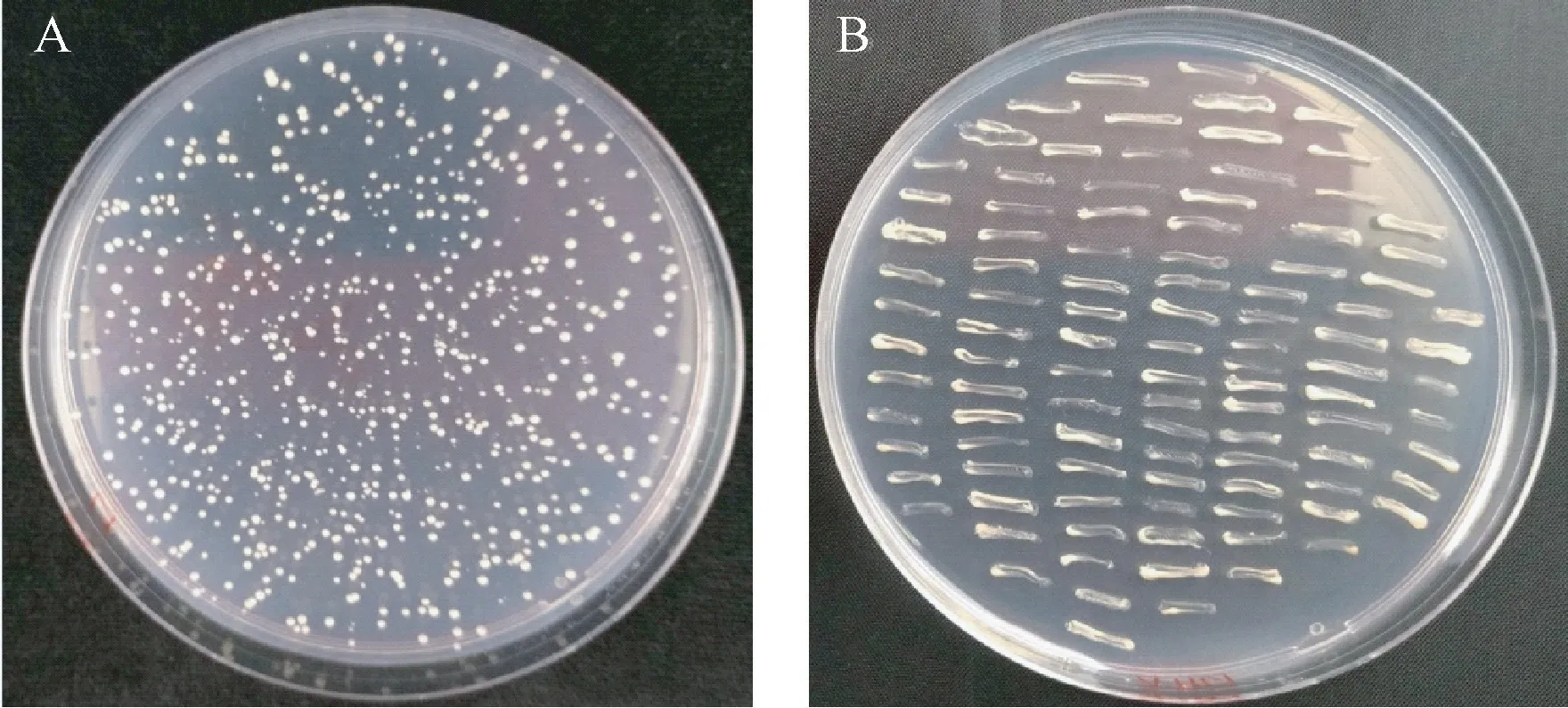
图2 诱饵质粒在不同培养基中的生长情况Fig.2 Growth of bait plasmids in different media
测序结果在 NCBI ( National Center for Biotechnology Information)网站上进行BLAST 比对。将目的基因序列进行比对分析后,挑选10 个具有全长基因序列的克隆进行统计,结果如表3 所示,得到基因与已有报道比对分析,包括硫氧还蛋白H1、胚胎晚期富含Lea14-A 蛋白、G 蛋白偶联受体107 以及之前有报道的真核翻译起始因子5A 等与生长发育及植物抗逆相关的蛋白。
2.4 回转验证
根据上述整理的筛库结果,选出感兴趣的候选因子,将这些基因进行酵母双杂交回转验证。首先将筛选出的含有这些基因片段的酵母质粒转化到DH5α 大肠杆菌感受态中,涂氨苄(ampicillin)抗性的LB 平板,分离出猎物蛋白后与 pBT3-SUC-P10 共同回转NMY51,试验设置pBT3-SUC-P10 和pPR3N 为阴性对照,共转产物涂布于SD-Trp/Leu 缺陷平板上,30℃培养箱生长3 d 后将酵母菌落转接至SD-Ade/His/Leu/Trp 缺陷平板上,酵母双杂交结果如图3 所示。P10 蛋白与目的基因片段共转后的产物均能在缺陷培养基上正常生长,阴性对照没有生长,说明P10 与分离出的猎物蛋白经回转验证后能够在酵母细胞中发生互作。
3 讨论
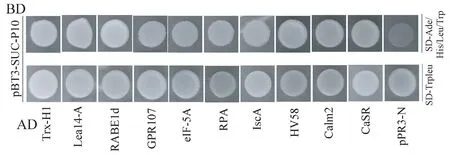
图3 酵母回转验证P10 与酵母分离猎物蛋白的互作Fig.3 Yeast rotation verification of the interaction between P10 and yeast isolated prey protein
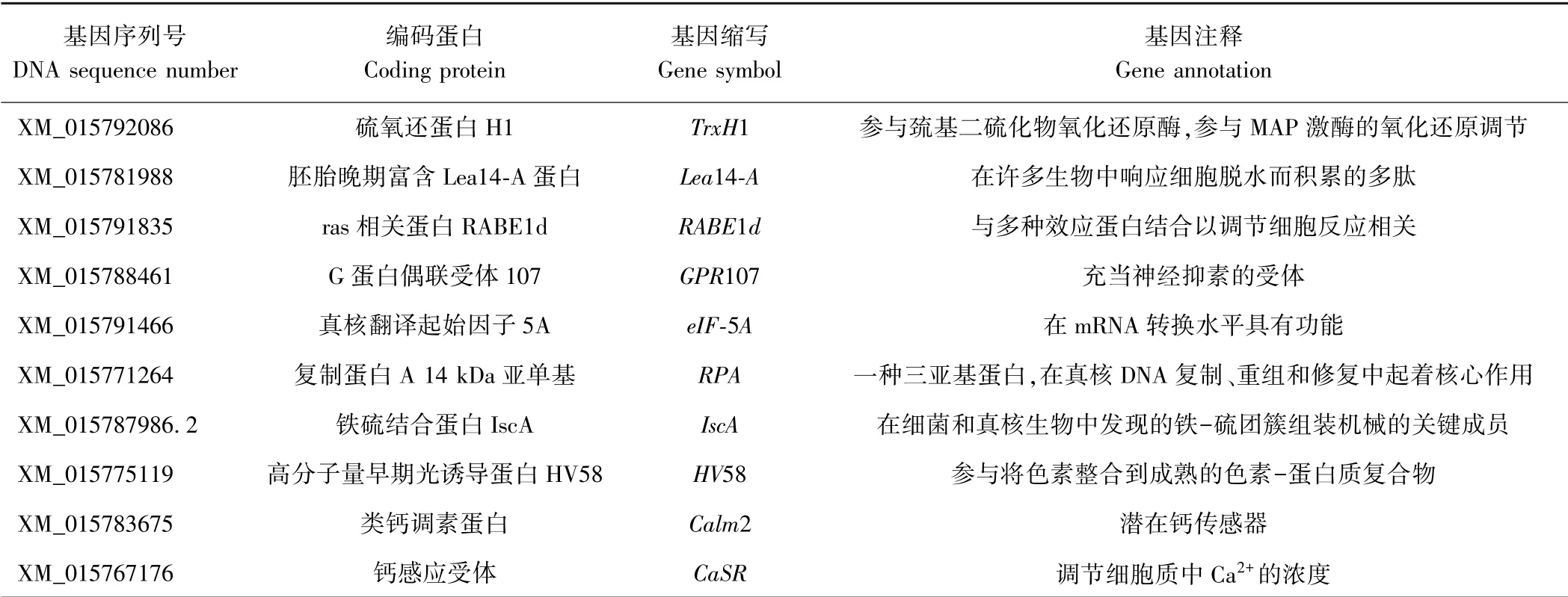
表3 酵母双杂交筛选阳性克隆的生物学信息统计表Table 3 Biological information statistics of yeast two-hybrid screening of positive clones
本研究前期发现RBSDV P10 转基因水稻可以增强对RBSDV 及同属SRBSDV 的抗性,但是在其他病毒如纤细病毒属的水稻条纹病毒(rice stripe virus,RSV)侵染水稻时会抑制植物防御反应[13],而SRBSDV P10 作为外壳蛋白在病毒侵染寄主植物时的发挥作用机制尚不明确。已有研究发现RBSDV P10 定位在细胞质膜与细胞核上[12],而SRBSDV 在功能与结构上与其具有高度同源性,因此本研究选择DUAL 膜系统酵母双杂系统筛选与P10 互作的蛋白。DUAL 膜系统酵母体系是一种基于酵母的筛选测定方法,用于鉴定和表征天然状态下完整膜蛋白、膜相关蛋白和可溶性蛋白之间的相互作用,以及在细胞膜上原位检测全长整合膜蛋白之间的相互作用[16]。
DUAL 膜系统筛库载体pBT3-SUC、pBT3-STE 以及pBT3-N 具有不同的作用结构域,因此先进行功能验证以确定筛库诱饵载体。分别构建pBT3-SUC-P10、pBT3-STE-P10 以及pBT3-N-P10 载体,为了验证筛库诱饵的自激活与功能检测,将构建好的3 个诱饵质粒分别与pPR3N 及pOST1-Nub1 进行一对一酵母双杂试验。结果表明,pBT3-STE-P10 存在自激活,相较于pBT3-N-P10,pBT3-SUC-P10 更具有活性,是最适合进行筛库的诱饵质粒。
利用pBT3-SUC-P10 质粒与水稻cDNA 文库质粒进行筛库,将其转入NMY21 菌株后涂板,在SD-AHLT上生长出来的阳性克隆提取质粒测序,筛选到10 个不同的猎物蛋白,将这些蛋白与pBT3-SUC-P10 进行一对一酵母双杂回转试验,结果发现均具有互作作用。这些蛋白包括与植物早期发育相关的胚胎发育晚期丰富蛋白Lea14-A、硫氧还原蛋白TRX-H1、铁硫结合蛋白IscA 以及真核生物起始翻译因子eIF-5A 等。胚胎发育晚期丰富蛋白(late embryogenesis abundant protein,LEA 蛋白)主要在植物种子发育晚期大量积累,且在植物处于逆境时被诱导产生的一种应激蛋白,与抗多种胁迫相关[17]。水稻中过表达OsLea14-A可以提高对脱水、高盐及重金属的耐受性[18]。铁硫簇是生物学中最常见的氧化还原中心类型之一。已有研究报道,IscA 能够募集细胞内铁并为蛋白质中的铁硫簇输送铁[19]。硫氧还原蛋白(thioredoxin H1-like,Trxs)是植物中蛋白质的多基因家族,通过硫醇-二硫键交换反应在氧化还原平衡调节中起关键作用[20]。水稻中OsTRXh1 调节质外体的氧化还原状态,并影响植物发育和胁迫响应[21]。研究发现,eIF-5A 并非传统意义上的真核翻译起始因子,可能只在某些特殊代谢途径中合成蛋白时所需[22]。有研究表明在水稻中,OseIF5A与RBSDV P10 发生互作,并且可能受植物发育和环境胁迫的调节[23-24]。早期的光诱导蛋白(early light-induced protein,ELIP)属于光捕获复合物的多基因家族,它们结合叶绿素并吸收绿色植物中的太阳能[25-26]。在茶树[Camellia sinensis(L) O. Ktze.]中,CsELIP基因在茶叶中发生光抑制时显著上调,表明它们可能参与光保护作用[27],以及在棉花中(Gossypiumspp)发现GhELIP1 基因在衰老叶片中的表达量最高,表明GhELIP1 基因参与棉花叶片的衰老调控[28]。这些基因的发现说明水稻受到病毒侵染时,生长发育与营养物质的合成均受到影响,可为进一步研究SRBSDV 致病机理提供参考。
4 结论
本研究以南方水稻黑条矮缩病毒外壳蛋白P10作为诱饵载体,通过筛选水稻膜系统酵母双杂cDNA文库,找到水稻中与P10 互作的蛋白,结合生物信息学技术进行分析,回转验证,筛选到10 个可能与P10互作的水稻寄主蛋白,为后续进一步研究P10 蛋白的功能提供了理论依据。
——一道江苏高考题的奥秘解读和拓展

