缺血性肠坏死合并肝门静脉积气一例
黄华平 张迪 赖建勤 龚瑾
病人,男,82岁。因腹痛1天于2020年1月21日入院。病人1天前突发持续性腹痛,呈全腹隐痛阵发性加剧,伴恶心呕吐,头晕。实验室检查:WBC 16.27×109/L,HGB 76 g/L,Glu 16.82 mmol/L,腹部CT检查提示:(1)考虑门静脉系统广泛积气与肝内胆管多发积气鉴别,门静脉主干及肠系膜上静脉积气;(2)肝S4肝内胆管小结石;(3)考虑胆囊腺肌症;(4)左肾复杂性囊肿,右肾小结石;(5)双肺下叶多发炎。予以抗感染、抑酸护胃等对症保守治疗未见明显好转。糖尿病史30余年,血糖药物控制尚可;高尿酸血症10年;既往有双下肢血管闭塞病史。体格检查:急性病容,腹部稍隆,腹肌稍紧,下腹部压痛,无反跳痛,移动性浊音阴性,肠鸣音减弱,1~2次/分。双下肺可闻及少许湿啰音。实验室检查:WBC 24.29×109/L,CRP 224.41 mg/L,HGB 77 g/L,K 3.82 mmol/L,Glu 3.40 mmol/L。腹部X线检查:考虑小肠不完全性肠梗阻。腹部血管彩超检查:腹主动脉粥样硬化并多发斑块形成,腹腔干及肠系膜上动脉狭窄。全腹增强CT检查(图1):肝门静脉积气,盆腔少许积液,回肠末端水肿,右下腹及盆组小肠肠壁广泛积气,考虑小肠坏死。行急诊剖腹探查。术中见盆腔少许黄色浑浊积液,距回盲瓣约10 cm处回肠肠壁暗紫,无溃破穿孔,肠管无蠕动,覆有黄脓苔,长度约30 cm,行小肠部分切除并肠吻合术(图2)。术后病理检查:肠壁全层见大量中性粒细胞浸润,局部见肠壁全层坏死。术后予以输注红细胞、血浆,抗感染等对症支持治疗,术后第4天恢复全流饮食,第14天痊愈出院。随访半年,病人预后佳,饮食活动可,无慢性腹痛腹胀等不适。
讨论肝门静脉积气(hepatic portal venous gas,HPVG)是一种罕见的临床影像表现,是指肝门静脉及其所属分支内出现气体。最早报道于1955年Wolfe的一篇坏死性小肠结肠炎报道。HPVG并不是一种独立的疾病,而是一系列疾病的伴随影像表现,早期的报道统计死亡率高达75%,其中肠坏死占72%,故又被称为“死神之征”[1]。随着CT的普及,愈来愈多诸如溃疡,腹泻,医源性操作等良性HPVG病例的增加,其总死亡率降至29%~39%[2]。
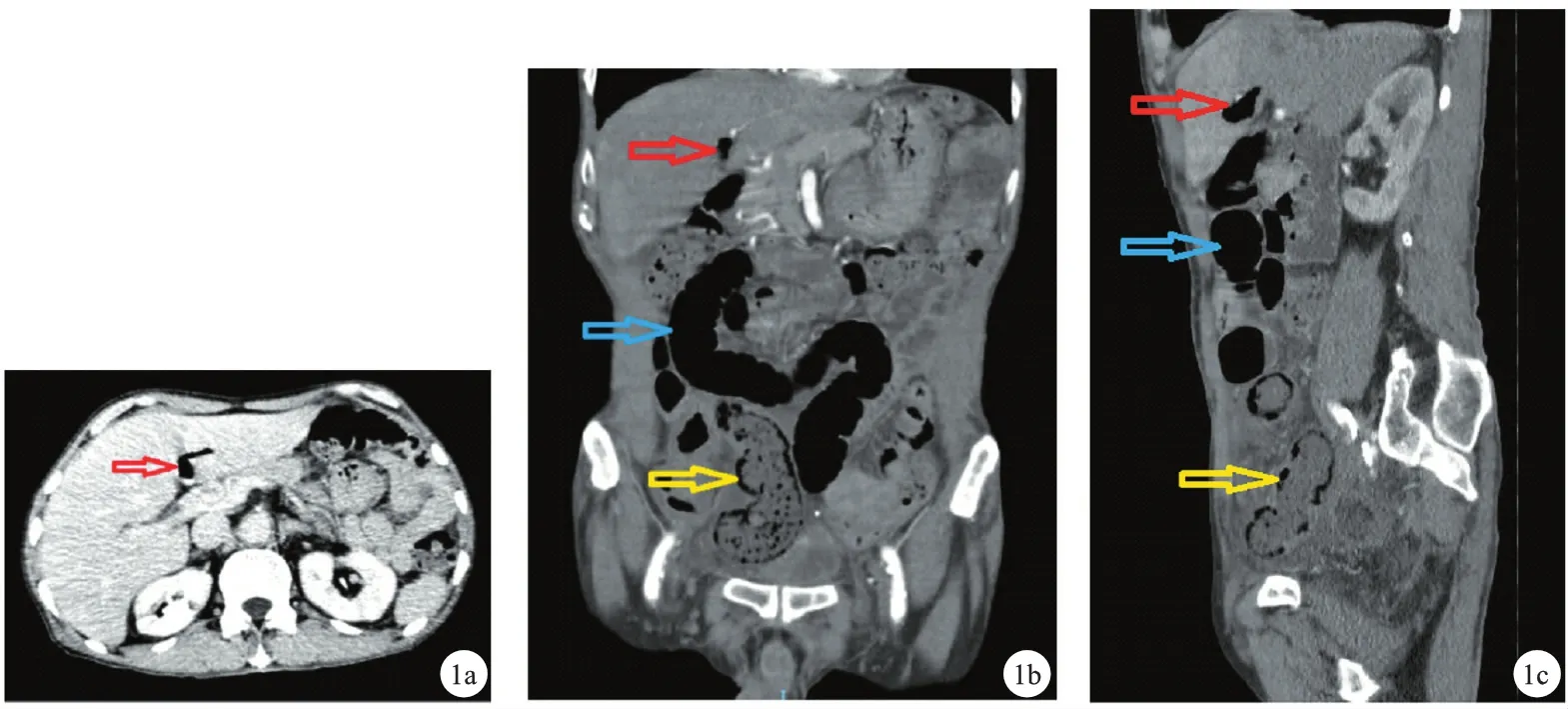
图1 术前全腹增强CT:1a横断位门静脉期;1b冠状位动脉期;1c矢状位动脉期(红色箭头示肝门静脉积气,蓝色箭头示扩张的小肠,黄色箭头示小肠肠壁广泛积气)
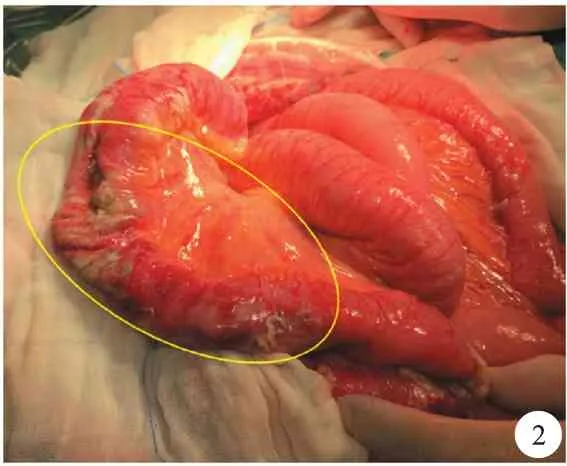
图2 术中见回肠末端肠壁暗紫挛缩伴黄脓苔,未穿孔(黄色圆圈所示)
HPVG发生机制主要包括以下几个方面:(1)机械学说:肠腔内压力增高,高压气体经过肠系膜静脉进入门脉系统;(2)细菌转移学说:肠内产气细菌透过受损的肠黏膜进入门脉系统,代谢产气;(3)医源性操作如介入化疗,射频消融等[3]。本例小肠严重扩张肠壁积气,感染指标增高,小肠缺血性坏死,考虑两种学说共同作用下产生HPVG。
HPVG主要通过CT检查发现,典型的特征为“枯枝征”,即肝包膜下2 cm内,呈枯枝状气体密度影,肝左叶居多。与肝内胆管积气鉴别点在于气体的分布部位:胆汁的向心性流动使气体集中于肝脏中央,而门脉系统的离心性流动使积气分散于肝脏外周[3]。但对于不典型HPVG,缺乏经验的医生容易造成误诊漏诊,不典型者往往处于疾病发展的早期,随着病情的恶化才会愈发典型。本例非典型HPVG(图1a),肝门附近气体低密度影,可以利用增强CT的门脉期示踪门静脉,易与胆管积气相鉴别。此外,增强期肠壁的增强减弱亦有助于诊断肠道缺血坏死。排除造影剂禁忌,增强CT更有助于影像医生乃至临床医生进行阅片,早期诊断[4]。
HPVG往往预示着病情恶化,腹内脏器缺血坏死,更有学者认为是急诊剖腹探查的指征。临床治疗应基于病因诊断,HPVG本身并不是手术指征,良性HPVG,原则上保守治疗加以复查即可;一旦发生脏器缺血坏死,应及时手术剖腹探查。此外,对于老年病人,由于机体反应低下,对痛觉敏感度差,常呈现出临床表现与病理变化不相对应,出现体征不明显,指标不典型,即便病情恶化发展腹膜炎,也不一定能引出腹膜刺激征,容易造成诊断延误,错失抢救时机。
老年病人急性肠坏死合并肝门静脉积气,起病急,病情危重,手术风险巨大,需要临床医生及时诊断,果断治疗。

