基于宏基因组学方法分析施肥模式对设施菜田土壤微生物群落的影响
马 龙,高 伟,栾好安,唐继伟*,李明悦,黄绍文*
(1 中国农业科学院农业资源与农业区划研究所/农业农村部植物营养与肥料重点实验室,北京 100081;2 天津市农业资源与环境研究所,天津 300192;3 河北农业大学林学院,保定 071000)
目前,我国蔬菜体系分为设施蔬菜和露地蔬菜两种,设施蔬菜因其高投入、高产出、高收益的生产特点得到迅速发展,已成为许多地区的农业支柱产业。2016年设施蔬菜播种面积达386.7万hm2,占蔬菜总播种面积的18%左右,但产量占蔬菜总产量约34%,产值占蔬菜总产值的一半左右[1-3]。然而,设施蔬菜栽培过程中普遍存在化肥投入过量、养分比例严重失衡、施肥模式不够合理等现象,导致土壤有机质含量下降、养分过度积累、微生物群落结构破坏等问题,严重制约我国设施蔬菜产业的可持续发展[4-5]。针对上述问题,在合理施肥条件下使用有机肥/有机物料替代部分化肥可以使设施蔬菜的化肥减施潜力达到35%以上[6]。
土壤微生物是农田生态系统的重要组成部分,具有种类多、数量大等特点,主要包括细菌、真菌和古菌,其通过自身生长代谢参与有机质和土壤养分的分解与转化,为土壤养分循环和能量流动提供动力和保障[7-8]。土壤生物学特性 (微生物量、群落结构等) 可以反映土壤质量及肥力状况,被认为是土壤环境质量评价的重要指标[9-10]。前人关于不同施肥模式下土壤微生物群落方面的研究多集中在细菌、真菌[11-13],对土壤古菌的研究十分有限[14-16]。有研究表明,古菌在土壤碳、氮循环中起着至关重要的作用,能参与CH4代谢、氨氧化等过程,是土壤中的潜在养分库[17]。土壤微生物易受外界环境变化的影响,施肥可直接或间接改变农田生态系统的养分平衡和供应状况,从而对土壤生物学特性产生影响[18]。有学者指出,盛果期作为果菜生长发育的关键时期,对土壤养分的需求量较高,土壤微生物活动剧烈[19-20]。因此,明确不同施肥模式对设施果菜盛果期土壤生物学特性的影响,对于农田土壤养分管理具有重要意义。
随着土壤微生物相关研究的日益深入,研究方法也在不断改进。目前国内外对土壤微生物群落结构的研究方法和技术多集中在磷脂脂肪酸分析法[21-23]、定量PCR扩增技术[24]和高通量测序 (16S RNA和ITS) 技术[25-26],应用宏基因组方法分析微生物群落结构的研究较少。有学者指出,宏基因组测序技术可以跨过微生物分离和纯培养过程,揭示土壤中全部存在的微生物遗传组成和群落功能,建立土壤微生物物种与环境之间的关系[27-28]。另有研究发现,利用宏基因组测序可以同步进行土壤细菌、真菌和古菌的测定,既可以分析土壤微生物的组成,也可以分析各物种的群落结构,进而更深入地探明不同施肥模式下土壤微生物群落结构的差异。因此,有必要开展基于宏基因组分析不同施肥模式对设施菜田土壤微生物群落结构影响的研究。
利用天津市西青区蔬菜基地日光温室蔬菜不同施肥模式定位试验,在调查不同施肥模式下土壤微生物量及丰度的基础上,探究土壤微生物群落结构组成及多样性的变化,以此分析有机肥/秸秆替代化肥模式对设施菜田土壤生态环境的影响,为设施菜田制定合理高效的施肥方案提供一定科学依据。
1 材料与方法
1.1 试验区概况
试验地点位于天津市西青区辛口镇第六埠村(117°0′E,39°13′N),该区属于暖温带半湿润大陆性气候,全年平均温度11.6℃、自然降水量586 mm、无霜期203天、日照总量2810 h。供试日光温室东西走向,长 80 m、宽 6.5 m (含 0.5 m 通道),温室前部有通风口,白天适时敞开通风,夜间或降雨时关闭。供试土壤类型为中壤质潮土。定位试验起始时间为2009年10月 (定位试验开始时棚龄为7年),种植制度为春茬番茄-秋冬茬芹菜轮作。定位试验开始前0—20 cm土层基本理化性质为:pH 7.9、有机质25.4 g/kg、硝态氮 186.2 mg/kg、速效磷 144.6 mg/kg、速效钾 404.0 mg/kg。供试芹菜 (Apium graveolens) 品种为‘文图拉’,番茄 (Lycopersicon esculentum) 品种为‘朝研299’。
1.2 试验设计
选取定位试验6个处理,分别为:1) 全部使用化肥氮 (4/4CN);2) 3/4 化肥氮+1/4 猪粪氮(3/4CN+1/4MN);3) 2/4 化肥氮+2/4 猪粪氮(2/4CN+2/4MN);4) 1/4 化肥氮+3/4 猪粪氮(1/4CN+3/4MN);5) 2/4 化肥氮+1/4 猪粪氮+1/4 秸秆氮 (2/4CN+1/4MN+1/4SN);6) 2/4 化肥氮+2/4 秸秆氮(2/4CN+2/4SN)。各处理等量氮磷钾,番茄茬施用的N、P2O5和K2O总量分别为450、225和600 kg/hm2,芹菜茬施用的N、P2O5和K2O总量分别为450、300和600 kg/hm2。春茬番茄和秋冬茬芹菜各处理的具体氮和碳投入量见表1。试验为随机区组设计,每个处理 3 次重复,小区面积 14.4 m2(宽 2.4 m×长 6.0 m)。番茄株、行距分别为0.3 m和0.6 m,种植密度为25000株/hm2;芹菜株、行距分别为0.20 m和0.15 m,种植密度为330570株/hm2。为防止小区间养分和水分的横向迁移,小区间埋设厚度为4 mm PVC板(100 cm 埋于地下、5 cm 露出地面)。

表 1 春茬番茄和秋冬茬芹菜各施肥处理中氮、碳投入量 (kg/hm2)Table 1 Nitrogen and carbon inputs in fertilization treatments during spring tomato and autumn-winter celery season
有机肥全部基施,化肥部分基施,部分作追肥施用。番茄季处理1~6所用化肥中20%氮肥、70%磷肥和20%钾肥基施,剩余氮肥和钾肥分4次追施 (分别在番茄开花期、第一穗果膨大期、第二穗果膨大期和第三穗果膨大期),氮肥追施比例分别为30%、30%、10%和10%,钾肥追施比例分别为10%、30%、30%和10%,剩余磷肥在第一次和第二次追肥各施入15%。芹菜季处理1~6所用化肥中20%氮肥、70%磷肥和20%钾肥基施,剩余氮肥和钾肥在芹菜5~6叶期、8~9叶期和11~12叶期分3次追施,氮肥追施比例分别为35%、35%和10%,钾肥追施比例分别为10%、35%和35%,剩余磷肥在第一次追肥时全部施入。
定位试验所施用的化肥为尿素 (N 46%)、过磷酸钙 (P2O512%)、磷酸二铵 (N 18%、P2O546%)、氯化钾 (K2O 60%) 和磷酸二氢钾 (P2O552%、K2O 34%)。所用有机肥 (商品猪粪) N、P2O5、K2O和C含量分别为 21.7、13.9、16.3和218 g/kg (干基),水分含量为28.9%;所用玉米秸秆N、P2O5、K2O和C含量分别为 10.4、3.2、16.9和427 g/kg (干基),水分含量为64.9%。
基施方式为肥料撒施后旋耕入地,追肥方式为肥料溶于水后随水冲施。各处理均是依据田间持水量进行灌溉,当田间持水量低于60%时进行灌溉。为保证灌水量的准确,每个小区均安装有单独的PVC进水管,并用水表记录灌水量。番茄季和芹菜季灌水总量分别为3889和3334 m3/hm2。
1.3 土壤样品采集及测定方法
1.3.1 土壤样品采集 2019年5月23日于定位试验第20茬设施蔬菜 (春茬番茄盛果期,番茄定植后80天) 采集土壤样品。土壤样品的采集方法是在每个小区内按“S”形布设10个点,采取0—20 cm土壤样品,剔除石砾、植物残根等杂物,混匀装袋,过2 mm筛备用。用四分法取10 g左右的鲜土送去测序公司,进行微生物群落结构 (宏基因组) 分析测定;取一部分放4℃冰箱内保存,用于微生物量碳与氮含量的测定;剩余土壤样品风干后,过1 mm筛和0.15 mm筛用于测定土壤基础理化指标。
1.3.2 土壤微生物群落宏基因组测定 使用美国Omega Bio-Tek 公司的 E.Z.N.A.® Soil DNA Kit(Omega Bio-tek,Norcross,GA,U.S.) 试剂盒提取土壤中微生物总DNA。完成基因组DNA提取后,利用TBS-380检测DNA浓度,采用NanoDrop200检测DNA纯度,使用1%琼脂糖凝胶电泳检测DNA完整性。通过Covaris M220将DNA片段化,筛选约 300 bp 的片段,利用 TruSeq™ DNA Sample Prep Kit试剂盒构建PE文库;采用HiSeq 3000/4000 PE Cluster Kit试剂进行桥式PCR分析;使用HiSeq 3000/4000 SBS Kits试剂进行 lluminaHiseq 测序。
使用MetaGene软件对拼接结果中的contigs进行ORF预测。选择核酸长度大于等于100 bp的基因,并将其翻译为氨基酸序列;用CD-HIT软件对所有样品预测出来的基因序列进行聚类,每类取最长的基因作为代表序列,构建非冗余基因集;使用SOAPaligner软件,分别将每个样品的高质量reads与非冗余基因集进行比对,统计基因在对应样品中的丰度信息[29]。使用BLASTP将非冗余基因集序列与NR数据库进行比对,并通过NR库对应的分类学信息数据库获得物种注释,然后使用物种对应的基因丰度总和计算该物种的丰度[30]。
1.3.3 土壤微生物量碳氮测定及计算公式 土壤微生物量碳氮采用氯仿熏蒸—硫酸钾浸提,通过碳氮分析仪 (Multi N/C 3100) 测定。
土壤微生物量碳BC(mg/kg)=EC/kEC
土壤微生物量氮BN(mg/kg)=EN/kEN
式中:EC、EN为熏蒸土与未熏蒸土壤碳/氮的差值;kEc为转换系数,取值0.38;kEN为转换系数,取值0.45[31]。
1.3.4 土壤微生物群落Shannon指数和Ace指数计算[32]

式中:Sobs=实际观测到的物种数目;ni—第i个物种所含的序列数;N—所有的序列数。
2) Ace 丰富度指数:

式中,ni—含有i条序列的物种数目;Srare—含有“abund”条序列或者少于“abund”的物种数目;Sabund—多于“abund”条序列的物种数目;abund—“优势”物种的阈值,默认为10。
1.3.5 土壤基础理化指标测定 土壤硝态氮采用2 mol/L 氯化钾溶液浸提,双波长 (210 nm和270 nm)紫外分光光度法测定;土壤速效磷采用0.5 mol/L碳酸氢钠溶液浸提,钼锑抗比色法测定;土壤速效钾采用1 mol/L醋酸铵浸提,原子吸收分光光度计测定;土壤有机碳采用重铬酸钾–浓硫酸氧化 (外加热)法测定;土壤pH采用2.5∶1水土比,酸度计测定[33]。
1.4 数据处理
采用 Microsoft Excel 2016 进行数据处理,利用SPSS 16.0 (SPSS Inc.Chicago,IL) 单因素 ANOVA 方差分析及多重比较 (Duncan),运用R语言统计软件进行土壤微生物群落Shannon指数和Ace指数计算、主成分分析 (PCA) 和冗余分析 (RDA)。
2 结果与分析
2.1 有机肥/秸秆替代化肥模式对设施春茬番茄盛果期土壤微生物量碳、氮含量的影响
由表2可以看出,随有机肥用量的增加,土壤微生物量碳 (MBC) 和微生物量氮 (MBN) 含量均呈增加趋势。配施高量有机肥模式 (1/4CN+3/4MN) 土壤MBC和MBN含量均显著高于配施低量、中量有机肥模式 (3/4CN+1/4MN、2/4CN+2/4MN),增幅分别为20.9%~24.9%和57.1%~119.0%;配施秸秆模式(2/4CN+1/4MN+1/4SN、2/4CN+2/4SN) 均高于配施有机肥模式,增幅分别为31.9%~82.0%和14.7%~170.8%。

表 2 不同有机肥/秸秆替代化肥处理下土壤微生物量碳和氮含量 (mg/kg)Table 2 The soil microbial biomass carbon and nitrogen contents under different substitution proportions of organic materials
有机肥/秸秆替代化肥处理的土壤MBC和MBN含量分别在185.2~337.0和13.7~37.1 mg/kg,平均分别为250.0和26.9 mg/kg,较单施化肥模式(4/4CN) 平均分别增加101.5%和134.6%,配施秸秆处理 (2/4CN+1/4MN+1/4SN、2/4CN+2/4SN) MBC 和MBN含量的增幅分别高达158.8%和210.9%。
2.2 有机肥/秸秆替代化肥模式对设施春茬番茄盛果期土壤微生物群落结构的影响
2.2.1 有机肥/秸秆替代化肥模式下设施春茬番茄盛果期土壤微生物丰度 表3显示,有机肥/秸秆替代部分化肥处理可增加土壤细菌和真菌丰度,降低土壤古菌丰度。有机肥/秸秆替代处理的土壤细菌、真菌、古菌丰度分别在 1295.4×104~1485.8×104、93.0×102~110.4×102、20.9×104~26.6×104,平均分别为 1393.4×104、99.9×102、23.4×104,细菌和真菌丰度较4/4CN处理平均增加了8.6%、11.6%,而古菌丰度平均减少了21.7%。

表 3 不同有机肥/秸秆替代化肥处理下土壤微生物丰度 (Reads)Table 3 Soil microbial abundance under different substitution proportions of organic materials
高碳有机替代模式 (1/4CN+3/4MN、2/4CN+1/4MN+1/4SN、2/4CN+2/4SN) 土壤细菌和真菌丰度均高于低碳有机替代模式 (3/4CN+1/4MN、2/4CN+2/4MN),而土壤古菌丰度均低于低碳有机替代模式。与低碳有机替代模式相比,高碳有机替代模式土壤细菌和真菌丰度增幅分别为8.1%~14.7%和6.8%~18.7%,平均分别增加12.3%和12.0%;土壤古菌丰度降幅为6.0%~21.4%,平均降低12.9%。
2.2.2 有机肥/秸秆替代化肥模式下设施春茬番茄盛果期土壤微生物群落组成 从图1可以看到,不同处理细菌的优势门组成相同,但是各菌门所占比例受到处理的影响。6个处理中相对丰度大于1%的土壤细菌优势门均有11个,以变形菌门 (Proteobacteria)相对丰度最大 (41.8%~48.4%),其次是放线菌门(Actinobacteria,10.7%~12.7%),再次是绿弯菌门(Chloroflexi,6.1%~8.6%)、酸杆菌门 (Acidobacteria,6.4%~7.0%),相对丰度小于5%的土壤微生物优势门分别是芽单胞菌门 (Gemmatimonadetes,4.5%~5.9%)、浮霉菌门 (Planctomycetes,3.8%~4.5%)、拟杆菌门 (Bacteroidetes,3.1%~3.7%)、厚壁菌门(Firmicutes,2.5%~2.8%)、蓝藻细菌门 (Cyanobacteria,2.5%~2.9%)、疣微菌门 (Verrucomicrobia,2.1%~2.5%) 和硝化螺旋菌门 (Nitrospirae,1.3%~1.6%)。

图 1 有机肥/秸秆替代化肥模式下土壤细菌的群落组成 (门水平,相对丰度 > 1%)Fig.1 Soil bacteria community composition under different substitution proportion of organic materials(phylum level, relative abundance > 1%)
有机肥/秸秆替代化肥处理提高了变形菌门相对丰度,降低放线菌门、绿弯菌门、芽单胞菌门、厚壁菌门和硝化螺旋菌门相对丰度,其他菌门对不同施肥模式的响应不敏感。与4/4CN相比,有机肥/秸秆替代化肥模式土壤变形菌门的相对丰度增幅为8.7%~15.8%,平均增加11.1%;土壤放线菌门、绿弯菌门、芽单胞菌门、厚壁菌门和硝化螺旋菌门的相对丰度降幅分别为4.0%~15.4%、11.4%~29.1%、1.0%~24.6%、2.9%~12.5%和2.5%~16.9%,平均分别降低10.6%、19.6%、11.7%、8.6%和9.9%。
配施高量有机肥模式 (1/4CN+3/4MN) 土壤变形菌门、放线菌门和酸杆菌门的相对丰度均高于配施低量、中量有机肥模式 (3/4CN+1/4MN、2/4CN+2/4MN),增幅分别为3.2%~5.9%、6.0%~6.1%和1.2%~5.3%,平均分别增加4.5%、6.1%和3.2%,而土壤绿弯菌门、芽单胞菌门、浮霉菌门、拟杆菌门、厚壁菌门、蓝藻细菌门、疣微菌门和硝化螺旋菌门相对丰度均低于低量、中量有机肥模式,降幅分别9.1%~19.9%、9.1%~14.4%、4.0%~5.0%、1.6%~7.2%、1.6%~2.0%、3.6%~4.8%、9.6%~15.3%和13.5%~17.3%,平均分别降低14.5%、11.7%、4.5%、4.4%、1.8%、4.2%、12.4%和15.4%。
配施秸秆处理 (2/4CN+1/4MN+1/4SN、2/4CN+2/4SN) 土壤放线菌门、浮霉菌门、厚壁菌门和蓝藻细菌门的相对丰度均高于配施有机肥处理 (3/4CN+1/4MN、2/4CN+2/4MN、1/4CN+3/4MN),增幅分别为2.7%~13.6%、5.0%~17.8%、4.0%~10.2%和3.8%~16.9%,平均分别增加9.1%、10.8%、6.9%和9.8%,而土壤酸杆菌门的相对丰度低于配施有机肥模式,降幅为2.3%~8.0%,平均降低5.7%。
由图2可看出,不同施肥模式中相对丰度大于1%的土壤真菌优势门共有4个,其中以子囊菌门(Ascomycota) 相对丰度最大 (62.8%~65.4%),其次为担子菌门 (Basidiomycota,22.9%~25.2%),相对丰度小于5%的土壤优势菌门分别为壶菌门(Chytridiomycota,3.8%~4.4%) 和球囊菌门(Glomeromycota,1.4%~1.9%)。

图 2 有机肥/秸秆替代化肥模式下土壤真菌的群落组成 (门水平,相对丰度 > 1%)Fig.2 Soil fungi community composition under different substitution proportion of organic materials(phylum level, relative abundance > 1%)
有机肥/秸秆替代化肥模式提高子囊菌门、壶菌门和球囊菌门相对丰度,降低担子菌门的相对丰度。与4/4CN相比,有机肥/秸秆替代化肥模式土壤子囊菌门、壶菌门和球囊菌门的相对丰度增幅分别为0.8%~3.7%、2.4%~7.6%和0.1%~30.3%,平均分别增加2.0%、5.1%和12.6%;担子菌门的相对丰度降幅为1.9%~9.2%,平均降低4.6%。
1/4CN+3/4MN处理土壤壶菌门的相对丰度低于3/4CN+1/4MN、2/4CN+2/4MN处理,降幅为8.6%~9.9%,平均降低9.2%。
配施秸秆模式土壤壶菌门的相对丰度高于配施有机肥模式,增幅为2.6%~14.8%,平均增加7.3%,而土壤子囊菌门的相对丰度低于配施有机肥模式,降幅为0.1%~4.0%,平均降低2.2%。
图3显示,不同施肥模式下群落相对丰度大于1%的土壤古菌优势门共有4个,以奇古菌门(Thaumarchaeota)的相对丰度最大 (54.9%~65.1%),其次为广古菌门 (Euryarchaeota,26.1%~34.5%),相对丰度小于5%的优势菌门分别为深古菌门 (Candidatus Bathyarchaeota,2.7%~3.6%) 和泉古菌门(Crenarchaeota,2.1%~2.8%)

图 3 有机肥/秸秆替代化肥处理下土壤的古菌群落组成 (门水平,相对丰度 > 1%)Fig.3 Soil archaea community composition under different substitution proportion of organic materials(phylum level, relative abundance > 1%)
有机肥/秸秆替代化肥模式提高土壤广古菌门和深古菌门相对丰度,降低奇古菌门的相对丰度,对泉古菌门影响不明显。与4/4CN相比,有机肥/秸秆替代化肥模式土壤广古菌门和深古菌门的相对丰度增幅分别为5.8%~31.9%和1.1%~25.3%,平均分别增加21.7%和16.0%;奇古菌门的相对丰度降幅为2.2%~15.6%,平均降低10.5%。
1/4CN+3/4MN处理土壤广古菌门、深古菌门和泉古菌门的相对丰度均高于3/4CN+1/4MN、2/4CN+2/4MN处理,增幅分别为7.1%~22.6%、12.7%~24.5%和2.8%~15.5%,平均分别增加10.9%、14.8%和9.1%,而土壤奇古菌门的相对丰度低于配施低量、中量有机肥模式,降幅为9.1%~12.8%,平均降低10.9%。
配施秸秆模式土壤泉古菌门的相对丰度高于配施有机肥模式,增幅为6.4%~32.1%,平均增加21.1%.
2.3 有机肥/秸秆替代化肥模式下设施春茬番茄盛果期土壤微生物群落Alpha多样性
微生物多样性与土壤生态系统功能和环境稳定性密切相关,较高的微生物多样性是抵御外界环境干扰的重要保障[34-35]。表4显示,有机肥/秸秆替代化肥处理的土壤细菌、真菌和古菌的Shannon指数分别在6.94~7.03、5.29~5.33和3.86~4.24,平均分别为6.99、5.31和4.09,较4/4CN处理平均分别增加0.7%、1.4%和9.0%,其中高碳有机替代模式土壤细菌、真菌和古菌Shannon指数平均分别增加1.0%、1.7%和11.9%。

表 4 不同有机肥/秸秆替代化肥处理下土壤微生物群落多样性指数Table 4 Soil microbial diversity index as affected by partial substitution of chemical fertilizer by organic materials
有机肥/秸秆替代化肥模式下土壤细菌和真菌的Ace指数均高于单施化肥模式,其中高碳有机替代模式效果较好。有机肥/秸秆替代化肥模式土壤细菌和真菌Ace指数分别在11968.0~12042.0和374.3~388.0,平均分别为11997.0和381.5,较单施化肥模式平均分别增加1.3%和3.1%。
2/4CN+1/4MN+1/4SN模式土壤细菌、真菌和古菌Shannon和Ace指数在不同施肥模式中均呈较高的水平,说明此模式下土壤生态系统更为稳定,抵御外界环境变化的能力更强。
2.4 有机肥/秸秆替代化肥模式下土壤微生物群落结构组成的主成分分析及冗余分析
对18个样品的土壤细菌、真菌和古菌在种(species) 水平上进行主成分分析 (图4),可以看出第一轴的解释量分别为27.3%、24.1%和17.8%,第二轴的解释量分别为9.6%、15.0%和9.6%。单施化肥与有机肥/秸秆替代化肥处理的土壤细菌和真菌群落结构可分为彼此之间界限明确的两组,古菌群落结构按不同施肥模式则可分为4组:4/4CN、3/4CN+1/4MN、2/4CN+2/4MN和2/4CN+1/4MN+1/4SN、1/4CN+3/4MN和2/4CN+2/4SN。表明不同施肥模式对土壤古菌群落结构组成的影响强于对细菌和真菌。

图 4 不同有机肥/秸秆替代化肥模式下土壤微生物群落结构的主成分分析Fig.4 Principal component analysis (PCA) of soil microbial community structure under different substitution proportion of organic materials
经过10年20季种植后,有机肥/秸秆替代化肥模式较单施化肥模式提高了土壤有机碳、硝态氮和速效磷含量,增幅分别为24.0%~67.1%、10.8%~76.9%和17.9%~113.1%,对pH和速效钾含量影响不显著 (表 5)。
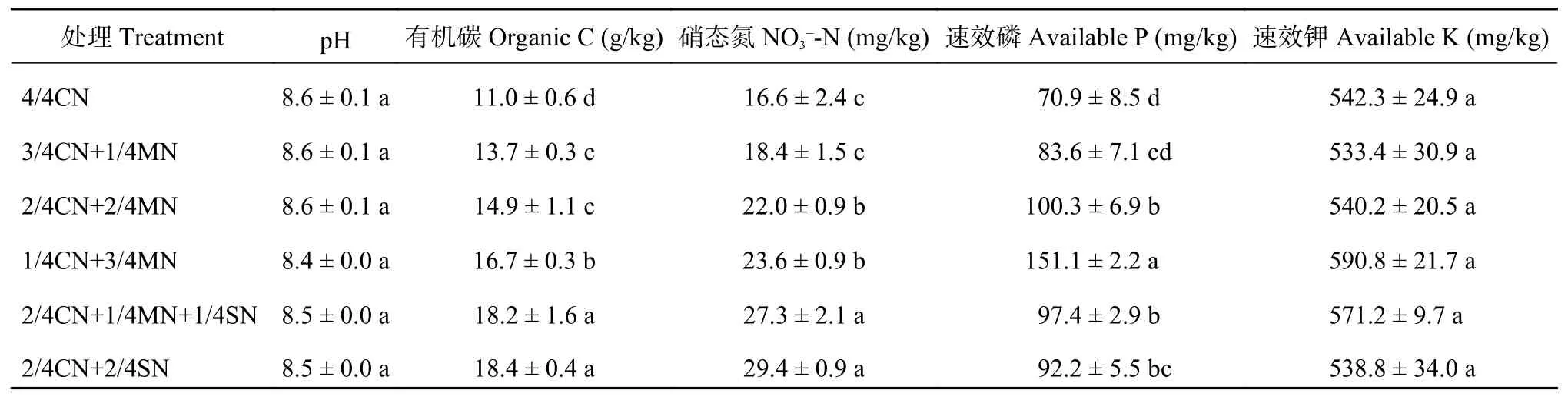
表 5 不同有机肥/秸秆替代化肥模式下土壤理化性质Table 5 Soil physicochemical properties under partial substitution of chemical fertilizer by organic amendments
土壤理化性质对土壤细菌、真菌和古菌群落结构影响的冗余分析 (RDA) 结果显示,在分析的5个指标中,有机碳 (P=0.001)、pH (P=0.006) 和硝态氮 (P=0.002) 对土壤细菌群落结构影响显著,分别解释其群落结构变异的22.3%、20.3%和16.1%;有机碳 (P=0.001) 和硝态氮 (P=0.001) 对土壤真菌群落结构影响显著,分别解释其群落结构变异的10.4%和8.9%;硝态氮 (P=0.001) 和有机碳 (P=0.001) 对土壤古菌群落结构影响显著,分别解释其群落结构变异的36.0%和34.7% (图5)。因此,土壤有机碳和硝态氮含量是影响细菌、真菌和古菌群落结构的共同因素。

图 5 不同有机肥/秸秆替代化肥处理土壤微生物群落结构与土壤理化性状关系的冗余分析Fig.5 Redundancy analysis (RDA) of soil microbial community structure constrained by soil physicochemical properties in each organic substitution treatment
3 讨论
3.1 有机肥/秸秆替代化肥模式对设施春茬番茄盛果期土壤微生物丰度的影响
有机肥长期替代部分化肥对土壤中不同微生物群体的结构和丰度影响不同。在黑土小麦–大豆–玉米轮作体系下,有机肥与无机肥配施能够增加细菌丰度,降低真菌丰度[36],有机肥与无机肥配施模式显著提高砂姜黑土细菌和真菌丰度[37]。丁建莉等[38]对东北黑土真菌群落结构的研究表明,有机肥与无机肥配施模式土壤真菌丰度显著低于单施化肥模式。长期单独施用化肥会导致土壤板结、酸化,抑制微生物的生长[39],而有机肥、有机物料的投入可改善土壤结构及其养分状况,为微生物生长、繁殖提供充足的“食物”及较佳的“微环境”[40],较高的有机替代模式可为微生物生长繁殖提供更多样、更丰富的能源物质。在本试验中,高碳有机替代处理较单施化肥显著提高了设施蔬菜土壤中的细菌、真菌丰度,但是降低了古菌的丰度。
与土壤细菌相比古菌数量很低,但对土壤的碳氮代谢起着至关重要的作用[17],因而成为土壤微生物研究的一个重要内容。袁红朝等[41]对稻田土壤的研究表明,化肥配施秸秆相较于单施化肥可显著提高土壤古菌丰度。邢亚薇等[42]也证明与单施化肥模式相比,有机肥与无机肥配施增加黑垆土土壤古菌丰度。而在本研究中,有机肥/秸秆替代化肥模式却降低了土壤中的古菌丰度。有学者指出,土壤微生物群落亚群间存在着一定的竞争关系,某一亚群的快速生长必然会因竞争“食物”等资源,对其他亚群的生长产生一定的抑制作用[43]。有研究表明,细菌、真菌对养分的竞争能力要强于古菌[44],本研究有机肥/秸秆的投入对土壤真菌及细菌的促进作用,可能增强了其对碳、氮的竞争,抑制了土壤古菌的数量。
3.2 有机肥/秸秆替代化肥模式对设施春茬番茄盛果期土壤微生物群落结构及多样性的影响
从本试验的结果可知,设施蔬菜土壤细菌的主要优势菌群包括变形菌门 (41.8%~48.4%)、放线菌门 (10.7%~12.7%)、绿弯菌门 (6.1%~8.6%) 和酸杆菌门 (6.4%~7.0%)。与单施化肥相比,有机肥/秸秆替代化肥可提高变形菌门相对丰度,降低放线菌门和绿弯菌门相对丰度;与只配施粪肥模式相比,同时配施秸秆可提高放线菌门的相对丰度,降低酸杆菌门的相对丰度。刘平静等[11]的研究表明,有机无机肥配施显著降低了土放线菌门的相对丰度;孙瑞波等[45]的研究表明,秸秆与化肥配施会提高砂姜黑土变形菌门和酸杆菌门相对丰度,显著降低放线菌门的相对丰度。变形菌门被认为是富营养菌群,可在营养丰富的土壤环境中迅速繁殖,而放线菌门和绿弯菌门作为土壤中耐胁迫能力较强的微生物,对不利环境适应性强,适宜在养分较低的环境中繁殖[46-48]。本研究中,有机肥/秸秆的投入可提高土壤有机碳、硝态氮及速效磷的含量,更适合富营养菌群 (变形菌门) 的生长,相对来讲,单施化肥更利于耐胁迫菌群(放线菌门、绿弯菌门) 的生长繁殖。
在本研究中,设施蔬菜土壤真菌的主要优势菌群包括子囊菌门 (62.8%~65.4%)、担子菌门(22.9%~25.2%)、壶菌门 (3.8%~4.4%) 和球囊菌门(1.4%~1.9%)。与单施化肥相比,有机肥/秸秆替代部分化肥提高了子囊菌门、壶菌门和球囊菌门相对丰度,降低担子菌门的相对丰度,配施有机肥模式土壤子囊菌门的相对丰度高于配施秸秆模式。子囊菌门具有分解土壤易降解有机底物的能力,且其比担子菌门具有更高的物种进化速度和多样性[49-50]。由于有机肥比秸秆更易被降解,子囊菌门对配施有机肥的环境喜好性更强,故在配施有机肥模式中子囊菌门相对丰度更高。
与细菌和真菌相比,学者对土壤古菌的了解非常有限,目前提出的27个古菌门只有6个有培养代表,随着基因组测序和计算方法的发展正在加深对古菌的了解[14]。本试验结果表明,奇古菌门 (54.9%~65.1%)、广古菌门 (26.1%~34.5%)、深古菌门(2.7%~3.6%) 和泉古菌门 (2.1%~2.8%) 是土壤古菌主要优势菌群。土壤古菌被认为存在于极端环境 (如强酸、强碱或高盐环境) 中,对生存环境或底物的要求苛刻,耐胁迫的能力强[51-52],有机肥/秸秆替代化肥模式为土壤增加多种养分与能量,土壤古菌可更好地适应土壤的变化,故土壤古菌对土壤环境的响应会更强。在本研究中,与单施化肥模式相比,有机肥/秸秆替代化肥模式提高土壤广古菌门和深古菌门的相对丰度,降低奇古菌门的相对丰度。王宁等[53]对稻田土壤古菌群落组成的研究也表明,奇古菌门(97.3%~98.1%) 为土壤古菌主要优势菌群,秸秆还田后,可大大降低土壤中奇古菌门相对丰度。有学者指出,奇古菌门在土壤氨氧化过程 (硝化作用的限速步骤) 中起着重要作用[54-55]。有机无机肥配施能有效地降低土壤硝酸盐含量,并且施用高碳氮比的有机物料可促使土壤硝态氮更多地转变为微生物量氮储存[56]。本研究中奇古菌门丰度的降低从另一个角度证明了有机无机替代调节土壤中硝态氮含量的有益作用。
土壤微生物群落多样性指数对不同施肥模式的响应存在差异。有学者指出,长期有机肥和无机肥配施能提高土细菌的Shannon指数[9],在稻田土壤化肥与秸秆配施可提高土壤细菌和古菌的Shannon指数[41],与单施化肥相比,单施有机肥和有机无机肥配施均能提高黑土细菌和真菌的Shannon和丰富度指数[36]。另有研究表明,施用有机肥也会降低黄土真菌Shannon指数[13]。本试验结果表明,与单施化肥模式相比,有机肥/秸秆替代化肥模式提高土壤细菌、真菌和古菌Shannon指数及Ace指数,其中以2/4CN+1/4MN+1/4SN模式效果最佳。究其原因为:2/4CN+1/4MN+1/4SN模式为化肥–有机肥–秸秆配施,化肥可为土壤微生物生长繁殖提供大量速效养分,有机肥/秸秆二者的投入可为微生物提供更多的、更丰富的碳源底物,而且可改善由单施化肥引起的土壤酸化和养分不均衡的弊端,增加土壤微生物多样性,提高抵御外界环境干扰的能力,使土壤生态系统功能趋于稳定。
土壤基础理化性质直接影响土壤微生物的养分供给能力以及生存环境。赵凤艳等[57]的研究表明,铵态氮、电导率、pH和全碳是影响土壤细菌群落变化的重要环境因子,丁建莉等[38]的研究表明有效磷、铵态氮和硝态氮是东北黑土真菌群落结构变化的重要影响因子。还有研究表明,pH与C/N值是影响稻田土壤古菌群落结构变化的重要影响因子[51]。依据本研究的主成分分析 (PCA) 结果,土壤细菌和真菌对不同施肥模式的响应弱于土壤古菌;依据冗余分析(RDA) 结果,有机碳 (P=0.001)、硝态氮 (P=0.002)显著影响土壤细菌、真菌和古菌群落结构组成。硝态氮作为速效养分可被微生物直接利用参与土壤氮代谢过程,有机碳作为土壤碳源的外在反映,影响土壤微生物的活动[38]。可以认为,施肥模式通过影响土壤理化性状,最主要的是有机碳和硝态氮含量,影响了设施菜田土壤微生物群落结构。
综合本试验结果及10年定位试验产量数据(2/4CN+1/4MN+1/4SN模式产量最高)[58],表明化肥–有机肥–秸秆配施模式 (2/4CN+1/4MN+1/4SN) 为设施菜田可持续发展的模式。
4 结论
有机肥/秸秆替代化肥,特别是高碳有机替代模式可促进土壤微生物生长繁殖,提高土壤微生物量碳含量、微生物量氮含量,提高细菌和真菌丰度,降低土壤古菌丰度。
有机肥/秸秆替代化肥模式虽然没有改变微生物的组成结构,但是影响了优势菌群的比例。配施有机肥或秸秆可提高适宜于富养环境的细菌和真菌菌群,降低适应恶劣营养环境的菌群数量。驱动土壤细菌、真菌和古菌群落结构改变的主要土壤环境因子为有机碳、硝态氮含量。设施蔬菜土壤较高的养分含量和环境,致使细菌和真菌群落结构组成对施肥模式的响应弱于土壤古菌。设施蔬菜土壤古菌的主要优势菌群包括奇古菌门 (54.9%~65.1%)、广古菌门 (26.1%~34.5%)、深古菌门 (2.7%~3.6%) 和泉古菌门 (2.1%~2.8%)。有机肥/秸秆替代化肥模式提高土壤广古菌门和深古菌门的相对丰度,降低奇古菌门的相对丰度。

