外源谷胱甘肽喷施对缺硫胁迫下小白菜谷胱甘肽代谢的影响
王 丹,汪宽鸿,杨 静,朱祝军,祝 彪
(浙江农林大学农业与食品科学学院/浙江省农产品品质改良技术研究重点实验室,浙江杭州 311300)
硫是植物生长发育过程中所必需的营养元素[1-2],同时也是维生素、多肽 (GSH和PC)、含硫氨基酸(Met和Cys) 以及许多次级代谢产物的重要组成成分[3-4]。增施硫肥能够有效促进植物光合作用和蛋白质形成,提高农作物产量,改善农产品品质[5]。近年来,南方红壤地区的硫缺乏现象十分普遍,缺硫胁迫很大程度上阻碍了植物的生长发育,严重制约了农业生产[6]。谷胱甘肽 (GSH) 是一种由甘氨酸(Gly)、谷氨酸 (Glu) 和半胱氨酸 (Cys) 缩合而成的三肽化合物[4,7-8],甘氨酸残基可以防止GSH被γ-谷氨酰环化转移酶作用,由谷氨酸的γ-羧基和半胱氨酸的α-氨基缩合而成的特殊肽键γ-谷氨酰胺键可以保护GSH不被多肽酶水解[4],半胱氨酸上游离的巯基具有很强的供电子或质子氢的能力[9]。GSH这种特殊的化学结构,使其在植物体内发挥至关重要的作用,参与细胞代谢过程中产生的多余活性氧自由基的清除、过氧化物的还原、对氧化还原敏感信号的传导[9-13]、与异源有毒物质络合、调控植物生长发育以及对各种逆境胁迫 (重金属、干旱、盐胁迫、病菌侵染) 的抵抗[14-17]。植物细胞中GSH的生物合成分两步依赖ATP参与的酶催化反应完成。第一步,合成γ-谷氨酰半胱氨酸 (γ-EC),由L-半胱氨酸和L-谷氨酸在 γ-谷氨酰半胱氨酸合成酶 (γ-ECs) 催化下反应;第二步,合成GSH,由γ-谷氨酰半胱氨酸和甘氨酸在GSH 合成酶 (GSH2) 催化下反应[7-8]。其中,γ-ECs(由GSH1基因编码) 是GSH合成过程中的限速酶,通过最终产物GSH对γ-ECs活性反馈抑制,调控GSH的生物合成[11,18]。研究表明,细胞内总GSH含量在拟南芥细胞和烟草分裂间期G1期到S期过渡过程中显著增加,在缺失GSH1的拟南芥根尖分生组织细胞分裂间期却没有观察到G1期向S期的转变[19-20],在缺失GSH1的拟南芥pad2-1突变体内,GSH含量只有野生型的20%[21-22]。在植物GSH代谢中,有GSH还原酶 (GR)、GSH过氧化物酶 (GPx)、GSH 硫转移酶 (GST) 3 个关键酶[23]。GR 可在NADPH辅酶的催化下将氧化型谷胱甘肽 (GSSG) 还原成还原型谷胱甘肽 (GSH),降低植物体内活性氧(ROS) 含量,减轻植物所受的氧化胁迫[24-25]。GPx可以在GSH的参与下,清除机体内的H2O2、过氧化物及脂质过氧化物,保护机体不被ROS进一步损伤[26-28];GST能够催化GSH与外源毒素及内源有毒物质结合生成水溶性产物,或者将结合的化合物从细胞质中转运到液泡中,最终被排除到细胞外[29-31]。
小白菜又称不结球白菜,俗称青菜、油菜等,是需硫量较高的作物之一,含有较多的甲硫氨酸、胱氨酸和半胱氨酸等含硫氨基酸以及多种含硫次生代谢产物,对硫缺乏较为敏感[32-33]。目前,关于外源GSH缓解逆境胁迫的研究主要集中在干旱、重金属以及盐胁迫等方面,对外源GSH缓解缺硫胁迫的研究尚未见报道。本试验以小白菜为试材,进行缺硫胁迫和外源喷施GSH、GSSG处理,分析GSH1基因表达量、γ-ECs、GR、GPx、GST活性以及GSH和GSSG含量,从基因表达、酶活性、物质含量层面综合分析外源GSH和GSSG处理对缺硫胁迫下小白菜GSH代谢途径的影响,为利用外源GSH减轻植物缺硫胁迫提供理论依据。
1 材料与方法
1.1 试验材料与试验设计
试验选用的小白菜品种为‘杭州油冬儿’(BrassicarapaL.ssp.Chinensisvar.communis.cv.Hangzhou You Dong Er),由杭州种子公司提供。试验于2018年10月和2019年3月在浙江农林大学农学院人工智能气候室育苗,2018年10—11月和2019年3—4月在浙江农林大学平山基地玻璃温室营养液栽培。在穴盘中育苗,将小白菜种子播于50孔穴盘基质中 (每孔2~3粒),待幼苗长至2~3片真叶时,选取长势一致幼苗,自来水洗去根部基质,随后移栽到10 L水培箱中 (每箱8株),所有幼苗先在正常硫浓度营养液 (1 mmol/L,S1) 中生长 2 天,以适应水培环境,2 天后分为正常硫供应 (S1) 和缺硫 (0.02 mmol/L,S0.02) 2 个处理培养。缺硫处理营养液配方中,微量元素和大量元素A试剂与正常硫供应营养液浓度相同,大量元素C试剂中,以MgCl2·6H2O 代替 MgSO4·7H2O 使各处理 Mg2+含量相同,具体如表1所示 (正常硫供应营养液由微量元素、大量元素A和大量元素B试剂组成,缺硫营养液由微量元素、大量元素A和大量元素C试剂组成)。每7 天更换一次营养液,气泵昼夜不间断通气。玻璃温室最大光照强度653 μmol/(m2·s),白天温度控制在18℃~30℃,夜间温度控制在15℃~18℃。缺硫营养液中栽培17 天 (小白菜长至9~10片真叶) 时进行外源喷施硫处理。试验共设置正常供硫+喷施蒸馏水对照 (CK);缺硫处理下,分别喷施蒸馏水 (H2O)、喷施 25 mg/L GSH (GSH)、喷施 25 mg/L GSSG (GSSG),共4个处理。处理时,小白菜叶表面和背面均需喷施,使叶片上的水珠呈饱和状态。试验采用完全随机区组排列,每个处理重复4次,每个重复3株。分别在处理0、2、4、8、24 h取样测定基因表达量,在处理0、24、48、72 h取样测定物质含量及酶活性等生理指标,挑选健康无病害的植株,用锡箔纸包0.3 g干净新鲜的叶片,液氮冷冻后,保存在–80℃冰箱待测。

表 1 营养液配方Table 1 Composition of nutrient solution
1.2 测定方法
1.2.1 RNA提取、质量检测以及反转录合成cDNA总RNA采用Trizol法提取,氯仿、异丙醇萃取分离,质量检测及反转录合成cDNA均采用TaKaRa公司试剂盒,具体步骤参照何超超[17]的方法。
1.2.2 定量引物的设计以及基因表达量的测定 根据已发表的大白菜 (Bra03675) 和拟南芥(AT4G23100) 的GSH1基因序列,利用Primer Premier 5.0软件设计特异性定量引物,上下游引物分别为:GCTTATGTTAGCTCCTACTCC和TATCC TCCATTTGTCCTTT,以白菜肌动蛋白基因 (ACTIN)为内参基因,上下游引物分别为:CGCTTAACCCG AAAGCTAAC和TACGCCCACTAGCGTAAAGA。荧光定量 PCR 反应体系:TB Green 10 μL,上游引物 0.4 μL,下游引物 0.4 μL,cDNA 模板 1.6 μL,灭菌水 7.6 μL。PCR 扩增条件:95℃ 30 s (预变性);95℃ 5 s,60℃ 30 s (40 个循环);95℃ 5 s,60℃ 30 s(Melt Curve)。用 2−△△Ct法计算基因表达量。
1.2.3 GSH 合成酶 γ-ECs活性的测定 γ-ECs 活性的测定采用上海闳巨实业有限公司提供的试剂盒,用酶标仪在450 nm波长下测定吸光值,计算样品活性。
1.2.4 GSH和 GSSG含量的测定 GSH和GSSG含量测定采用南京建成生物工程研究所的试剂盒。按照说明书步骤用酶标仪测定405 nm吸光值,计算GSH和GSSG含量。
1.2.5 GSH代谢酶GR、GPx、GST等活性的测定GR活性的测定采用王绍娴[34]的方法并进行改进。取上述酶液 100 μL,依次加入 25 mmol/L 的 PBS (含0.2 mmol/L EDTA,pH 7.0) 1.7 mL,10 mmol/L 的GSSG 100 μL,最后加入 2.4 mmol/L 的 NADPH 100 μL,混匀后快速转入2.5 mL比色皿中,动力学方法测定340 nm波长下吸光值,计算其活性。
GPx活性的测定采用何超超等[17]的方法并进行改进。取上述酶液 200 μL,依次加入 25 mmol/L PBS(含 0.2 mmol/L EDTA,pH 7.0) 380 μL,1.14 mol/L NaCl 100 μL,5 mmol/L GSH 100 μL,2 mmol/L NADPH 100 μL,2.5 mmol/L H2O2100 μL,25 U/mL GR 10 μL,混匀后快速转入 1 mL 比色皿中,动力学方法测定340 nm波长下吸光值,计算其活性。
GST活性测定采用南京建成生物工程研究所的试剂盒。用可见分光光度计在412 nm波长下测定吸光值,计算样品活性。
1.3 数据分析
采用 Excel 2007和SPSS Statistics 19 软件对检测数据进行计算和方差分析,并在0.05水平上进行最小显著差异性检验。
2 结果与分析
2.1 缺硫胁迫下小白菜对外源GSH和GSSG的吸收
如图1A所示,缺硫胁迫下,GSH含量显著低于对照,在处理 0 (处理前)、24、48和72 h分别是对照的87%、62%、86%和64%,GSH含量在外源喷施GSH处理后开始上升,在24 h显著高于H2O处理,随后回落,48 h后开始上升,72 h显著高于H2O处理,达到了H2O处理的1.96倍。外源喷施GSSG处理后,缺硫胁迫下小白菜GSH含量较H2O处理在24—48 h短暂下降后逐渐上升,在处理后72 h显著高于H2O处理,达到了H2O处理的1.4倍。
如图1B所示,缺硫胁迫下,GSSG含量在外源喷施GSH处理后24、48、72 h始终低于对照,其中,处理后24和72 h达到显著水平,分别仅为对照的51%和59%,这可能是由于缺硫胁迫下小白菜吸收了外源喷施的GSH,使细胞维持在还原状态;而GSSG含量在外源喷施GSSG处理后开始上升,在24 h显著高于对照,随后开始下降,在72 h显著低于对照,但和H2O处理没有显著差异,说明小白菜吸收了外源喷施的GSSG,细胞内GSSG含量短暂升高,但高浓度的GSSG被GR催化还原成GSH,GSSG含量下降。
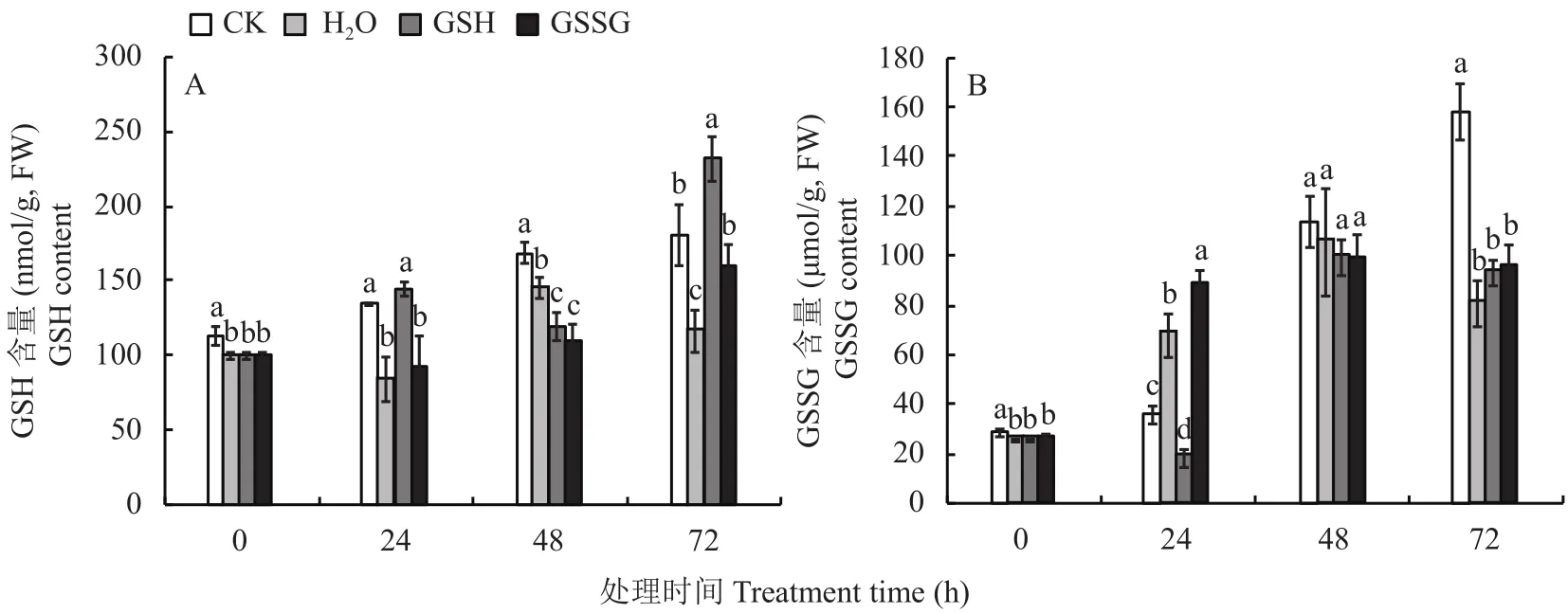
图 1 外源GSH和GSSG对缺硫胁迫下小白菜GSH和GSSG含量的影响Fig.1 Effects of exogenous GSH and GSSG on the content of GSH and GSSG in pakchoi under sulfur deficiency
2.2 外源GSH对缺硫胁迫下小白菜GSH合成的影响
2.2.1 外源GSH对缺硫胁迫下小白菜BcGSH1表达的影响 在 0 h (处理前) 以及 25 mg/L 外源GSH和GSSG分别处理缺硫胁迫下小白菜24 h内的BcGSH1基因表达量见图2A,缺硫胁迫下小白菜BcGSH1表达量在2和4 h与对照没有显著差异,但在0、8、24 h显著低于对照,仅为对照的35%、51.9%和28.3%。外源喷施25 mg/L GSH后,缺硫胁迫下小白菜BcGSH1表达量显著上升,在处理后4、8和24 h分别达到了H2O处理的3.51、3.64和4.08倍。缺硫胁迫下小白菜BcGSH1表达量在外源喷施 25 mg/L GSSG 后 4 h 开始上升,在 8和24 h分别达到了H2O处理的4.38和5.79倍。
2.2.2 外源GSH对缺硫胁迫下小白菜叶片γ-ECs活性的影响 图2B显示,缺硫胁迫下,γ-ECs活性在0、24、48和72 h均显著低于对照,在外源喷施GSH处理后,γ-ECs活性呈先上升后下降的趋势,在处理后24和48 h分别比H2O处理增加了44%和40%,但在处理后72 h与H2O处理差异不显著;外源GSSG处理后,缺硫胁迫下小白菜γ-ECs活性先上升后下降,仅在处理48 h显著高于H2O处理,达到了H2O处理的1.4倍,在处理后72 h和H2O处理没有显著差异。

图 2 缺硫胁迫下喷施GSH和GSSG后不同时间小白菜BcGSH1表达量和γ-ECs活性Fig.2 Relative expression of BcGSH1 and activity of γ-ECs in pakchoi at different time after foliar spraying GSH and GSSG under sulfur deficiency
2.3 外源GSH对缺硫胁迫下小白菜GSH代谢的影响
如图3A所示,缺硫胁迫下,GR活性显著低于对照,在 0 h (处理前)、处理 24、48和72 h分别是对照的54%、75%、55%和69%。GR活性在外源喷施GSH处理后开始上升,在24、48、72 h 3个时间点都显著高于H2O处理,分别达到了H2O处理的1.42、1.97和1.44倍;同样,外源喷施GSSG处理后,GR活性持续上升,在24、48、72 h 3个时间点都显著高于H2O处理,分别达到了H2O处理的1.60、1.75和1.77倍;说明缺硫胁迫显著降低了小白菜GR活性,外源喷施GSH和GSSG能够提高GR活性,在一定程度上提高了小白菜的还原能力。
如图3B所示,缺硫胁迫下,GPx活性显著高于对照,这可能是由于缺硫胁迫对小白菜造成了氧化损伤,GPx活性增强,催化GSH与ROS反应,以减轻ROS对小白菜的损伤。外源喷施GSH 24 h后,缺硫胁迫下小白菜GPx活性开始持续上升,在处理后48和72 h达到H2O处理的1.3和1.2倍,这可能是缺硫胁迫下小白菜吸收了外源GSH,细胞内GSH含量增加,有足够多的GSH以供GPx催化来清除ROS以应对缺硫胁迫。外源喷施GSSG后,GPx活性反而下降,在处理后72 h仅为H2O处理的62%。
如图3C所示,缺硫胁迫下,GST活性显著低于对照,在处理 0 (处理前)、24、48和72 h 仅为对照的58%、48%、67%和64%,这可能是由于缺硫胁迫下,GSH含量较低,缺乏GSH参与解毒过程,因此GST活性较低。外源喷施GSH后,缺硫胁迫下小白菜GST活性开始上升,在24、48、72 h 3个时间点都显著高于H2O处理,分别比H2O处理增加了37%、42%、50%,说明缺硫胁迫下小白菜吸收了外源喷施的GSH,GSH含量上升,导致GST活性增强,催化GSH合成其他络合物;同样,GST活性在外源GSSG处理后开始上升,在24、48、72 h 3个时间点都显著高于H2O处理,分别达到了H2O处理的1.48、1.27和1.52倍,这可能是缺硫胁迫下小白菜吸收了外源喷施的GSSG后,GSSG被GR还原成GSH,高浓度的GSH供GST催化参与代谢。
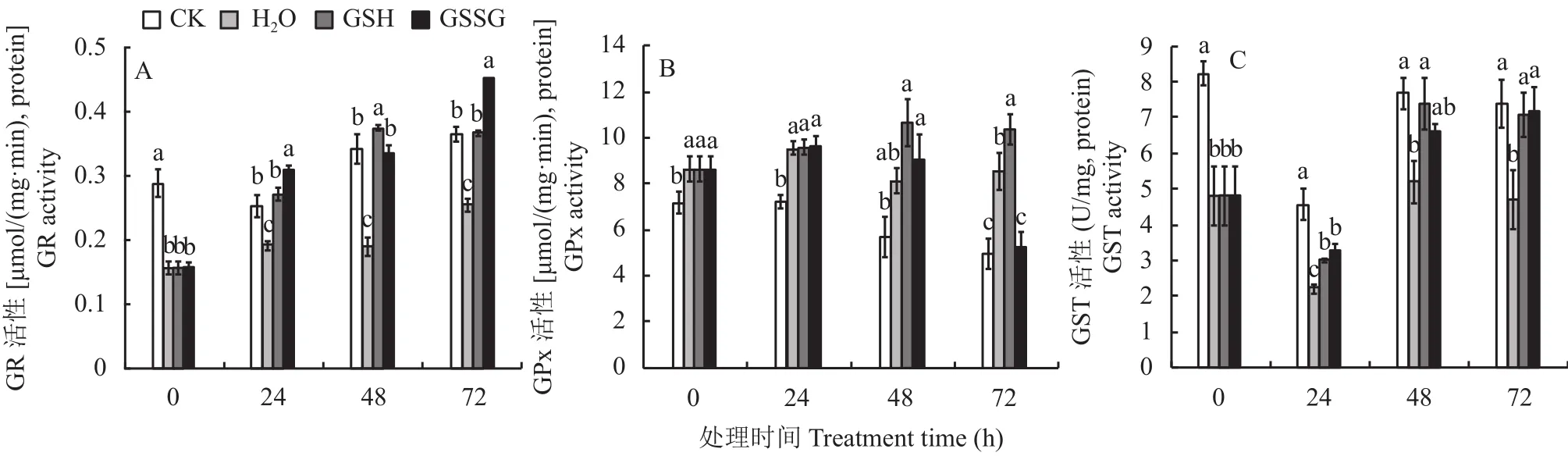
图 3 外源GSH和GSSG对缺硫胁迫下小白菜GR、GPx和GST活性的影响Fig.3 Effects of exogenous GSH and GSSG on the activity of GR, GPx and GST in pakchoi under sulfur deficiency
3 讨论
硫是植物生长发育过程中所必需的营养元素,缺硫将阻碍植物体内蛋白质合成,限制植物生长,导致植物对病虫害的抵抗力以及逆境胁迫的耐受性降低,影响农作物的产量与利用价值[35-37]。GSH在清除ROS、还原硫的储存和转运、调节酶活性、调节植物对氧化还原敏感信号的传导[10-13]、抵抗各种逆境胁迫 (重金属、干旱、盐胁迫、病菌侵染) 等方面都发挥着重要作用[14-17,28]。本试验结果发现,缺硫胁迫会显著降低小白菜GSH合成基因BcGSH1表达量、γ-ECs活性、GSH含量以及GSH关键代谢酶GR和GST的活性,但会引起GPx活性显著增强,说明缺硫胁迫下,硫酸盐缺乏,进入小白菜初生硫代谢的合成原料减少,小白菜谷胱甘肽合成关键基因BcGSH1表达量降低,GSH合成关键酶γ-ECs活性降低,GSH合成受阻,GSH含量显著降低,小白菜ROS清除能力降低,GR活性下降,以GSH为底物的GST活性也随之降低,而GPx活性增强,催化GSH反应生成GSSG,清除机体内的H2O2、过氧化物及脂质过氧化物,保护机体不被ROS进一步损伤。袁园园[38]在水稻缺硫胁迫应答机理研究中发现,缺硫处理15天后,水稻幼苗GSH含量、POD、CAT、SOD活性显著下降;高可辉等[39]在水稻幼苗上开展的缺硫处理相关研究发现,缺硫处理7天后,水稻幼苗GSH含量显著下降,以GSH为底物的GST活性也随之下降,而在缺硫预处理加镉胁迫处理的水稻幼苗中,GST活性则大幅上升,催化GSH与镉结合,具备了GPx的抗氧化功能,为镉胁迫带来的氧化胁迫缓解提供了一条途径;Wyrwicka等[40]在酸雨处理对黄瓜叶片抗氧化酶活性的影响研究中发现,黄瓜受到酸雨胁迫的第5天,GPx活性较低,GST活性显著提高,GPx和GST同为GSH代谢中的保护酶,变化恰好相反,可能二者之间存在代谢补偿机制。此外,虽然GPx和GST都有清除过氧化物的功能,GPx催化还原H2O2和有机氢过氧化物,而GST则不能分解H2O2,只能催化GSH的巯基与一些亲电子类物质结合[41],因此,缺硫胁迫下GSH含量降低,以GSH为底物的GST活性也降低。
在外源喷施25 mg/L的GSH后,缺硫胁迫下小白菜GSH合成关键基因BcGSH1表达量和GSH合成关键酶γ-ECs活性升高,GSH含量短暂上升后下降,随后又上升,在72 h显著高于H2O处理(图1A),说明缺硫胁迫下的小白菜吸收了外源GSH,小白菜体内GSH含量恢复后,开始参与正常代谢而被消耗,GSH含量下降,48~72 h,胁迫得到缓解或者消失后,GSH含量开始恢复,在72 h显著高于H2O处理。缺硫胁迫下小白菜GR、GPx和GST活性在外源GSH处理后随着时间的延长持续升高 (图3),其中,GR和GST活性始终高于H2O处理,且GST活性在48和72 h与对照没有显著差异 (图3A和B),说明外源喷施GSH能够作为硫素来源补充小白菜体内的GSH,提高抗氧化酶活性,短暂缓解缺硫胁迫对小白菜造成的氧化损伤。在外源GSH处理48h时,GR活性显著高于H2O处理,GR可以将GSSG还原成GSH,而GSSG含量无差异,GSH含量下降,这可能是由于缺硫胁迫也会导致氧化损伤,虽然GR活性升高能够合成更多的GSH,GSH除了直接清除ROS自由基,还参与了由抗坏血酸-GSH循环、GSH氧化物循环等清除ROS自由基[42],因此GSH大量消耗,含量下降,胁迫得到缓解或者消失后,GSH含量开始恢复,在72 h显著高于H2O处理。于威等[13]对自毒作用下嫁接黄瓜幼苗的研究发现,施加适宜浓度的GSH能够增强黄瓜幼苗抗氧化酶活性,提高抗氧化剂含量,缓解ROS对细胞造成的伤害。鲁丽丽等[43]对二色补血草的研究表明,外源GSH处理可以明显增强NaCl胁迫下补血草SOD、CAT、GR和APx活性,提高GSH含量,降低膜脂过氧化水平,缓解盐胁迫对补血草造成的伤害。周艳等[44]的研究表明,NaCl胁迫下,番茄幼苗叶片抗氧化酶SOD、CAT和APx活性在外源喷施GSH后上调,GSH提高了番茄幼苗植株渗透调节能力及清除ROS的酶促系统的防御能力,能够保护膜结构和功能的完整性,从而有效缓解盐胁迫对番茄幼苗生长的抑制。
在外源喷施25 mg/L的GSSG后,缺硫胁迫下小白菜BcGSH1表达量在处理4 h后开始上升,γ-ECs活性在处理24 h后开始上升,而GSH含量在处理24 h后开始下降,48 h显著低于对照,随后上升(图1),这可能是外源喷施的GSSG加剧了小白菜细胞内缺硫胁迫造成的氧化损伤,细胞内GSH被消耗,而高浓度的GSSG在GR催化下还原成GSH,以维持细胞内GSH库在还原状态。缺硫胁迫下小白菜GSSG含量在处理开始后上升,24 h显著高于对照,随后回落,GR和GST活性开始持续上升,始终高于H2O处理,其中GR在48 h与对照一致,24和72 h显著高于对照,GST活性在48和72 h与对照一致,而GPx活性在GSSG处理开始后没有显著变化,在48 h后开始下降,说明外源GSSG处理后,缺硫胁迫下的小白菜吸收了外源GSSG,细胞内GSSG含量升高,缺硫胁迫造成的氧化状态加剧,诱导GR和GST活性升高,GR催化GSSG转化为GSH,而GPx活性下降,减少催化GSH转化为GSSG,以维持GSH库在还原状态。陈鹏等[45]在外源抗氧化剂处理降解番茄体内残留百菌清的研究中发现,外源GSSG预处理显著增加了百菌清处理后番茄叶片GSSG含量,也促进植株GSH的合成与积累,同时还有效的激发了GR的活性,但是,番茄叶片百菌清残留量和ROS含量均与对照没有显著差异,很有可能是由于外源GSSG处理没有激发植物体内部GSH相应的解毒机制。刘会芳等[46]发现外源喷施GSSG虽然造成盐胁迫下番茄幼苗叶片内源GSSG的大量积累,但其诱导了AsA-GSH 循环关键酶活性提高,进而能够在一定程度上缓解番茄幼苗所遭受的盐胁迫。
4 结论
缺硫胁迫显著降低了小白菜BcGSH1表达量、GSH含量及γ-ECs、GR和GST活性,诱导GPx活性增强。外源喷施适宜浓度的GSH和GSSG可以补充小白菜内源GSH和GSSG,小白菜体内GSH和GSSG含量上升后,开始缓解缺硫胁迫而参与代谢被消耗;胁迫得到缓解或者消失后,GSH含量开始恢复上升。外源喷施GSH还会诱导细胞内GSH代谢3个关键酶GR、GPx和GST活性增强;而外源喷施GSSG则诱导GR和GST活性增强,GPx活性降低,维持细胞不被继续氧化,缓解因缺硫胁迫对机体造成的损伤。

