γ-Fe2O3纳米材料与甲基营养型芽孢杆菌对大豆生长及产量的协同促进机制
张辰弛,马扬旸,曹雪松,王震宇
(环境过程与污染控制研究所/江南大学环境与土木工程学院,江苏无锡 214122)
全球人口数量预计到2050年将达到97亿,届时为满足全球人口需求,粮食产量需达到约148亿t[1-2]。据联合国粮农组织 (FAO) 统计,全球近三分之一的土地已用于农耕[3]。在有限的耕地面积内,为进一步满足粮食需求,化肥的使用已经成为农业生产中必不可少的手段之一,自20世纪60年代以来,全球化肥用量逐年攀升,预计至2030年全球化肥使用量将达到2.23亿t[4]。然而传统肥料约60%~90%未能被植物利用[5],随挥发、降雨或灌溉流失[1, 6]。进而引起一系列环境问题,如:土壤肥力的普遍退化[7],水体富营养化[8]以及温室气体的大量排放[9]。因此,开发一种高效、绿色、可持续利用的新型肥料已经成为当前亟待解决的问题。随着纳米技术的迅速发展,以纳米材料为原料的纳米肥料在解决以上问题中展现出巨大应用前景[10]。Kah等[1]利用Meta分析整合了79篇纳米农用的文章,结果发现纳米肥料相对于传统肥料增效20%~30%。
铁是植物生长发育过程中的必需微量元素[11],直接或间接参与植物体内众多的生理生化功能[12]。尤其值得注意的是铁在植物叶绿素合成过程及光合作用的电子传递过程中扮演重要角色。植物缺铁会降低作物光合作用效率,进而导致作物减产[13]。土壤中的铁含量约为20~40 g/kg[14],然而土壤溶液中有效铁的总浓度约为10−10mol/L[15],比植物最佳生长浓度低104~105倍,尤其在石灰性、pH高和重碳酸盐含量高的土壤中,植物可利用铁含量更低[16],难以满足作物正常生长的需求[17]。据统计,全世界约30%的耕地存在缺铁现象[18]。关于纳米铁肥对种子萌发及作物生长的影响目前已有研究,Rui等[19]研究发现,土壤施用 2、10、1000 mg/kg γ-Fe2O3NPs后,花生叶片中叶绿素含量有一定提高;Hu等[20]研究发现,柑橘幼苗经 50 mg/L γ-Fe2O3NPs 处理后,叶绿素含量相较于对照组提升23.2%;Alidoust等[21]研究发现,叶面施用纳米氧化铁比土壤施用更加有效,对植物光合作用促进效果明显。然而纳米氧化铁的叶际应用仍存在一定局限性,纳米颗粒在叶面通过角质层间隙或气孔进入植物体内[22],由于纳米氧化铁形成尺寸较大的团聚体,限制了其生物可利用性,因此,减少纳米材料的团聚对提高其生物可利用性具有重大意义。当前研究有关叶面施用纳米氧化铁对植物生长促进作用机制较少,因此,氧化铁纳米材料对作物的促生效应与机制仍需进一步研究。
甲基营养型芽孢杆菌 (Bacillusmethylotrophicus)作为一种性能优良的植物促生菌,对植物生长和增产有直接或间接促进作用[23]。Radhakrishnan等[24]研究发现,芝麻叶面接种甲基营养型芽孢杆菌后,叶绿素含量提高约60%,籽粒蔗糖含量提高约50%,这可能与甲基营养型芽孢杆菌代谢物中的赤霉素与吲哚乙酸有关。同时,甲基营养型芽孢杆菌代谢产物中含有脂肽[25]。脂肽在纳米颗粒的制备过程中作为生物表面活性剂展现出良好的稳定性和分散性[26]。叶际环境中水分和养分相对较少,微生物生长受到一定限制,因此制约了植物促生菌在农业上的应用。纳米氧化铁由于自身高比表面积以及磁性能可以通过对微生物的固定作用[27],提高其在叶面定殖能力。然而,目前关于纳米氧化铁与植物促生菌共同叶面施用,对作物生长的联合作用效果研究较少,其影响机制尚不明确。
大豆作为世界性五大主栽作物之一,每年因缺铁造成大豆减产的直接经济损失巨大[28]。本研究以大豆为受试植物,主要开展以下3方面研究内容:1) γ-Fe2O3NMs促进作物生长、提高作物产量的最优施用浓度及机制;2) γ-Fe2O3NMs 与植物促生菌 (甲基营养型芽孢杆菌) 共施用对作物生长及产量的协同作用效能;3) γ-Fe2O3NMs与甲基营养型芽孢杆菌对作物协同作用机制。该研究旨在揭示纳米材料与有益菌对作物的协同促生机制,为纳米材料在农业生产中的应用提供新思路及基础理论支撑。
1 材料与方法
1.1 试验材料
氧化铁纳米材料 (γ-Fe2O3NMs)购自 US Research Nanomaterials (Houston,TX,USA),纯度大于99.9%。
供试大豆品种为‘中黄13’。盆栽试验用土取自江苏省无锡市江南大学,土壤pH 7.8,土壤悬液电导率为594.67 μS/cm,以二乙烯三胺五乙酸(DTPA) 作为浸提液,测定土壤中有效铁含量5.25 mg/kg、土壤全磷含量674.14 mg/kg、全钾含量13.85 g/kg、土壤最大持水量16%。
供试微生物为甲基营养型芽孢杆菌 (Bacillus methylotrophicus),菌种保藏号为“CCTCCAB2014337”。以LB液体培养基作为甲基营养型芽孢杆菌培养基,将生长2~3天的甲基营养型芽孢杆菌菌液0.5 mL接种于装有4.5 mL液体培养基的试管中。在温度为29℃、转速为180 r/min的恒温震荡培养箱培养36 h,之后采用分光光度计测定菌液的OD值。菌液OD600值在0.82~0.84,菌液浓度约为1×108CFU/mL,纳米颗粒在紫外光灭菌后加入无菌培养基用于制作不同浓度γ-Fe2O3NMs培养基。
1.2 盆栽试验
盆栽用土包含 1.2 kg 河沙、1.2 kg 大颗粒土 (粒径 2~1 cm) 以及 3.6 kg 小颗粒土 (粒径小于 2 mm)。河沙和大颗粒土的使用是为避免土壤板结,透气性不足,从而限制根系生长[29]。种植前,每盆施基肥(尿素 2.0 g、氯化钾 0.5 g、磷酸二氢铵 1.0 g)。
大豆种子用H2O2浸泡5 min消毒并用去离子水清洗[30]。消毒后的种子在黑暗潮湿条件下25℃培育3天,出芽后移栽至盆中继续培育,分别在大豆生长的第三叶期 (V3)、第四叶期 (V4)、第五叶期 (V5)、开花期 (R1)、盛花期 (R2)、结荚期 (R3),分别用不同浓度纳米悬液、菌液以及纳米加菌悬液进行6次叶面喷施,于移入土后95天进行采样。试验共设10个处理:对照处理 (CK,叶面喷施超纯水);纳米材料处理组设置 0、1、10、30和50 mg/L 5 个浓度梯度处理;纳米材料与甲基营养型芽孢杆菌复合处理组中包含甲基营养型芽孢杆菌悬液以及对应每个纳米颗粒浓度,其中,不施γ-Fe2O3NMs的甲基营养型芽孢杆菌处理以BM表示。每个处理设5次重复。每次每株喷施10 mL悬液,喷施过程中土壤表面覆膜避免污染。叶施在上午8:00—9:00进行,此时植物气孔处于开放状态,喷施后12 h保持叶面湿润,避免溶液的蒸发导致纳米氧化铁在叶表面沉积。
1.3 测定方法
1.3.1 材料表征 称取 0.1 mg γ-Fe2O3NMs 将其分散在10 mL Milli-Q超纯水中,保持低温水浴超声震荡30 min,取20 μL悬液滴于洁净的双联镍网,待自然风干后,用透射电子显微镜 (TEM,JEM-2100,Japan) 于 200 kV 下观察 γ-Fe2O3NMs 形态和粒径。水力学直径和Zeta电位用纳米粒度仪 (Malvern Instrument Inc.,UK) 测定。
1.3.2 γ-Fe2O3NMs 对甲基营养型芽孢杆菌菌落数和菌落形态的影响 γ-Fe2O3NMs经紫外灭菌后,制备成 1、10、30、50 mg/L γ-Fe2O3NMs液体培养基与固体培养基。将甲基营养型芽孢杆菌在不同浓度γ-Fe2O3NMs液体培养基中培养36 h,利用紫外分光光度计测定菌液600 nm处的吸光值 (OD600)。同时将未添加γ-Fe2O3NMs的LB液体培养基中培养36 h的甲基营养型芽孢杆菌菌液稀释2×106倍后均匀涂布于含有不同浓度 γ-Fe2O3NMs (0、1、10、30、50 mg/L)的固体培养基上,于29℃微生物培养箱 (Thermo IGS100) 中继续培养36 h后,观察菌落数及菌落形态。
1.3.3 植株生物量与产量 试验以大豆地上部、地下部以及豆荚干重作为植株生物量。干重采用称重法,用万分之一电子天平 (OHAUS,上海) 称量,干重为鲜样在115℃杀青15 min,70℃烘干48 h至恒重后称量。为保证籽粒的完整性,称量时选择带荚称重的方式。播种95天后,将大豆根部完整取出,利用蒸馏水清洗干净,根尖数采用根系扫描仪WinRHIZO Pro 2017 b (Regent Instruments Inc.,Canada)进行分析。
1.3.4 光合作用参数 叶绿素含量用乙醇浸提法[31]测定,采样后选择第6复叶中间叶片,去除主叶脉,组织研磨仪粉碎后称量 20 mg,加入 5 mL 95 %乙醇溶液后,避光静置24 h,在紫外分光光度计波长665、649、470 nm下测定,根据吸光值计算叶绿素含量。净光合速率、蒸腾速率由便携式光合测定系统 (CIRAS-3,PP-Systems,USA) 于大豆生长第40天,在顶端3个复叶中间叶片上原位测定。
1.3.5 总碳水化合物 采样后选择叶片、籽粒、根的干样,组织研磨仪粉碎后称量,利用蒽酮比色法[32]测定总碳水化合物含量。
1.3.6 γ-Fe2O3NMs团聚体直径 甲基营养型芽孢杆菌接种于LB培养基中,29℃培养36 h,高速离心后取上清液作为发酵液。以发酵液和LB培养基为溶剂制备 3 mg/L γ-Fe2O3NMs 悬液后稀释 1000 倍,用于单颗粒电感耦合等离子体质谱 (SP-ICP-MS,iCAP-TQ,Thermo Fisher,Germany) 分析。
1.3.7 吲哚乙酸 (IAA) 甲基营养型芽孢杆菌代谢产物中IAA含量用Salkowki比色法[33]测定。LB液体培养基接种甲基营养型芽孢杆菌后29℃培养36 h,离心后取上清液,0.22 μm聚醚砜水相滤膜过滤后与Salkowki溶液按比例1∶1混合,于530 nm波长下比色测定。
1.3.8 养分含量 采样后选择叶片、籽粒、根的干样,组织研磨仪粉碎后称量25 mg,加入5 mL HNO3后冷却,待样品冷却至室温后使用微波消解仪(MARS 6,CEM,USA) 115℃ 消解 45 min,消解液稀释定容后使用电感耦合等离子体质谱 (ICP-MS,iCAP-TQ,Thermo Fisher,Germany) 仪测定各元素含量[34]。
1.4 数据分析
采用Excel 2016和SPSS 15.0软件进行数据统计分析,使用最小显著差异 (least significant difference,LSD) 检验法进行多重比较 (P< 0.05 为差异显著)。
2 结果与分析
2.1 γ-Fe2O3 NMs的表征
透射电镜图显示,γ-Fe2O3NMs主要呈椭圆形或圆形,粒径主要分布在 10~30 nm (图 1)。10、20、50 mg/L γ-Fe2O3NMs水力学直径与 Zeta 电位见表 1。水力学直径随γ-Fe2O3NMs浓度上升而增加,Zeta电位绝对值随着γ-Fe2O3NMs浓度增加而降低,这可能是由于γ-Fe2O3NMs自身较高的比表面积或磁性能导致团聚[27]。

图 1 γ-Fe2O3 NMs的透射电镜图Fig.1 Transmission electron microscopy (TEM) image of γ-Fe2O3 NMs

表 1 不同浓度γ-Fe2O3 NMs的水力学直径与Zeta电位Table 1 Hydrodynamic diameter and ζ-potential of γ-Fe2O3 NMs under different concentrations
2.2 γ-Fe2O3 NMs浓度对甲基营养型芽孢杆菌生长的影响
如图2所示,γ-Fe2O3NMs浓度对菌落数目影响不大,但 γ-Fe2O3NMs浓度在 10~50 mg/L 时,单菌落直径较空白对照组及 1 mg/L γ-Fe2O3NMs处理组明显增加。相较于空白对照组和 1 mg/L γ-Fe2O3NMs处理组,10~50 mg/L γ-Fe2O3NMs处理组甲基营养型芽孢杆菌菌液OD600吸光值显著增加 (图2),这表明γ-Fe2O3NMs能够促进甲基营养型芽孢杆菌的生长。

图 2 γ-Fe2O3 NMs浓度对甲基营养型芽孢杆菌菌落生长及甲基营养型芽孢杆菌菌液OD600吸光值的影响Fig.2 Effect of concentrations of γ-Fe2O3 NMs on the growth of Bacillus methylotrophicus and OD600 values of Bacillus methylotrophicus suspensions
2.3 γ-Fe2O3 NMs浓度对大豆生理特征和碳水化合物的影响
从图 3 可以看出,30和50 mg/L γ-Fe2O3NMs处理显著增加了大豆叶中叶绿素含量,γ-Fe2O3NMs显著提高了大豆叶面的净光合速率及蒸腾速率。图4显示,30 mg/L γ-Fe2O3NMs施用后,大豆叶片中总碳水化合物含量相较于其他处理显著上升;施用γ-Fe2O3NMs后,籽粒中总碳水化合物含量均有一定程度的增加,其中10、30、50 mg/L浓度下增加显著。这表明,γ-Fe2O3NMs能够促进大豆光合作用,提高大豆光合产物的累积,进而促进大豆生长及产量提升。

图 3 叶面施用γ-Fe2O3 NMs对大豆叶片叶绿素含量、净光合速率、蒸腾速率的影响Fig.3 Effects of foliar application of γ-Fe2O3NMs on the chlorophyll content, net photosynthetic rate,and transpiration rate of soybean
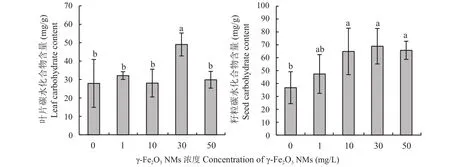
图 4 叶面施用γ-Fe2O3 NMs对大豆叶片和籽粒总碳水化合物含量的影响Fig.4 Effects of foliar application of γ-Fe2O3 NMs on the carbohydrate content in soybean leaves and seeds
2.4 γ-Fe2O3 NMs与甲基营养型芽孢杆菌配施对大豆生长及产量的影响
如图5所示,叶面施用γ-Fe2O3NMs增加了作物地上部及地下部干重,并提高了大豆产量。施用10、30、50 mg/L γ-Fe2O3NMs 处理明显增加了大豆地下部干重 ; 1、10、30、50 mg/L γ-Fe2O3NMs 处理显著提高了大豆地上部干重;30和50 mg/L γ-Fe2O3NMs处理显著提高了大豆产量。以上结果表明,30 mg/L为 γ-Fe2O3NMs的最优施用浓度。
单独施用甲基营养型芽孢杆菌对大豆生物量及产量没有明显的影响 (图 5),结合 γ-Fe2O3NMs 施用后,明显增加了大豆的地下部及地上部干重。其中,30和50 mg/L γ-Fe2O3NMs配合甲基营养型芽孢杆菌处理组大豆产量较单施γ-Fe2O3NMs分别增加了 31.5%和13.4%。这表明,30、50 mg/L γ-Fe2O3NMs既能够促进大豆生长、增加大豆产量,又可以提高促生菌对大豆生长的调节作用。
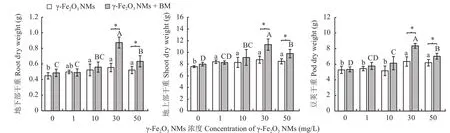
图 5 叶面喷施不同浓度γ-Fe2O3 NMs对大豆地下部、地上部和豆荚干重的影响Fig.5 Effects of foliar application of different concentrations of γ-Fe2O3 NMs on the dry weight of soybean root, shoot and pod
2.5 γ-Fe2O3 NMs与甲基营养型芽孢杆菌协同促生效应
为探究γ-Fe2O3NMs与甲基营养型芽孢杆菌协同促生机制,将γ-Fe2O3NMs加入LB培养基与36 h培养的甲基营养型芽孢杆菌发酵液中,稀释至相同倍数。SP-ICP-MS结果 (图6) 显示,发酵液中平均团聚体粒径约为135.52 nm,明显低于LB培养基中的159.19 nm。这表明甲基营养型芽孢杆菌发酵液明显降低了γ-Fe2O3NMs的团聚作用,提高了其生物可利用性。

图 6 γ-Fe2O3 NMs在LB培养基中与甲基营养型芽孢杆菌发酵液中的粒径分布比较Fig.6 Comparison of the particle size distribution of γ-Fe2O3 NMs in LB medium and Bacillus methylotrophicus broth
甲基营养型芽孢杆菌的代谢物中含有IAA,其可被作物利用,进而促进作物生长[35]。不同浓度γ-Fe2O3NMs 处理 36 h 后,10、30、50 mg/L γ-Fe2O3NMs显著提高了甲基营养型芽孢杆菌发酵液中IAA的浓度,使其浓度从3.8 mg/L增加至7.6~8.8 mg/L(图 7)。

图 7 不同浓度γ-Fe2O3 NMs暴露36 h后对甲基营养型芽孢杆菌发酵液中IAA浓度的影响Fig.7 IAA concentration produced by Bacillus methylotrophicus after exposure to different concentrations of γ-Fe2O3 NMs for 36 h
如图8所示,γ-Fe2O3NMs对大豆新根的形成影响较小,甲基营养型芽孢杆菌可显著促进大豆新根的形成,二者配合施用则进一步促进了大豆新根的形成。

图 8 叶面喷施不同浓度γ-Fe2O3 NMs对大豆单株根尖数的影响Fig.8 Soybean root tips per plant after foliar application of different concentrations of γ-Fe2O3 NMs
表2显示,施用30与50 mg/L浓度γ-Fe2O3NMs后,大豆地下部铁含量显著高于对照组与低浓度γ-Fe2O3NMs处理组,但铁在植物体内迁移性较差[11],这可能是由于高浓度γ-Fe2O3NMs处理后显著促进了大豆根系生长,进而加强了根部对营养元素的吸收。另外,已有研究表明,叶面施用纳米颗粒可以通过维管束系统向植物根部运输,因此地下部铁元素含量变化也可能是由于γ-Fe2O3NMs在植物体内的迁移造成[36]。表2表明,叶面施用γ-Fe2O3NMs对大豆P、Ca含量的影响较小;但使S、Mg和Fe、Mn含量明显增加。此外,叶面施用γ-Fe2O3NMs在一定程度上提高了地上部营养元素含量。相较于对照处理,10、30、50 mg/L γ-Fe2O3NMs处理籽粒中铁含量平均提高约50%。施用30 与 50 mg/L γ-Fe2O3NMs后,大豆籽粒中磷元素与钙元素含量同样明显高于对照组与低浓度处理组。图8所示,相较于纳米处理组,与甲基营养型芽孢杆菌配合施用后,根尖数均有明显增加,这将进一步促进大豆根系对营养元素的吸收,表2显示,相较于同浓度纳米处理,大豆各部位各元素含量在加菌处理后均明显增加。
3 讨论
3.1 γ-Fe2O3 NMs对甲基营养型芽孢杆菌生长的影响
与对照组及 1 mg/L γ-Fe2O3NMs处理相比,10、30、50 mg/L γ-Fe2O3NMs处理菌液 OD600吸光值与平板单菌落直径明显增加 (图2)。本研究结果表明,γ-Fe2O3NMs能够促进甲基营养型芽孢杆菌的生长。其主要原因可能为:1) γ-Fe2O3NMs 作为甲基营养型芽孢杆菌的支撑与固定材料,可加快其生长速度,提高细胞活性[27];2) γ-Fe2O3NMs 作为甲基营养型芽孢杆菌生长铁源,为细菌生长、色素合成提供养分,促进细菌代谢生长[37-38]。
3.2 γ-Fe2O3 NMs对大豆生长及产量的影响
在高等植物中,叶绿素是由前体氨基乙酰丙酸(ALA) 形成的,而ALA的合成过程中需要铁氧还原蛋白参与[39]。铁氧还原蛋白作为植物光合作用中光系统Ⅰ(PSⅠ) 的电子传递体,直接影响植物光合作用速率[40]。本次试验中大豆净光合速率相较于对照组显著增加。Alidoust等[21]得到类似研究结果,叶面施用γ-Fe2O3NMs后,净光合速率提高6%,气孔导度提高20%。籽粒中碳水化合物含量的增加可能是由于γ-Fe2O3NMs促进了大豆光合作用速率,进而提高了光合产物 (碳水化合物) 在叶面及籽粒中的累积[41-42]。碳水化合物是大豆果实中重要的营养品质指标[43],γ-Fe2O3NMs不仅提高了大豆的产量,同时也提升了大豆的营养品质。以上结果表明,γ-Fe2O3NMs能够促进大豆光合作用,提高大豆光合产物的累积,进而促进大豆生长及产量形成。
3.3 γ-Fe2O3 NMs与甲基营养型芽孢杆菌叶面配施对大豆生长及产量的影响
本研究中,50 mg/L γ-Fe2O3NMs对大豆生长及产量的促进及提高效果与 30 mg/L γ-Fe2O3NMs差异不显著,其可能原因是:1) 过量施用 γ-Fe2O3NMs,导致其不能被大豆叶面完全吸收。Hong等[44]研究发现,叶面施用CeO2NPs后,叶片中铈浓度在80、160、320 mg/L CeO2NPs处理后并未有显著差异。另外,随着γ-Fe2O3NMs浓度逐渐增大,其悬浮液更易发生团聚 (表 1),大的 γ-Fe2O3NMs 团聚体附着于大豆叶表面,难以被吸收进入大豆体内。2) 高浓度γ-Fe2O3NMs相较于低浓度可能对植物产生一定负面影响。Hu 等[20]发现柑橘经高浓度 (100 mg/L) γ-Fe2O3NMs处理后,植株鲜重低于低浓度 (20 mg/L) 处理的柑橘幼苗,这可能是由于高浓度γ-Fe2O3NMs对植物造成了一定氧化胁迫。单独施用甲基营养型芽孢杆菌对大豆生物量及产量没有明显的影响 (图5)。这可能是由于叶际环境缺少水分及养分,不利于促生菌的生长[45]。
3.4 γ-Fe2O3 NMs与甲基营养型芽孢杆菌协同促生效应
SP-ICP-MS分析结果表明,发酵液中γ-Fe2O3NMs团聚体直径小于LB培养基中γ-Fe2O3NMs团聚体直径。甲基营养型芽孢杆菌代谢产物中含有脂肽[46],这种生物表面活性剂可能是减少γ-Fe2O3NMs团聚的原因。
Idris等[35]研究发现,甲基营养型芽孢杆菌的代谢产物中含有IAA,其可被作物利用,进而促进作物生长。γ-Fe2O3NMs与甲基营养型芽孢杆菌配合施用进一步提高了其对大豆新根形成的促进作用。其可能原因是,甲基营养型芽孢杆菌发酵液中的IAA能够促进植物根系的生长与新根的形成[47]。
γ-Fe2O3NMs与甲基营养型芽孢杆菌配合施用可提高根部对营养元素的吸收(表2),这对植物生长发育具有重要意义。如,硫元素在植物的代谢和发育过程中同样起着举足轻重的作用,不仅是构建蛋白质的必要元素,而且还可作为前体合成谷胱甘肽、辅助因子、基本的维生素等[48]。铁元素参与植物光合作用与呼吸作用中的电子传递过程,与植物体内众多酶的合成相关[49]。锰元素作为植物体内众多酶的催化因子,对植物体内的氧化过程催化至关重要[50]。

表 2 不同处理大豆各器官营养元素含量 (mg/g)Table 2 Contents of nutrient elements in soybean organs under different treatments
籽粒中营养元素的提升对提高大豆营养品质同样具有积极作用,由于人体对大豆中铁蛋白吸收机制与非血红素铁不同,大豆中的铁更易被人体吸收[51];磷元素参与大豆油脂和蛋白质等物质的合成[52];同时已有研究表明,大豆蛋白的摄入可以有效缓解骨质流失,这与大豆蛋白中钙元素含量有关[53]。
4 结论
叶面施用γ-Fe2O3NMs能够提高大豆叶片总叶绿素含量,促进大豆光合作用,提高大豆叶片与籽粒中总碳水化合物含量,进而促进大豆生长,其中γ-Fe2O3NMs浓度为 30 mg/L 处理对于大豆生长促进效果最显著。相较于纳米材料单独施用的对照组,浓度为 30、50 mg/L 的 γ-Fe2O3NMs和甲基营养型芽孢杆菌联合施用增加大豆干重的效果更明显。γ-Fe2O3NMs和甲基营养型芽孢杆菌可作为一种新型环境友好的叶面肥应用于农业生产中。另外,γ-Fe2O3NMs对大豆根系根瘤固氮、大豆体内氮素循环及籽粒中蛋白质积累等的影响机制还需进一步研究。

