β-环糊精/卵白蛋白复合抗冻剂对冻藏过程鲌鱼品质的影响
吕美雯,熊舟翼,张仲李,熊汉国*
(1.华中农业大学 食品科学与技术学院,武汉 430070;2.武汉农业科学技术研究院农产品加工中心,武汉 430200)
鲌鱼(Culteralburnus)是我国优质的淡水鱼类,肉质细嫩、营养丰富,深受消费者的喜爱[1]。目前,我国普遍采用冻藏的方法来保存鲌鱼,但是冻藏过程中脂肪的氧化和冰晶的形成会导致鱼肉组织劣变和肌原纤维蛋白变性。为了延缓冻藏过程中鱼类品质的劣变,常添加4%蔗糖+4%山梨糖醇作为抗冻剂来保护鱼类品质,但这些传统抗冻剂的加入会引起甜味和热量增加,不符合现代消费者的健康需求。因此研究诸如低聚糖类、蛋白类等低甜度、低热量抗冻剂的抗冻效果具有重要意义[2]。β-环糊精(β-CD)是由7个葡萄糖残基构成的低聚糖,其分子中的羟基可以与蛋白质分子的官能团发生反应而抑制蛋白质聚集变性,从而起到食品保鲜的作用[3-4]。Liu等[5]、Walayat等[6]分别研究发现β-CD、OVA作为抗冻剂添加到肌原纤维蛋白中提高了其在冻藏过程中的稳定性,改善了冻藏过程中肌原纤维蛋白的功能特性。卵白蛋白(OVA)是蛋清蛋白(EWP)的主要成分,具有抗氧化、凝胶化等功能特性。已有研究报道OVA与糖类通过静电相互作用形成了稳定的可溶性复合物,同时复合物的抗冻效果与复合物的质量配比、浓度以及溶解性有关[7]。然而对于不同浓度的β-CD/OVA复合物应用到鲌鱼冻藏的抗冻效果却鲜有研究。因此,本研究以β-CD和OVA为抗冻剂原料,通过浊度、透射电子显微镜、粒径、Zeta电位和差示扫描量热仪(DSC)分析来确定两者复合的最佳质量配比。同时通过分析冻藏过程中鱼肉品质下降与肌原纤维蛋白变性的内在联系,探究不同浓度的β-CD/OVA复合物对鲌鱼冻藏期间的抗冻作用,为β-CD/OVA作为复合抗冻剂的应用前景提供了理论依据。
1 材料与方法
1.1 材料与试剂
鲌鱼(Culteralburnus):由湖北省武汉农科院水产研究所提供(规格:2000~2200 g/尾);卵白蛋白(纯度大于90%):购于德国Sigma-Aldrich公司;β-环糊精、磷酸二氢钠、氢氧化钠、氯化钠、三羟甲基氨基甲烷(Tris)、顺丁烯二酸、酒石酸钾钠、硫酸铜、三氯乙酸、氯化钙、硫酸亚铁、钼酸铵、三磷酸腺苷二钠(ATP):购于上海国药集团化学试剂有限公司。
1.2 仪器与设备
XHF-DY均质机 宁波森兹生物技术有限公司;AG-22331型台式离心机 德国艾本德有限公司;722型可见分光光度计 上海精密科学仪器有限公司;Zetasizer Nano-ZS90型粒径电位分析仪 英国马尔文仪器有限公司;JEM-2010 型透射电子显微镜 日本电子株式会社;200PC差示扫描量热仪 德国耐驰有限公司;MR-60 LF-NMR分析仪 上海纽迈电子科技有限公司;J-1500圆二光谱仪 日本岛津有限公司。
1.3 β-CD/OVA复合物配比的确定
1.3.1 复合物样品的制备
将β-环糊精(β-CD)与卵白蛋白(OVA)粉末分别按照4∶1、3∶1、2∶1、1∶1、1∶2、1∶3和1∶4的质量比混合分组,然后溶于去离子水(4 ℃)中并保持混合溶液最终的质量分数为10%,将上述溶液真空冻藏干燥即可得到不同质量比例的β-CD/OVA固体粉末。
1.3.2 浊度测定
用磷酸盐缓冲液(PBS,pH 6.8)分别稀释各组β-CD/OVA至浓度为20 mg/mL,搅拌至充分混匀之后,测定上述各组溶液在600 nm处的吸光值,即为浊度。
1.3.3 透射电子显微镜(TEM)观察
参考文献[8]的方法,用去离子水(4 ℃)分别稀释各组β-CD/OVA至浓度为0.01 mg/mL,然后在透射电子显微镜下观察。
1.3.4 粒径测定
用磷酸盐缓冲液(PBS,pH 6.8)分别稀释各组β-CD/OVA至浓度为5 mg/mL。利用粒径电位分析仪测定上述各组溶液的流体动力学半径,每次循环扫描12次,每次测定之前样品平衡120 s。
1.3.5 Zeta电位测定
用磷酸盐缓冲液(PBS,pH 6.8)分别稀释各组β-CD/OVA至浓度为5 mg/mL。利用粒径电位分析仪测定上述各组溶液的Zeta电位。
1.3.6 差示扫描量热(DSC)测定
称取 6.5 mg样品,压片密封处理进行DSC测试,扫描范围为20~100 ℃,升温速率为 5 ℃/min。
1.4 鲌鱼鱼肉品质的测定
1.4.1 鱼肉样品的制备
将新鲜的鲌鱼宰杀,剔骨并去除头尾后用去离子水(4 ℃)洗净鱼肉,将鱼肉切成长、宽、厚约为3 cm×1 cm×1 cm大小,然后用去离子水(4 ℃)稀释上述确定的最佳配比β-CD/OVA组至溶液的质量分数为0%、2%、4%和6%。将鱼肉浸泡在不同浓度的各组溶液(4 ℃)中60 min,最后将水分沥干在-18 ℃冻藏90 d。
1.4.2 持水性测定
参考文献[9]的方法,并做如下修改:转速4000 r/min,4 ℃条件下离心8 min。
1.4.3 质子密度图像观察
参考文献[10]的方法,并做如下修改:重复时间5000 ms,纵向弛豫时间0.2 ms,选择自旋回波时间0.2 ms。
1.4.4 组织结构观察
参考文献[11]的方法。
1.5 肌原纤维蛋白理化指标的测定
1.5.1 肌原纤维蛋白的提取与含量测定
肌原纤维蛋白的提取参考文献[12]的方法,然后将提取的肌原纤维蛋白分别与2%、4%和6%上述确定的最佳配比β-CD/OVA组的冻干粉末混匀(以蛋白质量为基准),其中0% β-CD/OVA组作为空白组对照,将所有样品在-18 ℃条件下冻藏90 d。取1 g肌原纤维蛋白样品,用0.6 mol/L NaCl溶液(pH 7.0)稀释至25 mL,采用双缩脲法[13]测定提取的肌原纤维蛋白含量,即为盐溶性蛋白含量。
1.5.2 Ca2+-ATPase活性测定
参考文献[14]的方法,并做如下修改:用0.6 mol/L NaCl溶液(pH 7.0)稀释肌原纤维蛋白至5 mg/mL。
1.5.3 二级结构含量测定
参考文献[15]的方法,并做如下修改:肌原纤维蛋白样品浓度调整为1 mg/mL。
1.6 数据分析
所有试验数据使用Origin 2019软件作图,用SPSS 22.0软件进行方差和显著性分析,显著性水平为P<0.05。
2 结果与分析
2.1 β-CD/OVA复合物的浊度分析
β-CD/OVA复合溶液浊度值的变化反映了溶液状态下粒子的溶解分散程度。不同质量比例β-CD/OVA的浊度变化见图1。

图1 不同质量配比对β-CD/OVA浊度的影响Fig.1 Effect of different mass ratios on turbidity of β-CD/OVA
由图1可知,随着OVA比例的增加,体系的浊度先显著下降(P<0.05)后又逐渐增加,同时观察到在组别1∶3中,复合体系的浊度值最小,表明在该比例下溶液中的粒子溶解性最好,相对其他组分散程度最好。
2.2 β-CD/OVA复合物的透射电镜分析
不同质量比例β-CD/OVA的透射电子显微镜变化见图2。
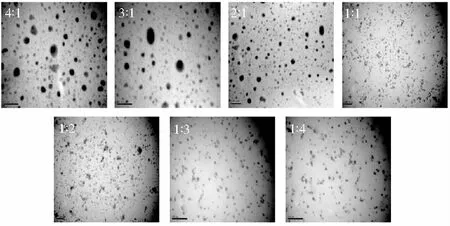
图2 不同质量配比对β-CD/OVA TEM的影响Fig.2 Effect of different mass ratios on TEM of β-CD/OVA
由图2可知,组别为4∶1、3∶1和2∶1的溶液中呈现出较多的聚合态粒子,此时体系中的复合物溶解分散程度较差。但随着OVA比例的增加,溶液中粒子间的聚集程度明显下降,复合物能够均匀地溶解分散在溶液中。尤其是在组别1∶3中没有观察到明显的粒子聚集,呈现较为均匀的分布状态,结果与浊度分析结果一致。
2.3 β-CD/OVA复合物的粒径分析
不同质量比例β-CD/OVA的粒径变化见图3。

图3 不同质量配比对β-CD/OVA粒径的影响Fig.3 Effect of different mass ratios on particle size of β-CD/OVA
由图3可知,随着OVA比例的增加,体系的粒径先显著下降(P<0.05)后又增加。在组别4∶1、3∶1、2∶1、1∶1、1∶2、1∶4中粒径分别为660,562,309,271,121,114 nm,但在组别1∶3中观察到体系的粒径只有91 nm,显著小于其他组别(P<0.05),这可能是由于其他组别的溶液中形成了较大的聚集体,而组别1∶3中形成了小粒径的可溶性复合物,这与透射电镜的观察结果一致,结果表明在组别1∶3的溶液中复合物粒子分布均匀且没有形成聚集。
2.4 β-CD/OVA复合物的Zeta电位分析
β-CD/OVA复合物之间的相互作用力主要是静电相互作用力。不同质量比例β-CD/OVA的Zeta电位变化见图4。
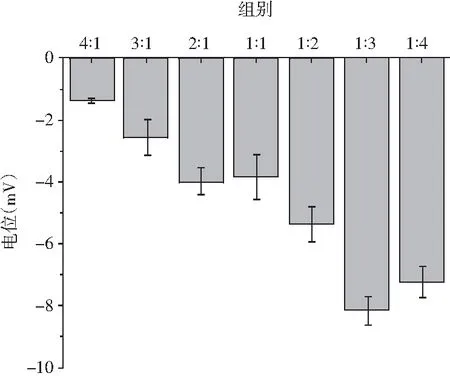
图4 不同质量配比对β-CD/OVA Zeta电位的影响Fig.4 Effect of different mass ratios on Zeta potential of β-CD/OVA
由图4可知,随着OVA比例的增加,电位绝对值先增加后减小,这可能是因为当OVA的比例增加时,OVA带有的负电荷增加了体系的电位绝对值。在组别1∶3中观察到体系的电位绝对值最大(P<0.05),以上结果表明当β-CD与OVA的质量比为1∶3时,β-CD/OVA复合物之间具有较强的静电排斥作用,减少了聚集,同时分子热运动所需克服的能量增大,此时β-CD/OVA复合溶液体系最稳定。
2.5 β-CD/OVA复合物的DSC分析
通过上述分析发现在组别1∶1、1∶2、1∶3和1∶4中β-CD/OVA复合体系的溶解分散程度较好,体系较其他组别相对更稳定。因此,对这4组进行DSC分析来进一步确定β-CD/OVA复合的最佳配比。不同质量比例β-CD/OVA的DSC变化见图5。差示扫描量热图中峰向上代表的是吸热峰,反映的是蛋白质变性的过程。峰顶点对应的温度是β-CD/OVA复合体系的热变性温度。

图5 不同质量配比对β-CD/OVA DSC的影响Fig.5 Effect of different mass ratios on DSC of β-CD/OVA
由图5可知,组别1∶4、1∶3、1∶2和1∶1的热变性温度分别为61.6,62.7,58.5,61.9 ℃。分析发现组别1∶3比组别1∶4、1∶2和1∶1的热变性温度分别提高了1.1,4.2,0.8 ℃,结果表明组别1∶3中β-CD/OVA复合体系的热稳定性最好,该比例下复合体系最稳定。综合以上分析,组别1∶3的复合溶液中粒子溶解分散程度最好,利于鱼肉的浸渍处理,并且该组的稳定性最强,适合长期的冻藏研究。因此,最终选择组别1∶3即β-CD/OVA的质量比为1∶3作为最佳配比进行下一步的鲌鱼抗冻研究。
2.6 复合抗冻剂对鱼肉持水性的影响
不同浓度β-CD/OVA处理的鱼肉在冻藏90 d内的持水性变化见图6。
由图6可知,随着冻藏时间的延长,鱼肉的持水性逐渐下降。特别是空白组(0%)和2% β-CD/OVA处理组的鱼肉持水性显著下降(P<0.05),然而4%、6%的β-CD/OVA处理组明显抑制了肌肉持水性的下降。经过90 d的冻藏后,2%、4%和6%的β-CD/OVA处理组分别较空白组(0%)的持水性提高了3.14%、3.97%和2.48%,说明β-CD/OVA的处理能保护鱼肉的持水效果,抑制持水性的下降,并且6% β-CD/OVA 的处理对抑制鱼肉持水性下降的效果最好。

图6 不同浓度的β-CD/OVA对冻藏期间鱼肉持水性的影响Fig.6 Effect of different concentration of β-CD/OVA on water holding capacity of fish during frozen storage
2.7 复合抗冻剂对鱼肉质子密度图像的影响
不同浓度β-CD/OVA 处理的鱼肉在冻藏90 d内的质子密度图像变化见图7。

图7 不同浓度的β-CD/OVA对冻藏期间鱼肉二维质子密度图像的影响Fig.7 Effect of different concentration of β-CD/OVA on proton density images of fish during frozen storage
由图7可知,在冻藏第0天时,各组样品均含有较多的深色亮点,说明新鲜状态的鱼肉含水量高,鱼肉的保水能力好。随着冻藏时间的延长,各组样品的深色亮点逐渐消失,说明鱼肉组织的保水性变差。在冻藏第30天时,空白组(0%)的MRI图中深色亮点明显减少,而经过β-CD/OVA处理的各组MRI图中亮点明显多于空白组(0%)。冻藏90 d后,各组样品的保水力均显著下降,但4%、6% β-CD/OVA处理的鱼肉保水力仍高于空白组(0%)和2% β-CD/OVA处理组,这可能是由于β-CD/OVA分子中的羟基与水结合提高了鱼肉的保水能力。结果表明,未经过β-CD/OVA处理的鱼肉保水能力明显下降,6% β-CD/OVA处理的鱼肉保水效果最好,4% β-CD/OVA处理的鱼肉保水效果次之。
2.8 复合抗冻剂对鱼肉组织结构的影响
不同浓度β-CD/OVA处理的鱼肉在冻藏90 d内的内部肌肉组织结构变化见图8。

图8 不同浓度的β-CD/OVA对冻藏期间鱼肉组织切片的影响Fig.8 Effect of different concentration of β-CD/OVA on tissue sections of fish during frozen storage
由图8可知,在冻藏第0天时,新鲜的鱼肉组织结构排列整齐,肌肉细胞之间的空隙较小且排列紧密,此时鱼肉的保水性最好。在冻藏30 d后,鱼肉的组织结构保持得比较完整,细胞组织间隙逐渐变得疏松,这可能是由于在冻藏过程中冰晶的形成和生长对细胞组织造成了挤压,引起了肌纤维间隙的增大。在冻藏90 d后,从图中可以明显看出各组的细胞间隙显著增大,但是6% β-CD/OVA处理组的细胞间隙明显比空白组(0%)和2%、4% β-CD/OVA处理的间隙紧密。这可能是由于β-CD/OVA的处理减少了冰晶的形成,抑制了肌肉组织受损,保护了肌肉结构的完整。
2.9 复合抗冻剂对盐溶性蛋白含量的影响
鱼肉中肌肉蛋白的功能性质主要由盐溶性蛋白肌原纤维蛋白体现,测定盐溶性蛋白的含量可以反映冻藏过程中鲌鱼功能特性的变化。不同浓度β-CD/OVA处理的盐溶性蛋白含量在冻藏90 d内的含量变化见图9。
由图9可知,在第0天时,盐溶性蛋白含量大约为75 mg/mL,随着冻藏时间的延长,盐溶性蛋白含量呈下降趋势。在冻藏了90 d后,空白组(0%)的盐溶性蛋白含量显著下降(P<0.05),同时空白组(0%)、2%、4%和6% β-CD/OVA处理组的盐溶性蛋白含量比0 d分别下降了59.1%、56.1%、50.5%和47.0%,结果表明,经过β-CD/OVA的处理有效抑制了盐溶性蛋白含量的下降,明显降低了盐溶性蛋白含量下降的程度和速度,β-CD/OVA对蛋白的功能性质有明显的保护作用。

图9 不同浓度的β-CD/OVA对冻藏期间盐溶性蛋白含量的影响Fig.9 Effect of different concentration of β-CD/OVA on salt-soluble protein content during frozen storage
2.10 复合抗冻剂对肌原纤维蛋白Ca2+-ATPase活性的影响
不同浓度β-CD/OVA处理的肌原纤维蛋白在冻藏90 d内的Ca2+-ATPase活性变化见图10。

图10 不同浓度的β-CD/OVA对冻藏期间肌原纤维蛋白Ca2+-ATPase活性的影响Fig.10 Effect of different concentration of β-CD/OVA on Ca2+-ATPase activity of myofibrillar proteins during frozen storage
由图10可知,随着冻藏时间的延长,各组肌原纤维蛋白的Ca2+-ATPase活性均发生显著下降(P<0.05)。在冻藏90 d后,空白组(0%)的Ca2+-ATPase活性下降速度最快,同时空白组(0%)的Ca2+-ATPase活性显著低于2%、4%和6%处理组的Ca2+-ATPase活性,这可能是由于β-CD/OVA的处理减少了蛋白的交联聚集,保护了蛋白质的结构完整。结果表明,空白组(0%)的Ca2+-ATPase活性下降程度最大,肌原纤维蛋白的完整性遭到了破坏,同时说明β-CD/OVA的处理能一定程度地抑制肌原纤维蛋白的交联聚集。
2.11 复配抗冻剂对肌原纤维蛋白二级结构的影响
不同浓度β-CD/OVA处理的肌原纤维蛋白在冻藏90 d内的二级结构变化见图11。
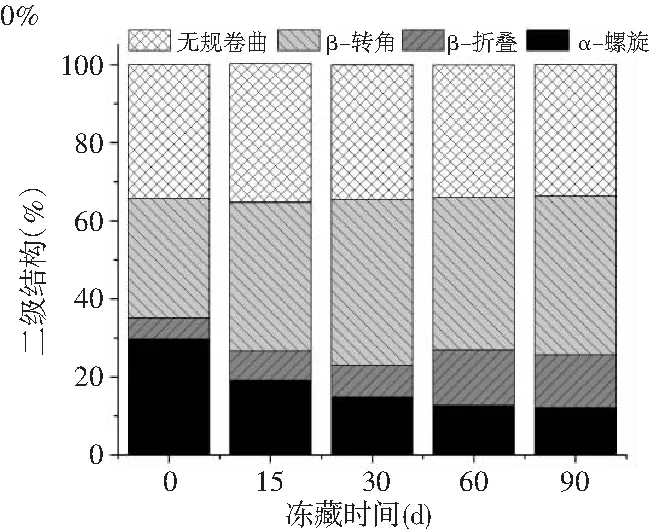


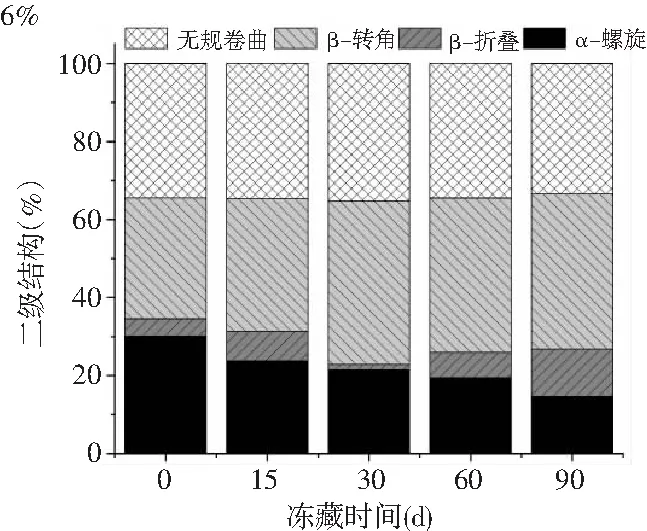
图11 不同浓度的β-CD/OVA对冻藏期间肌原纤维蛋白二级结构的影响Fig.11 Effect of different concentration of β-CD/OVA on secondary structure of myofibrillar proteins during frozen storage
由图11可知,随着冻藏时间的延长,α-螺旋的百分比显著降低(P<0.05),逐渐向β-折叠、β-转角和无规卷曲转化。在第0天时,各组样品的α-螺旋含量均保持在30%左右。在冻藏90 d后,空白组(0%)、2%、4%和6% β-CD/OVA处理组的α-螺旋含量分别下降了59.0%、56.1%、55.5%和51.3%,这可能是由于冻藏过程破坏了α-螺旋结构的稳定性,导致α-螺旋向其他结构转化。对比发现6% β-CD/OVA处理组的α-螺旋百分比下降的最少,说明6% β-CD/OVA的处理能更好地保护蛋白质的二级结构,保持α-螺旋结构的稳定性。
3 结论
鲌鱼在冻藏过程中由于肌原纤维蛋白的变性与降解,导致紧密的肌肉组织结构被破坏,使得鱼肉失去原有的弹性和保水力[16]。同时在冻藏过程中由于鱼肉组织中冰晶的形成和生长,对其细胞结构造成了不可逆的损伤,最终引起冻藏品质下降[17]。β-CD/OVA复合抗冻剂的添加延缓了鲌鱼品质的劣变,一定程度上提高了蛋白结构和鱼肉组织结构的稳定性,这是由于β-CD/OVA复合物分子中的羟基与肌肉组织中的水分结合,减少了冰晶形成,从而阻止了蛋白质分子的聚集与变性[18]。Walayat等报道了β-CD与EWP复合抑制了肌原纤维蛋白分子之间的相互作用,减少了蛋白质的聚集变性,从而保持了蛋白结构的稳定,这与本研究的结论一致。研究结果显示,6% β-CD/OVA处理抑制了α-螺旋向其他二级结构转化,增强了肌原纤维蛋白二级结构的稳定性,同时经过6% β-CD/OVA的处理显著抑制了肌原纤维蛋白含量和Ca2+-ATPase活性的下降,改善了疏松的组织结构,从而提高了鱼肉的保水能力和持水性能。6% β-CD/OVA的抗冻效果优于其他浓度的原因可能是随着复合物浓度的增加,抗氧化作用增强,抑制了鲌鱼蛋白和脂肪的氧化,提高了鲌鱼的冻藏品质[19]。综合以上分析,6%浓度1∶3配比的β-CD/OVA有望作为一种有效的新型功能复合抗冻剂应用到鱼类的冻藏中。

