基于TSP家族构建胃癌预后评估模型
刘航,卢文卿,包博文,郑雪莹,李冬阳,王多,车晓芳
中国医科大学附属第一医院,沈阳110001
胃癌是临床常见的消化系统恶性肿瘤之一,在我国其发病率居各类恶性肿瘤的第3位。大多数胃癌患者在初诊时已属中晚期,目前的治疗手段虽能在一定程度上改善患者预后,但其5 年生存率仍然较低。现有的分子预后模型和只针对单一病理类型或临床分期进行地预后评估,并未综合考虑相关分子家族在胃癌中的整体功能和临床应用,具有一定局限性。因此,从分子家族功能角度出发,筛选合适的分子标志物,并将其纳入胃癌预后预测模型,对准确评估胃癌患者预后具有重要意义。凝血酶原(TSP)家族是一类具有Ⅱ、Ⅲ型重复序列且羧基末端区域高度同源的凝血酶原蛋白,共有TSP1、TSP2、TSP3、TSP4、TSP5五个家族成员。TSP家族主要存在于细胞外基质中,可通过与不同的细胞受体结合而参与血管生成。TSP家族能够参与多种肿瘤的发生、发展,但其在胃癌中作用的研究较少。有研究发现,TSP2 和TSP5 是胃癌发生的危险因素[1-2],而TSP4 则是胃癌发生的保护因素[3],这表明TSP家族成员在胃癌中的作用不尽相同。2020年3月—6月,本研究利用人类肿瘤相关的基因表达汇编(GEO)数据库中胃癌数据集,筛选出TSP家族中影响胃癌预后的独立危险因素并构建预测胃癌预后的风险评分(RS)模型,旨在为胃癌预后预测提供科学依据。现报告如下。
1 资料与方法
1.1 资料提取 登录GEO数据库(http://www.ncbi.nlm. nih. gov/geo),从GEO 数据库中下载胃癌样本量最大的GSE62254 数据集,获取胃癌样本转录组测序表达数据和性别、年龄、Lauren分型、临床分期、总生存期等临床资料。在排除生存资料缺失样本后,最终纳入胃癌患者283例。
1.2 方法
1.2.1 数据集分组与RS 计算 以283 例胃癌患者TSP1~TSP5 mRNA 相对表达量的中位数为临界值,将患者分为TSP高表达者与TSP低表达者。利用Cox比例风险回归模型筛选影响胃癌预后的独立危险因素(X)并计算其对应的偏回归系数(β)。采用加权法构建RS 公 式,即RS=β1×exp X1+β2×exp X2+…+βn×exp Xn。根据RS的中位数进行二分类,低于RS中位数的样本为低RS者、高于RS中位数的样本为高RS者。
1.2.2 RS 效能评估 基于RS 和患者生存状态,绘制不同RS下的受试者工作特征(ROC)曲线,并计算相应的曲线下面积(AUC)。根据AUC 评估不同RS预测胃癌患者预后的准确性,筛选评价效能最佳的RS模型。
1.3 统计学方法 采用SPSS16.0 统计软件。计数资料比较采用χ2检验。生存分析采用Cox 比例风险回归模型、Kaplan-Meier 法。利用R3.3 软件中的pROC 包和nsROC 包(http://www. r-project. org/)绘制ROC 曲线,并通过DeLong 检验进行比较。P<0.05为差异有统计学意义。
2 结果
2.1 基于TSP 家族的胃癌预后风险评估模型RS1建立与验证 单因素Cox回归分析显示,TSP1、TSP3和TSP5 可能与胃癌患者预后有关(P 均<0.05);多因素Cox 回归分析显示,TSP3、TSP5 是影响胃癌患者预后的独立危险因素(P均<0.05)。见表1。基于TSP3、TSP5 mRNA 表达和Cox 回归分析,计算其对应的β,构建RS1,即RS1=β1×exp TSP3+β2×exp TSP5(β 为偏回归系数,exp TSP 为TSP mRNA 相对表达量)。经计算,RS1 的中位数为5.945 68,以此为临界值将患者分为高RS1 者与低RS1 者,高RS1 者生存期明显低于低RS1 者(P<0.05),RS1 预测胃癌患者预后的AUC为0.663。见图1、2。
2.2 RS1与胃癌患者临床病理特征的关系 见表2。
2.3 基于RS1 的胃癌预后风险评估模型RS2 建立与验证 为进一步提高预后评估模型的准确性,建立基于RS1 的胃癌预后风险评估模型RS2。单因素Cox回归分析显示,T分期、N分期、M分期、Lauren分型和RS1 可能与胃癌患者预后有关(P均<0.05)。多因素Cox 回归分析显示,T 分期、N 分期、M 分期和RS1 是影响胃癌患者预后的独立危险因素(P均<0.05)。见表3。基于T 分期、N 分期、M 分期和RS1的赋值以及Cox 回归分析中相对应的β,构建RS2,即RS2=β1X1+β2X2+β3X3+β4X4(β为偏回归系数,X为预后独立危险因素的赋值)。经计算,RS2 的中位数为6.604 39,以此为临界值将患者分为高RS2者与低RS2者,高RS2者生存期明显低于低RS2者(P<0.01),RS2预测胃癌患者预后的AUC为0.795。见图3、4。
2.4 基于TSP 家族的RS 评分与传统基于临床病理特征的预后模型预测效能比较 为了比较基于TSP家族的RS 评分与传统基于临床病理特征预后模型的优劣,本研究构建了仅基于T 分期、N 分期、M 分期的RS3,即RS3=β1X1+β2X2+β3X3(β为偏回归系数,X 为T 分期、N 分期、M 分期的赋值)。经计算,RS3的中位数为2.7,以此为临界值将患者分为高RS3者与低RS3 者。RS3 预测胃癌患者预后的AUC为0.767。DeLong检验发现,RS2预测胃癌患者预后的AUC明显高于RS1、RS3(P均<0.05)。见图5、6。
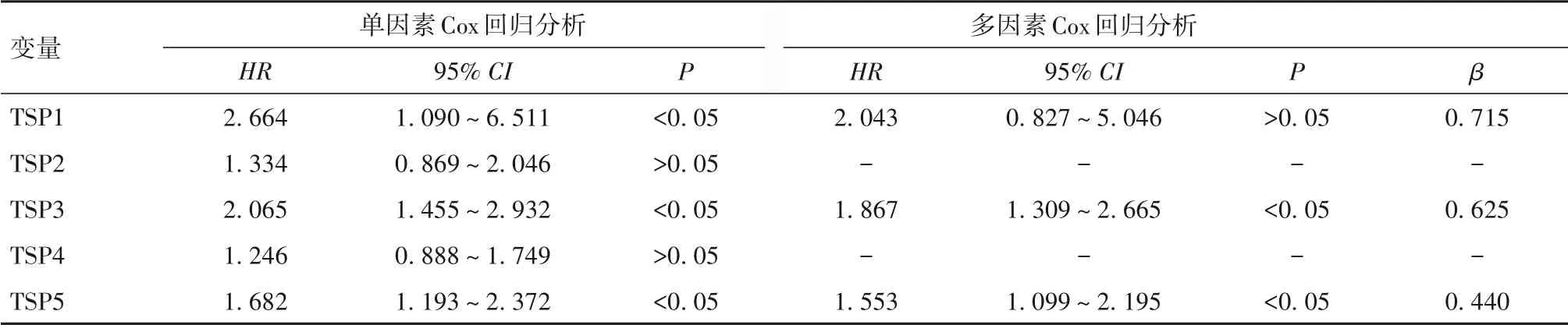
表1 TSP1~TSP5 mRNA表达影响胃癌患者预后的单因素和多因素Cox回归分析结果

图1 高RS1者与低RS1者的生存曲线
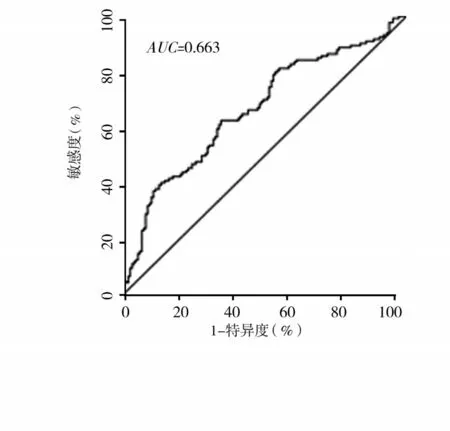
图2 RS1预测胃癌患者预后的ROC曲线

表2 RS1与胃癌患者临床病理特征的关系(例)
3 讨论
由于胃癌发病隐匿,大多数患者初诊时已属中晚期,错过了根治性手术的最佳时机,5 年生存率较低。现有的分子预后模型和只针对单一病理类型或临床分期进行地预后评估,并未综合考虑相关分子家族在胃癌中的整体功能和临床应用,具有一定局限性。如ZHOU 等[4]建立了由TSP5、SHH、NF1、AP4B1、MATN3、CCL8 组成的对Ⅲ期和Ⅳ期根治性手术联合放化疗胃癌患者预后评估模型,但该模型并不适用于所有胃癌患者。因此,建立有效的预后评估模型对判断胃癌患者预后具有重要意义。

表3 影响胃癌患者预后的单因素和多因素Cox回归分析结果
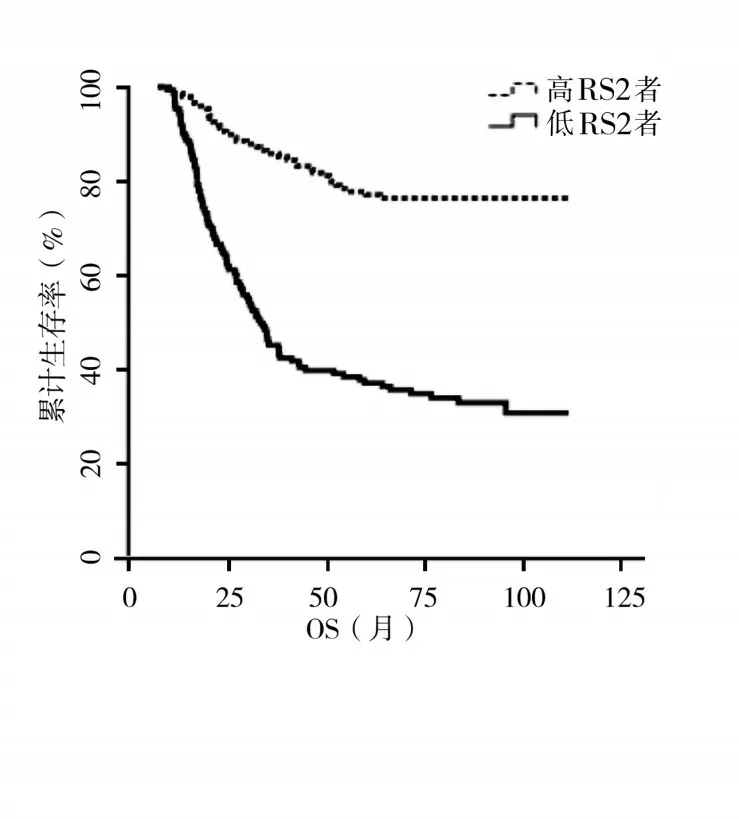
图3 高RS2者与低RS2者的生存曲线
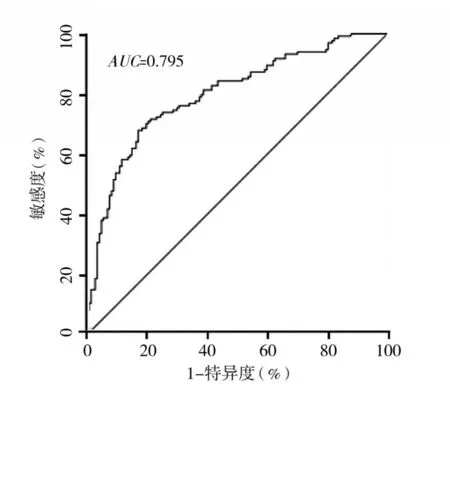
图4 RS2预测胃癌患者预后的ROC曲线
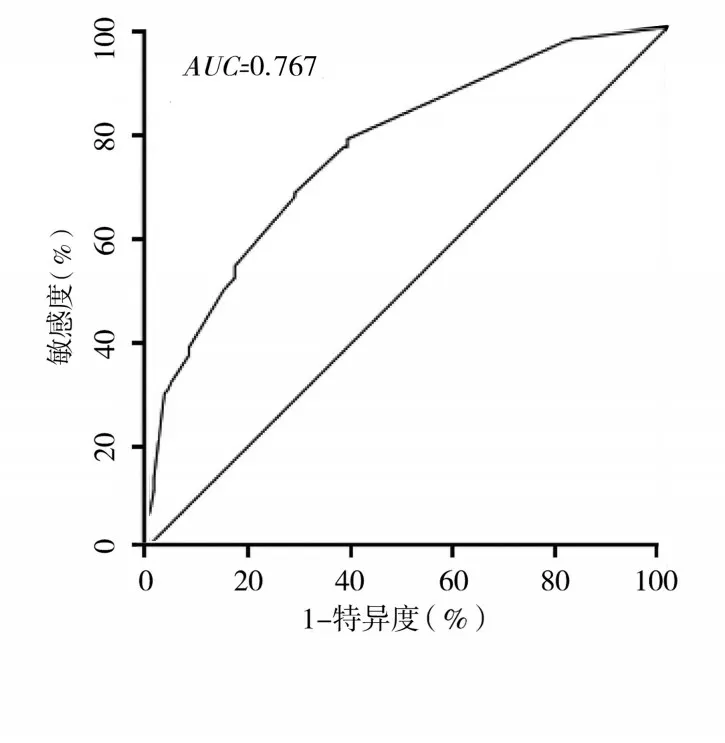
图5 RS3预测胃癌患者预后的ROC曲线

图6 RS1、RS2、RS3预测胃癌患者预后的ROC曲线
TSP 家族是一类存在于细胞外基质的血小板反应蛋白,可参与血管生成、炎症反应、免疫应答等生物学过程[5]。越来越多研究表明,TSP家族成员与多种肿瘤的发生、发展密切相关。有研究报道,沉默TSP1可促进结直肠癌细胞增殖、侵袭和迁移[6],提示TSP1 可作为结直肠癌进展的抑制因子。宫颈癌组织TSP2 低表达可提示患者预后不良[7],而在胰腺癌、肺癌和黑色素瘤组织中TSP2 高表达,并且其表达越高,患者预后越差[8-9]。TSP3在骨肉瘤和慢性粒细胞性白血病中高表达,且其高表达与患者预后不良有关,但在肺癌中TSP3 则作为保护因素。TSP5被证实在肠癌、乳腺癌、肝癌和前列腺癌组织中高表达,并且其高表达与患者预后不良有关。以上研究证实,TSP 家族各成员在肿瘤发生、发展过程中发挥的作用不同。目前,TSP2、TSP4、TSP5已被证实与胃癌的发生、发展有关。有学者利用全基因组表达谱分析发现,TSP2、TSP5在胃癌组织中表达上调,且其表达上调与患者预后不良有关[1-2]。HUANG 等[3]研究发现,TSP4 低表达与胃癌患者总生存期短密切相关;他们还发现,成纤维细胞生长因子受体2可通过PI3K-AKT-mTOR 信号通路下调TSP4 表达,从而促进胃癌细胞增殖、侵袭和迁移。但目前尚无综合评估TSP家族对胃癌预后影响的报道。
本研究综合分析了TSP家族在胃癌预后中的作用,结果发现TSP3、TSP5 是影响胃癌患者预后的独立危险因素。目前,关于TSP3的作用机制尚不完全清楚。有研究报道,TSP3 在心肌中可通过抑制整合素的功能,增加疾病诱导的失代偿和肌膜去稳定化,而整合素在肿瘤发生、发展过程中可参与上皮间质转化、血管生成以及细胞增殖和迁移等[10]。在骨肉瘤组织中TSP3高表达,其高表达能够促进肿瘤血管生成,并且与患者预后不良有关[11]。在慢性粒细胞白血病相关细胞系中发现,TSP3 表达上调,且其表达上调与肿瘤恶性程度增加有关;但在肺癌细胞中,TSP3 则被认为是细胞侵袭的一种负调控因子[12-13]。TSP5 能够编码软骨低聚基质蛋白,这是一种非胶原细胞外基质蛋白,该蛋白缺乏可导致骨骼发育缺陷。有研究报道,TSP5 可与转化生长因子β1(TGF-β1)结合,且与TSP5 结合的TGF-β1生物活性明显增强[14]。有研究证实,肿瘤相关成纤维细胞来源的TSP5旁分泌可促进肝癌细胞上皮间质转化[15];TSP5 能够通过促进Notch3及其配体Jagged1的相互作用,导致乳腺癌肿瘤干细胞增殖[16];在结肠癌中,TSP5 可通过激活PI3K-AKT-mTOR-p70S6K 信号通路,使肿瘤细胞增殖能力增强[17]。这些研究结果为进一步探究TSP3、TSP5在胃癌中的作用提供了新的方向。
本研究成功建立了基于TSP家族的胃癌预后评估模型RS1,并基于RS1 和临床病理特征建立了胃癌预后评估模型RS2,并构建了传统基于临床病理特征的胃癌预后评估模型RS3,结果发现,与RS1、RS3比较,RS2预测胃癌患者预后的效能更高。
综上所述,本研究成功构建了基于TSP家族的胃癌预后评估模型,为胃癌预后预测提供了科学依据。但本研究纳入的TSP3、TSP5在胃癌发生、发展过程中的具体分子机制尚不明确,仍需进一步探索。

