膝骨关节炎患者外周血单个核细胞CD36表达与氧化应激的相关性研究
周巧 刘健 宋倩 郭锦晨 黄旦

【摘 要】目的:探讨B类清道夫受体白细胞分化抗原36(CD36)在膝骨关节炎患者外周血单个核细胞(PBMC)上的表达及临床意义,以阐明其在膝骨关节炎发生和发展中的作用。方法:应用流式细胞仪检测70例膝骨关节炎患者和30例健康对照者PBMC表面CD36相对荧光强度,比较2组的表达情况,采用ELISA法检测2组炎性细胞因子、氧化应激相关指标的表达,并分析其相关性。结果:膝骨关节炎患者PBMC上CD36相对荧光强度显著高于正常对照组(P < 0.01)。与正常对照组比较,膝骨关节炎组超氧化物歧化酶(SOD)、总抗氧化能力(TAOC)、白细胞介素(IL)-4、IL-9明显降低,丙二醛(MDA)、脂质过氧化物、IL-1β、IL-6、肿瘤坏死因子-α(TNF-α)水平升高(P < 0.05或P < 0.01)。膝骨关节炎患者PBMC上CD36表达与SOD(r = -0.296,P = 0.014)、TAOC(r = -0.241,P = 0.042)呈负相关,与MDA(r = 0.255,P = 0.029)呈正相关;与炎性细胞因子IL-1β(r = 0.307,P = 0.009)、IL-6(r = 0.285,P = 0.017)、TNF-α(r = 0.265,P = 0.025)呈正相关。结论:膝骨关节炎患者PBMC上CD36表达异常,与炎症反应和氧化损伤有明确的相关性。
【关键词】 膝骨关节炎;外周血单个核细胞;B类清道夫受体白细胞分化抗原36;氧化应激
Correlation between the Expression of CD36 in Peripheral Blood Mononuclear Cells and Oxidative Stress in Patients with Knee Osteoarthritis
ZHOU Qiao,LIU Jian,SONG Qian,GUO Jin-chen,HUANG Dan
【ABSTRACT】Objective:To investigate the expression and clinical significance of CD36 in peripheral blood mononuclear cells(PBMC)of patients with knee osteoarthritis(KOA).Methods:Flow cytometry was used to detect the relative fluorescence intensity of CD36 on the surface of PBMC in 70 patients with knee osteoarthritis and 30 healthy controls.The expression of cytokines and oxidative stress related indicators in the two groups were detected by ELISA,and the correlation between them was analyzed.Results:The relative fluorescence intensity of CD36 on PBMC of patients with knee osteoarthritis was significantly higher than that of the normal group(P < 0.01).Compared with the normal group,the levels of SOD,TAOC and IL-4 were significantly decreased,and the levels of MDA,IL-1β,IL-6 and TNF-α were increased in the knee osteoarthritis group(P < 0.05 or P < 0.01).
CD36 expression was negatively correlated with SOD(r = -0.296,P = 0.014),TAOC(r = -0.241,P = 0.042),positively correlated with MDA(r = 0.255,P = 0.029),and positively correlated with IL-1β(r = 0.307,P = 0.009),IL-6(r = 0.285,P = 0.017)and TNF-α(r = 0.265,P = 0.025).Conclusion:
The abnormal expression of CD36 in PBMC of patients with knee osteoarthritis has a clear correlation with inflammatory reaction and oxidative damage.
【Keywords】 knee osteoarthritis;peripheral blood mononuclear cells;CD36;oxidative stress
骨關节炎(osteoarthritis,OA)的特征是关节软骨细胞的逐渐破坏,膝关节是最常受累部位,称为膝骨关节炎(knee osteoarthritis,KOA)。软骨细胞衰老已被认为是影响软骨稳态和功能衰老相关变化的主要因素,并且与炎症介质的增加和氧化应激有关[1]。异常升高的活性氧(ROS)会破坏细胞成分,例如细胞膜中的脂质、蛋白质、线粒体和核酸,干扰软骨细胞的无氧代谢和软骨破坏[2]。B类清道夫受体白细胞分化抗原36(CD36)是一种广泛表达的模式识别受体,可作为多种配体的清除剂受体,促进其摄取和细胞内降解[3]。巨噬细胞、血小板和某些其他细胞类型的CD36表达诱导炎症反应[4],CD36是促炎和氧化途径的关键调节剂[5]。CD36信号可下调关键的抗氧化因子,但其具体的作用途径及机制尚未阐明。
本研究通过检测KOA患者及健康对照者外周血单个核细胞(PBMC)中CD36的表达,分析其与氧化应激指标、细胞因子的相关性,探讨其在KOA发生和发展中的作用。
1 临床资料
1.1 一般资料 选取2017年7月至2018年7月在安徽中医药大学第一附属医院风湿免疫科就诊的住院KOA患者70例,男25例,女45例;年龄37~70岁,平均(55.43±7.53)岁;病程1~14年,平均(6.89±5.72)年;体质量47~86 kg,平均(62.07±11.18)kg。同时选取安徽中医药大学第一附属医院健康体检中心人员30例为正常对照组,男10例,女20例;年龄44~69岁,平均(57.23±8.50)岁;体质量45~78 kg,平均(60.23±12.14)kg。正常对照组均为身体健康、无明显器质性疾病者,性别、年龄与KOA组匹配。
1.2 诊断标准 按照2010年中华医学会风湿病学分会发布的《骨关节炎诊断及治疗指南》[6]标准。
1.3 纳入标准 ①KOA患者符合上述诊断标准,X线检查根据Kellgren-Lawrence[7]标准符合Ⅰ~Ⅲ级;②年龄35~75岁。
1.4 排除标准 ①合并有心脑血管、肝、肾和造血系统等严重原发性疾病者;②精神病患者;③重度KOA患者;④其他种类膝关节炎患者,如类风湿关节炎等。
2 方 法
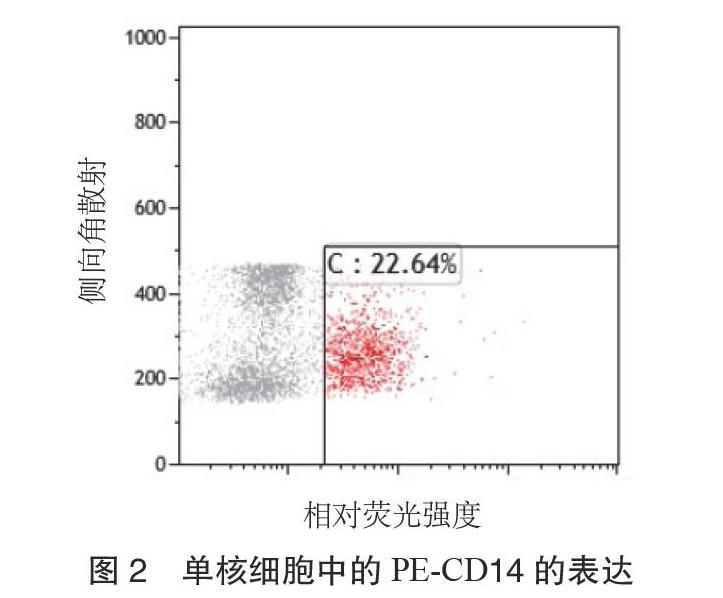
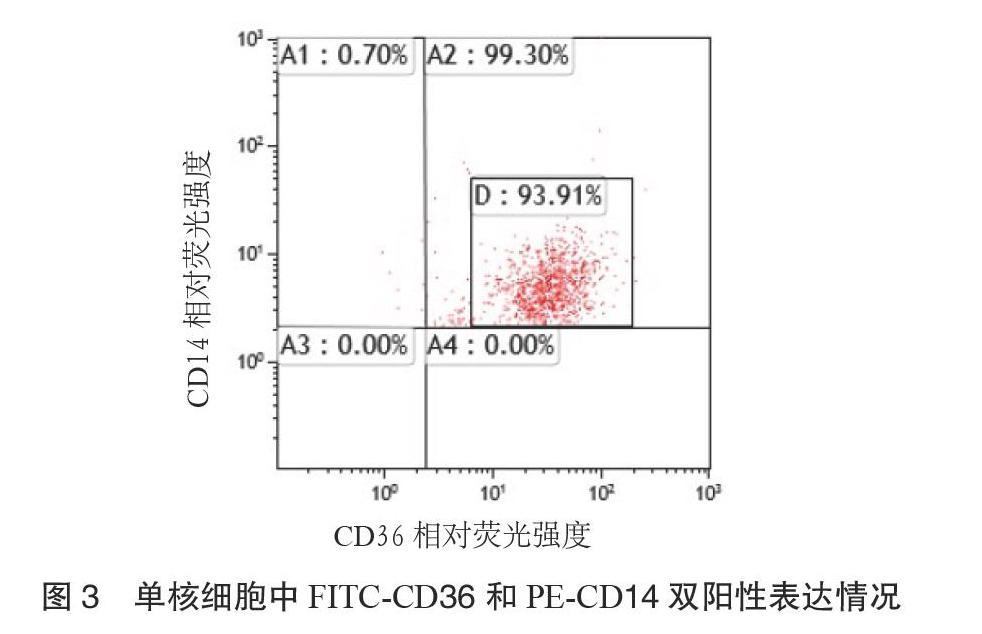
2.1 流式细胞术检测PBMC上CD36的表达 用肝素钠管清晨空腹抽取静脉血,100 μL全血入流式管,先后加入5 μL异硫氰酸荧光素(FITC)标记的CD36抗体和CD14-藻红蛋白(PE)。放置15 min后,加入2 mL溶解反应物裂解红细胞。将混浊液置于离心机以1500 r·min-1离心5 min,离心半径10 cm,弃上清。放置10 min后,使裂解细胞沉淀、分离。分离后的液体用2 mL磷酸盐缓冲液(PBS)清洗,再次以1500 r·min-1离心5 min,离心半径10 cm,然后加入0.5 mL的PBS再次洗涤。采用Fabcaliar流式细胞仪进行检测,以CD14-PE为纵坐标,CD36-FITC为横坐标的散点图上圈定单核细胞群并设门,然后分析门内FITC和PE双阳性细胞单核细胞CD36表达的相对荧光强度,采用Kaluza软件进行分析。
2.2 ELISA法检测白细胞介素(IL)-1β、IL-4、IL-6、IL-10、IL-9、肿瘤坏死因子-α(TNF-α)、转化生长因子-β(TGF-β)、过氧化脂质(LPO)、丙二醛(MDA)、超氧化物歧化酶(SOD)、总抗氧化能力(TAOC)的表达 抽取2组静脉血
3 mL,4℃至自然凝固后置于离心机以3000 r·min-1离心5 min,离心半径10 cm,分离血清。分为以下步骤:①稀释与加样;②温育;③配液;④洗涤;⑤加酶,每孔加入酶标试剂50 μL,空白孔除外,重复上述温育和洗涤过程;⑥显色,每孔先后加入显色剂A 50 μL和B 50 μL,轻混匀避光显色15 min。终止反应后,以450 nm波长依序测量各孔的吸光度。
2.3 统计学方法 采用SPSS 22.0软件进行统计分析。计量资料符合正态分布以表示,组间比较采用两独立样本t检验;不符合正态分布采用Wilcoxon秩和检验;相关性分析采用Spearman分析。以P < 0.05为差异有统计学意义。
3 结 果
3.1 KOA组和正常对照组PBMC上CD36相对荧光强度表达情况 KOA组PBMC上CD36相对荧光强度显著高于正常对照组,平均相对荧光强度分别为(36.65±2.71)和(15.89±2.13),2组比较,差异有统计学意义(P < 0.01)。实验相关流程见图1至图5。
3.2 KOA组和正常对照组细胞因子和氧化应激指标的表达情况 与正常对照组比较,KOA组SOD、TAOC明显降低,MDA、LPO水平明显升高
(P < 0.05或P < 0.01);KOA组IL-4、IL-9明显降低,IL-1β、IL-6、TNF-α明显升高(P < 0.05或P < 0.01)。2组TGF-β比较,差异无统计学意义(P ﹥ 0.05)。见表1。
3.3 KOA患者PBMC上CD36表达水平与氧化应激、细胞因子的相关性分析 PBMC上CD36与氧化应激指标相关性分析结果表明,CD36与SOD、TAOC呈负相关,与MDA、LPO呈正相关;与细胞因子IL-1β、IL-6、TNF-α呈正相关,与IL-4、IL-9、TGF-β呈负相关。见表2。
4 讨 论
OA是一种以关节软骨病变为特征的风湿病。软骨细胞是软骨中的主要细胞群,它们在软骨代谢的稳态中起着至关重要的作用。当软骨细胞的抗氧化能力和自噬水平降低时,就会发生氧化应激,破坏软骨的稳态,导致OA的发生和发展。当软骨细胞暴露于ROS中,可以诱导软骨细胞氧化应激[8]。氧化应激的存在会导致OA软骨中端粒基因组不稳定,软骨细胞复制性衰老和功能障碍,这表明氧化应激致使软骨细胞衰老可能是导致OA发病的重要机制。深入研究减少关节软骨氧化损伤的作用靶点,可以为防治KOA提供思路[9]。本研究也表明,KOA患者中SOD、TAOC下降,MDA、LPO升高,表明KOA患者体内存在氧化损伤,这些氧化损伤可能是导致软骨细胞衰老和软骨老化的原因。SOD是抗氧化系统中一种必不可少的酶,通过减少超氧化物自由基而在保护氧化应激的机制中发挥关键作用。TAOC是一个综合性指标,用于衡量机体抗氧化系统功能状况,其大小可代表和反映机体抗氧化酶系统和非酶促系统对外来刺激的代偿能力以及机体自由基代谢的状
態[10]。MDA、LPO是脂质过氧化的产物。自由基的增加会导致MDA的过量产生,是组织细胞损伤的重要标志[11]。KOA患者中抑炎因子IL-4、IL-9表达明显下降,促炎因子IL-1β、IL-6、TNF-α水平明显升高。研究表明,氧化损伤可以诱发炎症机制的激活,诱导OA中软骨细胞的凋亡[12]。
CD36是一種跨膜清道夫受体,已知有多种表达细胞类型,如巨噬细胞、血管内皮细胞、血小板、脂肪细胞和上皮细胞。CD36是巨噬细胞表面主要的识别、内吞氧化低密度脂蛋白的清道夫受体,可在氧化应激条件下促进慢性炎症。在一定条件下,CD36生成特定的反应性氧化剂,具体取决于环境和细胞。在脉管系统中,平滑肌细胞和内皮细胞中的CD36信号会促进ROS的生成、抗氧化剂基因的遗传下调,并损害平滑肌和内皮功能[13]。CECIL等[14]研究发现,在两种啮齿动物KOA模型中,CD36表达相对增加,可能导致关节软骨再生缺陷。模式识别受体CD36认为是软骨细胞肥大标志物,并与抑制分解代谢反应和导致软骨细胞炎症反应有关。在重度OA患者软骨中,CD36免疫染色的软骨细胞数量显著增加。CD36通过激活促炎和氧化途径促进肾纤维化[15]。原儿茶酸通过CD36/AMPK通路激活Sirt1和Sirt3恢复锰依赖性SOD的活性,改善内皮细胞氧化应激,发挥抗氧化活性[16]。
本研究流式细胞术结果提示,KOA患者PBMC上CD36表达异常增高。将CD36与氧化应激、细胞因子指标的相关性分析结果显示,CD36与SOD、TAOC呈负相关,与MDA、LPO呈正相关;与细胞因子IL-1β、IL-6、TNF-α呈正相关,与IL-4、IL-9、TGF-β呈负相关。表明CD36的表达与氧化应激、炎症反应关系密切,共同参与KOA的发生和发展,但其作用机制还需进一步研究。炎症已被证明直接触发软骨细胞的分解代谢活动,最终导致细胞外基质降解。IL-1β、IL-6和TNF-α等炎性细胞因子的过度产生在OA病理发展中起着至关重要的作用。IL-1β已被证明在软骨基质降解中起关键作用,在OA患者的滑液和软骨组织中高水平表达[17]。IL-1β还通过诱导环氧合酶2
(COX-2)和诱导型一氧化氮合酶(iNOS)的释放发挥其炎症作用[18]。IL-6也通过触发一系列软骨损伤事件,例如诱导基质金属蛋白酶(MMPs)、COX-2、前列腺素E2(PGE2)和一氧化氮的产生,在OA发病中发挥关键作用。TNF-α和IL-1β之间有协同作用,诱发关节组织中的炎症和分解代谢[19]。IL-1β和TNF-α诱导iNOS、COX-2和PGE2合酶的产生,从而增加其产物的量,诱导细胞氧化应激产生。IL-4在软骨代谢过程中起重要的软骨保护作用,IL-4通过抑制MMPs的分泌以及减少蛋白聚糖的生成对关节软骨有保护作用[20]。IL-9是重要的合成性细胞因子[21]。TGF-β可抑制IL-1β、TNF-α、MMP-9、MMP-13的基因表达,进而阻止软骨Ⅱ型胶原的过度降解[22]。
综上所述,KOA患者PBMC表面的CD36相对荧光强度异常升高,且其表达与氧化应激、细胞因子相关,提示CD36的重要性。本文初步证实了PBMC表面的CD36异常表达可能加剧氧化损伤或炎症反应导致KOA软骨细胞的凋亡,但相关机制研究甚少。深入研究CD36对KOA患者软骨细胞调节的影响,为阐明KOA患者细胞-氧化调节机制及临床治疗提供新思路。CD36作为预防和治疗KOA的潜在靶点,研发针对CD36的抗体和药物可能存在潜在的临床意义。
参考文献
[1] XIE J,LIN JT,WEI M,et al.Sustained Akt signaling in articular chondrocytes causes osteoarthritis via oxidative stress-induced senescence in mice[J].Bone Res,2019,7(3):318-326.
[2] MINGUZZI M,CETRULLO S,D'ADAMO S,et al.
Emerging players at the intersection of chondrocyte loss of maturational arrest,oxidative stress,senescence and low-grade inflammation in osteoarthritis[J].Oxid Med Cell Longev,2018,11(1):3075293.
[3] OHGAMI N,NAGAI R,IKEMOTO M,et al.CD36,serves as a receptor for advanced glycation endproducts (AGE)[J].J Diabetes Complications,2002,16(1):56-59.
[4] FEBBRAIO M,SILVERSTEIN RL.CD36:implications in cardiovascular disease[J].Int J Biochem Cell Biol,2007,39(11):2012-2030.
[5] YANG P,XIAO Y,LUO X,et al.Inflammatory stress promotes the development of obesity-related chronic kidney disease via CD36 in mice[J].J Lipid Res,2017,58(7):1417-1427.
[6] 中华医学会风湿病学分会.骨关节炎诊断及治疗指南[J].中华风湿病学杂志,2010,14(6):416-419.
[7] G?NTHER KP,SUN Y.Reliability of radiographic assessment in hip and knee osteoarthritis[J].Osteoarthritis Cartilage,1999,7(2):239-246.
[8] WANG YK,ZHANG S,PREVIN R,et al.Role of forkhead box O transcription factors in oxidative stress-induced chondrocyte dysfunction:possible therapeutic target for osteoarthritis?[J].Int J Mol Sci,2018,19(12):3794.
[9] YUDOH K,NGUYEN VT,NAKAMURA H,et al.Potential involvement of oxidative stress in cartilage senescence and development of osteoarthritis:oxidative stress induces chondrocyte telomere instability and downregulation of chondrocyte function[J].Res Ther,2005,7(2):R380-R391.
[10] TOOTSI K,M?RTSON A,KALS J,et al.Metabolic factors and oxidative stress in osteoarthritis:a case-control study[J].Scand J Clin Lab Invest,2017,77(7):520-526.
[11] KHOUBNASABJAFARI M,SOLEYMANI J,JOUYBAN A.Avoid using spectrophotometric determination of malondialdehyde as a biomarker of oxidative stress[J].Biomark Med,2018,12(6):551-554.
[12] MINGUZZI M,CETRULLO S,D'ADAMO S,et al.Emerging players at the intersection of chondrocyte loss of maturational arrest,oxidative stress, senescence and low-grade inflammation in osteoarthritis[J].Oxid Med Cell Longev,2018(1):3075293.
[13] YANG M,SILVERSTEIN RL.CD36 signaling in vascular redox stress[J].Free Radic Biol Med,2019,20(136):159-171.
[14] CECIL DL,APPLETON CTG,POLEWSKI MD,et al.The pattern recognition receptor CD36 is a chondrocyte hypertrophy marker associated with suppression of catabolic responses and promotion of repair responses to inflammatory stimuli[J].J Immunol,2009,182(8):5024-5031.
[15] OKAMURA DM,PENNATHUR M,PASICHNYK K,et al.CD36 Regulates Oxidative Stress and Inflammation in Hypercholesterolemic CKD[J].J Am Soc Nephrol,2009,20(3):495-505.
[16] HAN L,YANG Q,LI J,et al.Protocatechuic acid-ameliorated endothelial oxidative stress through regulating acetylation level via CD36/AMPK pathway[J].J Agric Food Chem,2019,67(25):7060-7072.
[17] MALDONADO M,NAM J.The role of changes in extracellular matrix of cartilage in the presence of inflammation on the pathology of osteoarthritis[J].Biomed Res Int,2013(1):284873.
[18] ZHENG WH,ZHANG H,JIN YL,et al.Butein inhibits
IL-1β-induced inflammatory response in human osteoarthritis chondrocytes and slows the progression of osteoarthritis in mice[J].Int Immunopharmacol,2017,42(1):1-10.
[19] MARCU KB,OTERO M,OLIVOTTO E,et al.NF-κB signaling:multiple angles to target OA[J].Current Drug Targets,2010,11(5):599-613.
[20] KOH SM,CHAN CK,TEO SH,et al.Elevated plasma and synovial fluid interleukin-8 and interleukin-18 may be associated with the pathogenesis of knee osteoarth ritis[J].The Knee,2020,27(1):26-35.
[21] QI CL,SHAN YX,WANG J,et al.Circulating T helper 9 cells and increased serum interleukin-9 levels in patients with knee osteoarthritis[J].Clin Exp Pharmacol Physiol,2016,43(5):528-534.
[22] 羅安玉,刘瀚霖,谢小飞,等.TGF-β1和BMP2在骨关节炎患者的关节软骨细胞中诱导的代谢特征[J].中国免疫学杂志,2020,36(15):1884-1888.
收稿日期:2020-11-08;修回日期:2020-12-24

