双委夜蛾气味结合蛋白AdisOBP6的原核表达、抗体制备及表达谱分析
宋月芹, 宋智煜, 董钧锋, 陈庆霄, 孙会忠
(河南科技大学林学院, 河南洛阳 471023)
双委夜蛾Athetisdissimilis隶属鳞翅目(Lepidoptera)夜蛾科(Noctuidae)委夜蛾属Athetis,是我国重要的农业害虫,对小麦、玉米、花生、大豆和甘薯等作物造成严重损失。该害虫主要分布于中国、日本、朝鲜、印度、印度尼西亚和菲律宾等国家(Takahashi, 1975; Banetal., 1998; Choetal., 2010; 李静雯等, 2012)。双委夜蛾首次在山东威海玉米地发现为害(李静雯等, 2012),随后在河南、陕西和安徽等地也陆续出现该虫的报道(宋月芹等, 2015; 段爱菊等, 2016; 郭婷婷等, 2016a, 2016b)。双委夜蛾幼虫和成虫在外形上与二点委夜蛾Athetislepigone极其相似,为害特征也相同,常隐蔽在秸秆、落叶和杂草中,在田间与二点委夜蛾混合发生。据统计,近6年二点委夜蛾为害面积近220万hm2,缺苗率高达70%以上,给玉米产量造成巨大损失(王振营等, 2012),而其中可能有一部分是双委夜蛾为害的。在室内用玉米苗饲养试验发现,双委夜蛾的幼虫食量、幼虫取食期和产卵量远大于二点委夜蛾(郭婷婷等, 2016a)。在田间,农民常将双委夜蛾与二点委夜蛾混在一起防治,长期施用广谱性杀虫剂使害虫极易产生抗药性,防治效果下降,对人畜不安全还污染环境。目前国内外专家通过研究昆虫基因功能等方面,以探索新型的对害虫专一性强、对人畜安全的绿色防控技术,已经取得了一定进展,而目前双委夜蛾这方面的研究较少。
昆虫具有灵敏的嗅觉系统,可以通过嗅觉精准地定位到配偶、寄主植物以及天敌(Leal, 2013),因此人们为了保护环境,探索新型害虫防治技术,对昆虫有关嗅觉基因开展了大量研究。如气味结合蛋白(odorant binding proteins, OBPs)(Gaoetal., 2018; Zhangetal., 2019; 巩雪芳等, 2020; Wangetal., 2020)、化学感受蛋白(chemosensory proteins, CSPs)(Qiuetal., 2018; Alietal., 2019)、嗅觉受体(olfactory receptors, ORs)(陈丽慧等, 2019; Tiwarietal., 2019)、味觉受体(gustatory receptors, GRs)(Poudeletal., 2015; Liuetal., 2020)、离子型受体(ionotropic receptors, IRs)(Abuinetal., 2019)、感觉神经元膜蛋白(sensory neuron membrane proteins, SNMPs)(胡颖颖等, 2013; Blankenburgetal., 2019)和气味降解酶(odorant degrading enzymes, ODEs)(Prestwich, 1987; Chertempsetal., 2015)等。其中OBPs是一类可溶性的小分子蛋白,在昆虫触角感器中高度表达,为气味识别的第一步(Pelosi and Maida, 1995)。根据半胱氨酸的数量,将OBPs分为5类:含有6个保守半胱氨酸位点的Classic OBPs;在第6个半胱氨酸后面多2~3个半胱氨酸残基,并且还有一个保守的脯氨酸位点的Plus-C OBPs;只有4个或5个半胱氨酸的Minus-C OBPs;具有2个典型半胱氨酸排列模式的Dimer OBPs;基因序列较长,特征不明显的Atypical OBPs(Zhangetal., 2013; McKenzieetal., 2014; Guetal., 2015)。
关于昆虫触角中OBPs的研究很多(Fanetal., 2011; Costa-da-Silvaetal., 2013; Ishidaetal., 2013; Duetal., 2019),但对昆虫精巢中OBPs的报道很少。Li等(2008)发现埃及伊蚊AedesaegyptiOBP22蛋白在雄蛾生殖器内大量表达,并在交配过程中将该蛋白转运到雌蛾的腹部末端和受精囊中,推测该蛋白可能作为某种信息素的载体,类似于脊椎动物的尿液和唾液。Sun等(2012)研究发现OBP10蛋白在棉铃虫Helicoverpaarmigera和烟青虫H.assulta雄蛾昆虫的精液中也大量表达,交配后将该蛋白转移到雌蛾生殖器内,随着精子与卵细胞的结合传递给受精卵,推测该蛋白可能携带保护卵的防御物质十二碳烯(dodecene),在雌雄成虫交配时传递给受精卵,避免受孕雌蛾在其附近产卵,从而减少了种群内和种群之间的自相残杀。同样,我们前期在对双委夜蛾OBPs研究时,也发现AdisOBP6在精巢中大量表达,其表达量远大于在触角中的(Sunetal., 2016)。为了进一步弄清AdisOBP6的表达规律,我们通过原核表达和抗体制备,用荧光定量PCR和Westen blot印迹方法分别对AdisOBP6在mRNA和蛋白水平上的表达情况进行分析,为今后进一步研究AdisOBP6基因的功能奠定基础。
1 材料与方法
1.1 供试虫源
本研究中所用的双委夜蛾来自河南科技大学林学院昆虫实验室,该群体自2017年7月在洛阳周边玉米田诱集成虫,然后在室内继代饲养至今。室内饲养条件为:温度27±1℃,相对湿度80%±5%,光周期16L∶8D。
1.2 AdisOBP6蛋白的结构分析
首先确定模板,将AdisOBP6(GenBank登录号: ALZ45421.1)氨基酸序列提交到Meta(http:∥bioinfo.pl/meta)在线网站,寻找同源序列,同源性在30%以上的氨基酸序列就可以作为模板用于三维结构的构建;然后采用Discover Studio 2.0软件工具中的Homology模块中的Modeler程序,以已知三维结构的同源序列模板预测AdisOBP6蛋白的三维结构。为了模拟蛋白的真实性,需要将目的蛋白的信号肽去除,根据模拟3D结构的得分情况,选取得分最高的结构作为最终结构。同时将比对文件用ESPript 3.0软件进行二级结构优化(Robert and Gouet, 2014)。
1.3 总RNA的提取及cDNA第1链的合成
收集双委夜蛾羽化后第3天的雌雄成虫触角、末龄幼虫精巢(因为幼虫雌雄难辨,我们采用随机方法解剖,以观察到精巢为准)、化蛹第3天的精巢以及成虫羽化后第1, 2, 3和5天的精巢,还有未受精卵和受精卵。将双委夜蛾各部分组织解剖后立即浸在液氮中的1.5 mL离心管内,然后保存在-80℃超低温冰箱中备用。
总RNA的提取采用RNAiso Plus Kit(TaKaRa,北京)试剂盒进行,并使用RNase-free DNase I(TaKaRa,北京)对提取的RNA进行除DNA处理。采用1%的琼脂糖凝胶电泳和NanoDrop 2000c分光光度计(Thermo Scientific)进行质量检测。采用PrimeScriptTM1st Strand cDNA Synthesis Kit(TaKaRa,北京)试剂盒对RNA进行反转录合成cDNA第1链。
1.4 重组表达载体的构建
去掉AdisOBP6蛋白序列N端信号肽,在蛋白C端加入His标签和终止密码子TAA,序列经过密码子优化后,并添加NdeI/XhoI为酶切位点序列(引物中下划线序列),由上海生工合成引物序列,AdisOBP6-NdeI-F: 5′-CCCATATGGGAGCCTGGATG AACTG-3′; AdisOBP6-XhoI-R: 5′-CCCTCGAGGGGA TGATGGTGATGATGT-3′。以1.3节合成的双委夜蛾末龄幼虫精巢cDNA为模板,用带有NdeI和XhoI酶切位点的AdisOBP6特异引物进行PCR扩增,PCR反应体系(20 μL): cDNA模板1 μL, 上下游引物(10 μmol/L)各1.5 μL, dNTPs (2.5 μmol/L)1.6 μL,ExTaqDNA聚合酶(TaKaRa,大连)0.2 μL, 10×ExTaqbuffer 2 μL, ddH2O为12.2 μL。PCR反应条件: 94℃变性5 min; 94℃变性30 s, 55℃退火30 s, 72℃延伸30 s, 35个循环; 最后72℃延伸10 min。胶回收目的片段,将目的片段克隆到pMDTM19-T载体上,转化大肠杆菌EscherichiacoliDH5α感受态细胞,挑取阳性克隆培养过夜,提取质粒。将该质粒酶切后,用T4 DNA连接酶连接到酶切过的pET-28a(+)载体上,克隆到大肠杆菌DH5α感受态细胞中,涂板过夜后挑去阳性克隆,摇菌提取组合后的pET-28a/AdisOBP6质粒,双酶切测序检测,挑取正确的质粒备用。
1.5 AdisOBP6重组蛋白的表达、纯化及抗原制备
取1 μL重组的pET-28a/AdisOBP6质粒转化到大肠杆菌BL21(DE3)感受态细胞中,涂布在LB固体培养基(含卡那霉素)上,37℃培养过夜。挑取阳性单菌落于5 mL的LB培养基(含卡那霉素)中37℃ 220 r/min摇菌培养过夜培养。将培养的菌液按1∶100(v/v)比例接种于3 L的LB液体培养基(含卡那霉素)中,37℃ 220 r/min培养,当OD值达到0.6时,添加终浓度为0.5 mmol/L IPTG,220 r/min,20℃和37℃分别诱导过夜,离心收集细胞菌体。
将收集的菌液超生破碎,4℃ 12 000 r/min离心20 min,收集上清和沉淀,SDS-PAGE蛋白电泳检测蛋白的可溶性。采用镍琼脂糖亲和层析法纯化蛋白,用20, 50和500 mmol/L咪唑洗脱,纯化的蛋白经SDS-PAGE检测后,在1×PBS(pH 7.4)中4℃透析过夜,再用PEG20000浓缩,0.45 μm滤膜过滤后,进行SDS-PAGE电泳检测。检测合格后,分装1 mL/管,共5管,-80℃冻存,用于抗体制备。
1.6 AdisOBP6抗体的制备
初免抗原为蛋白抗原与等体积弗氏完全佐剂混匀乳化,二免、三免、终免抗原为蛋白抗原与等体积弗氏不完全佐剂混匀乳化,免疫新西兰大白兔4次。采用ELISA法检测抗体效价,将AdisOBP6抗体分别稀释后,在450 nm的波长下测OD值,血清效价值≥2.5×阴性值为合格。检测抗体为阳性后保存于-80℃备用。抗体由生工生物工程(上海)股份有限公司制备。
1.7 AdisOBP6表达谱测定
荧光定量PCR在StepOne Plus型荧光定量PCR(ABI, Foster, CA, 美国)仪器上进行操作,使用2×SG Fast qPCR Master Mix(High Rox,B639273,BBI)试剂盒测定。双委夜蛾AdisGAPDH(GenBank登录号: KT361883)基因作为内参基因。采用Primer3在线工具设计引物,AdisOBP6正向引物: 5′-AGACAGAAGACAATGCCTGACAGTG-3′;反向引物: 5′-CTGACCTCAACATCATTCACGCTT-3′。AdisGADPH正向引物: 5′-CTGCTCATTTAGAGGGTGGTGC-3′;反向引物: 5′-TCTTCTGGGTAGCGGTGGTAG-3′。 将1.3节合成的cDNA样品稀释10倍作为模板上机检测。PCR反应体系: SybrGreen qPCR Master Mix 10 μL, 正反引物(10 μmol/L)各0.4 μL, cDNA模板(200 ng/μL)2 μL, 7.2 μL ddH2O补齐至20 μL。反应程序: 95℃预变性3 min; 95℃变性5 s, 60℃退火并延伸30 s, 共45个循环。熔点曲线设置为95℃持续15 s,降到60℃持续60 s,再升到95℃保持15 s。每个组织3次生物学重复,每生物学重复雌雄触角各来自50头个体、不同时期的精巢来自20头个体、受精卵和非受精卵各500粒,技术重复3次。以双委夜蛾雌成虫触角中基因表达量为对照,利用相对表达量公式2-ΔΔCt进行计算(Livak and Schmittgen, 2001)。
提取双委夜蛾羽化后第3天的雌雄成虫触角、末龄幼虫精巢、化蛹第3天的精巢以及成虫羽化后第1, 2, 3和5天的精巢,还有未受精卵和受精卵10种组织的总蛋白,每种组织重复3次。蛋白变性后,使用5%浓缩胶和15%的分离胶进行SDS-PAGE蛋白电泳。然后在200 mA电流下持续50 min,进行转膜。用含5%脱脂奶粉的TBST封闭液,室温摇床封闭2 h,一抗(AdisOBP6抗体)孵育4℃过夜,二抗37℃摇床孵育2 h。ECL显色曝光,拍照。为了检测样品蛋白情况,用小鼠单抗β-actin(预实验显示蛋白表达稳定)做一抗为对照组,进行Westen blot检测。
1.8 数据分析
数据采用SPSS 17.0(IBM, Chicago, IL, 美国)软件中的单因素方差分析(one-way ANOVA)和Tukey氏HSD法进行差异显著性分析,P<0.05表示样品间存在显著性差异。
2 结果
2.1 AdisOBP6的结构特征
通过结构比对得出AdisOBP6与冈比亚按蚊AnophelesgambiaeAgamOBP4结构最为相似,该结构为X衍射得到的蛋白结构,可靠性强,因此选择AgamOBP4的结构作为AdisOBP6的三维结构预测模板。比对可见,AdisOBP6具有气味结合蛋白保守的6个半胱氨酸,并具有7个α-螺旋结构(图1: A, B),蛋白N端和C端明显可见(图1: B),通过表面结构模拟,可见α-螺旋形成一个结合口袋,用于运输气味分子(图1: C)。
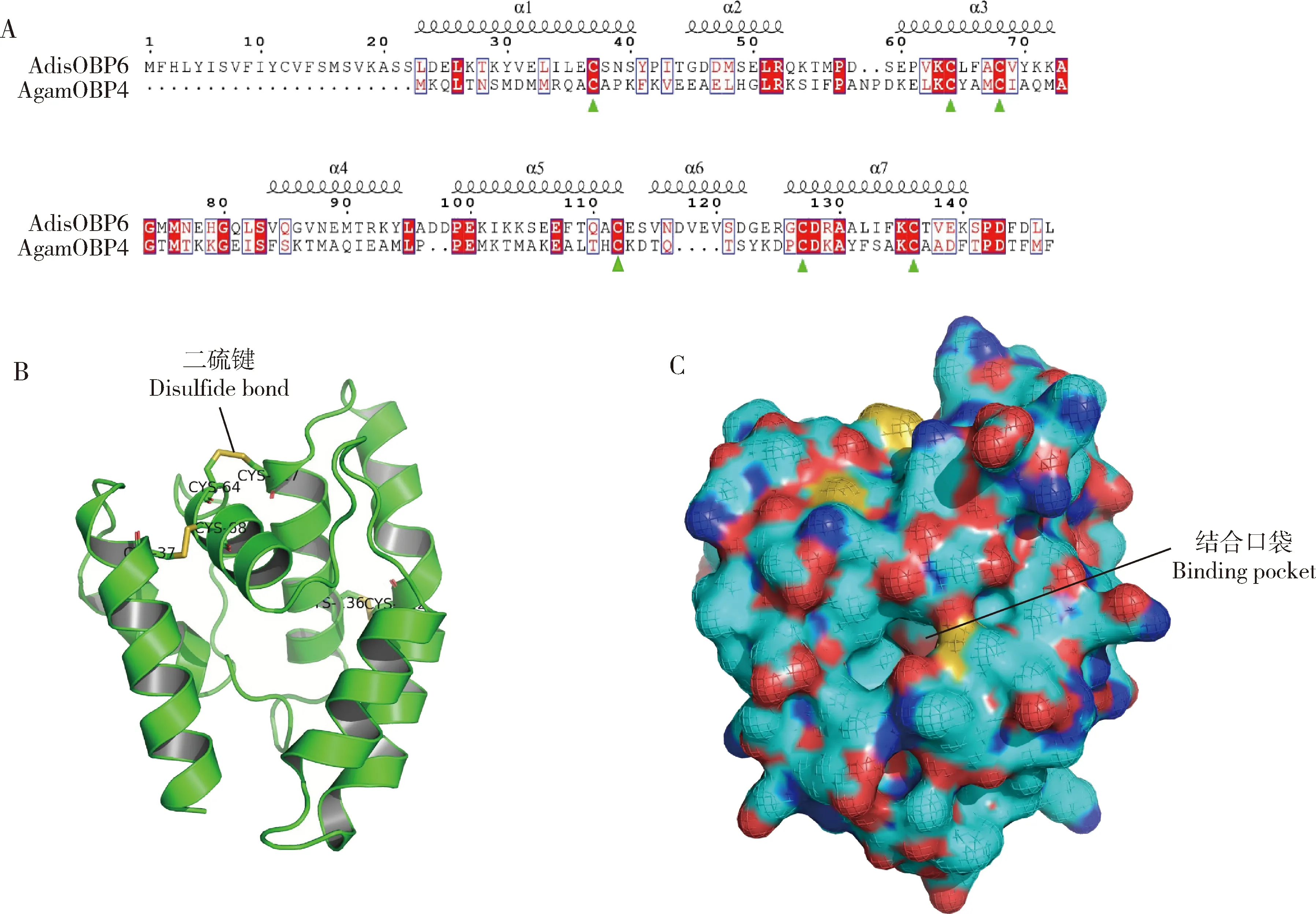
图1 双委夜蛾AdisOBP6二级结构及三级结构模拟图
2.2 原核表达载体的构建和鉴定
用带有酶切位点的引物PCR扩增重组质粒pET-28a/AdisOBP6,如图2所示,在400 bp左右的地方出现目的条带,与理论大小基本相符合。挑选pET-28a/AdisOBP6阳性转化子经质粒小提后分别用NdeI和XhoI进行双酶切鉴定,出现5 kb和400 bp左右的两个序列片段,与预测目的条带的结果相一致。

图2 pET-28a/AdisOBP6重组质粒PCR(A)和酶切鉴定(B)
2.3 AdisOBP6重组蛋白在大肠杆菌中的诱导表达
为了达到理想的表达效果,我们采用小样分别在20℃和37℃条件下用IPTG(0.5 mmol/L)诱导。从图3中可知,在20℃条件下,诱导效果最佳,目的蛋白表达量最高。在20℃和37℃条件下蛋白都大量表达在上清中,沉淀中很少,说明蛋白主要为可溶性蛋白。
2.4 AdisOBP6蛋白纯化
SDS-PAGE检测结果表明,在20 mmol/L咪唑洗脱时出现单一清晰的目的条带,随着咪唑浓度增加条带清晰度越来越低(图4: A);将透析和浓缩后的纯化蛋白进行SDS-PAGE电泳检测结果显示,AdisOBP6蛋白条带清晰,杂带少,说明蛋白纯化效果较好(图4: B)。
2.5 AdisOBP6抗体特异性
ELISA法测定抗体的效价,吸光值随着抗体稀释倍数的增加逐渐降低;4次重复的抗体分别稀释到512 000, 512 000, 512 000和64 000倍时,抗体效价值≥2.5×阴性值。为了鉴定所制备的AdisOBP6抗体的特异性,以Western blot法检测抗体对AdisOBP6重组蛋白的识别(图5),结果显示,重组蛋白与AdisOBP6抗体很好地结合在一起,说明该抗体确实为AdisOBP6抗体,故所制备的抗体可用于AdisOBP6功能的相关研究。

图3 重组蛋白AdisOBP6的SDS-PAGE电泳检测
2.6 AdisOBP6基因在mRNA水平和蛋白质水平上的表达谱
荧光定量PCR结果显示,AdisOBP6在双委夜蛾精巢中的表达量远高于在触角中的,在幼虫期的精巢中AdisOBP6就已经开始表达,蛹期表达量显著低于幼虫期的(P<0.05)。成虫羽化后,AdisOBP6在精巢中的表达量逐渐进入高峰。未受精卵和受精卵中AdisOBP6几乎不表达或表达量极低(图6: A)。
Western blot检测分析发现,AdisOBP6蛋白主要在精巢中表达,在雌雄成虫触角、受精卵和未受精卵中表达量很低。在幼虫精巢中AdisOBP6蛋白就开始表达一直延续到成虫期,在成虫期精巢AdisOBP6的表达量达到高峰(图6: B)。

图4 AdisOBP6蛋白纯化(A)和浓缩后(B)的SDS-PAGE电泳检测

图5 Western blot检测抗体对重组蛋白AdisOBP6的特异性

图6 双委夜蛾AdisOBP6基因在mRNA(A)和蛋白(B)水平上的表达谱
3 讨论
目前获得蛋白三维结构的方法主要是核磁共振(NMR)和X-射线衍射等方法,昆虫多种气味结合蛋白三维结构也被解析(Sandleretal., 2000; Lartigueetal., 2002; Leeetal., 2002; Pesentietal., 2009)。从昆虫气味结合蛋白三维结构来看,OBPs包含有6个α-螺旋,并命名为α1, α2, α3α, α4α, α5和α6,其中α1和α3, α3和α6, 以及α5和α6分别连接成3个二硫键支撑蛋白结构,使蛋白结构更稳定,并且围成一个口袋形状,将亲水性氨基酸分布到口袋外面,疏水氨基酸分布在口袋内,形成疏水性口袋,主要用于结合一些亲脂性气味分子,将这些气味分子转运到受体上(Jiangetal., 2009; Xuetal., 2010)。采用同源建模的方法,特别是序列一致性较高时,能够准确预测到OBPs的三维结构,促进OBPs功能的研究。我们通过序列比对,AdisOBP6与冈比亚按蚊AgamOBP4氨基酸序列一致性最高,并进行同源建模,预测了AdisOBP6的三维结构,发现AdisOBP6具有7个α-螺旋。昆虫OBPs的构象变化具有pH依赖性(Xuetal., 2010; Tianetal., 2016),在pH酸性条件下,氨基酸序列的C端形成第7个α-螺旋占据结合腔释放配体;pH中性时,第7个α-螺旋从结合腔排出,漏出结合腔内的疏水性残基,重新结合气味分子(Xu and Leal, 2008; Xuetal., 2010),此现象并非所有鳞翅目OBPs共有。
原核表达蛋白纯化是直接关联着后期蛋白功能的研究,当前对原核表达可溶性His标签融合蛋白纯化最常用的方法是镍琼脂糖亲和层析法纯化蛋白。该方法容易获得高纯度的蛋白,纯化效率高,操作方便。然而在原核表达的时候经常出现包涵体,还需经过变性复性才能恢复生物活性(张庶民和祁自柏, 1995),操作复杂。因此在原核表达时,经常降低温度,以便使蛋白尽量为可溶性蛋白。本研究采用不同温度(20℃和37℃)进行原核表达,结果表明两种温度下都能成功表达出可溶性的AdisOBP6蛋白(图3),且在20℃时蛋白表达量更高。此研究为后期进行结合实验等蛋白功能研究奠定基础。
昆虫大多数OBPs主要表达在触角中,也有少量OBPs在头、口器、足、翅和中肠等非嗅觉器官中表达(Zhuetal., 2013; Liuetal., 2015; 巩雪芳等, 2020),暗示它们可能还参与了除嗅觉以外其他的生理功能。例如,黑花蝇Phormiaregina的OBP56a在口器中高度表达,推测对膳食脂肪酸具有增溶作用(Ishidaetal., 2013);埃及伊蚊的OBP45在卵巢中大量表达,可能参与卵膜的形成(Costa-da-Silvaetal., 2013);中华蜜蜂Apisceranacerana的OBP15在足中特异性高度表达,推测可能在采集花粉和花蜜时用于味觉的识别(Duetal., 2019)。我们发现AdisOBP6基因在精巢中大量表达,并且在幼虫期AdisOBP6就已经开始表达,蛹期表达量低于幼虫期,成虫期表达量逐渐进入高峰,未受精卵和受精卵中AdisOBP6几乎不表达或表达量极低;Western blot印迹试验也证实了,AdisOBP6蛋白在精巢中大量表达,但在触角、受精卵和未受精卵中几乎没有检测到AdisOBP6蛋白的存在(图6),推测AdisOBP6可能参与了授精过程。同样,埃及伊蚊的OBP22和棉铃虫、烟青虫的OBP10也在精液中高度表达(Lietal., 2008; Sunetal., 2012),具体的生理功能只是推测,还需要进一步去证实。
本研究成功地纯化出AdisOBP6可溶性蛋白,并制备了相应的抗体,同时针对AdisOBP6在mRNA水平和蛋白质水平上的表达情况进行了研究,为今后研究AdisOBP6在双委夜蛾精巢内的具体生理功能奠定了基础,同时也丰富了昆虫气味结合蛋白基因功能的认识。

