表没食儿茶素没食子酸酯对脑出血大鼠脑组织氧化应激和线粒体的影响
杨莉 赵冉冉 杨峰 韩金涛 祁晓芳 李和军 张文忠
脑出血是我国常见的脑血管病,是由脑实质内血管破裂引起出血的急危重症,其致死率和致残率高[1-3]。脑出血后将导致继发性脑损伤,使脑功能进一步受到损害,目前认为,继发性脑损伤的机制与氧化应激、炎性反应、凋亡等自身损伤过程相关[4,5]。氧化应激是指机体在应激状态下,体内氧自由基的生成和自身对自由基清除、修复能力之间的不平衡状态。在脑出血后,血肿周围神经细胞凋亡,机体氧自由基生成增加,导致氧化应激发生,氧化应激进一步加重脑损伤,形成恶性循环,进而影响神经功能[6,7]。表没食儿茶素没食子酸酯(epigallocatechin-3-gallate,EGCG),是我国传统绿茶中的主要有效成分,目前已发现EGCG具有抗氧化、抗凋亡、抗炎等多种生物功效[8]。EGCG通过直接作用于自由基、激活抗氧化酶活性、与金属离子螯合等多种机制在机体内发挥抗氧化的保护作用。本研究通过建立脑出血动物模型,观察EGCG对大鼠脑出血血肿周围组织氧化应激状态的影响。
1 材料与方法
1.1 实验动物 健康清洁雄性SD大鼠60只,体重280~300 g(河北医科大学实验动物中心提供),随机数字表法分为假手术组(SHAM 组)、0.9%氯化钠溶液对照组(ICH 组)和治疗组(EGCG 组),EGCG组给予腹腔注射EGCG 50 mg/kg,Sham组和ICH组给予等量0.9%氯化钠溶液腹腔注射,连续7 d。
1.2 脑出血模型制备 采用脑内注入胶原酶法建立大鼠脑出血模型。3.6%水合氯醛以10 ml/kg剂量腹腔注射以麻醉大鼠。麻醉后SD大鼠呈固定于立体定位仪,呈俯卧位,四肢伸开,剪去大鼠头顶部毛发、碘伏和酒精消毒手术区域,切开大鼠头部皮肤。使用脑立体定位仪定位大鼠左侧尾状核区,在颅骨表面标记出以前囟为中点向左侧旁开3.0 mm处,自标记点使用动物骨钻钻开骨性结构,不可损伤硬脑膜,调节定位仪后,垂直将微量进样器插入钻孔中,进针深度6.0 mm,此为左侧尾状核区,将0.5单位的胶原酶5 min注射完毕,并保留针10 min后缓慢拔出,以骨蜡封闭钻孔处。消毒手术区域并缝合头皮。假手术组手术步骤同上,仅将针置入尾状核,不注入胶原酶。麻醉苏醒后,观察大鼠出现神经功能缺损症状,则为造模成功。
1.3 方法 脑出血模型制备成功48 h后,采用随机数字表法,将3组大鼠随机分为2个亚组,每个亚组10只。
1.3.1 神经功能缺损评分:使用国际公认的大鼠卒中后神经功能缺损标准,即改良的神经功能缺损评分法(modified neurological severity score,mNSS),评价各组大鼠神经功能受损情况。评价内容包括有平衡木实验、行走测试,感觉测试、反射缺失、反常运动和提尾反射。总分为18分,分数越高,提示大鼠神经功能障碍越重,1~6分提示神经功能轻度受损,7~12分为神经功能中度受损,13~18分提示神经功能中度受损[9]。
1.3.2 线粒体膜电位和活性氧自由基(reactive oxygen species,ROS)检测:大鼠断头取脑,冰盘上快速分离取脑组织,并眼科剪将脑组织剪碎后,研磨脑组织,经300目筛网过滤后,即可制备脑组织单细胞悬液,以4 000 r/min室温下离心3 min,弃上清后分为2份,一份与JC-1工作液混合,37℃避光孵育20 min,进行线粒体膜电位分析,另一份与DCFH-DA工作液混合,37℃避光孵育20 min后行脑组织ROS检测。
1.4 SOD检测 大鼠断头取脑后冰上迅速分离脑组织,存入液氮中,于-80℃保存备用。用移液管取体积总量为组织重量的9倍冷0.9%氯化钠溶液。2/3的冷0.9%氯化钠溶液置于烧杯中,加入剪碎脑组织,然后倒入玻璃匀浆管,再将剩余的1/3冷生理盐水冲洗烧杯中残留的脑组织块,一起放入匀浆管中进行匀浆,匀浆器放在冰浴中研磨6~8 min,使组织达到匀浆化。离心机2 000 r/min离心8 min,取适量上清液进行SOD检测。SOD检测利用分光光度仪法,在脑组织匀浆上清液中加入检测工作液,混匀后37℃孵育20 min,并在560 nm测定吸光度。

2 结果
2.1 神经功能缺损评分 SHAM组大鼠无神经功能缺损,与SHAM组比较,ICH组和EGCG组大鼠脑出血后mNSS评分明显升高 (P<0.05),与ICH组比较,EGCG组mNSS评分明显下降(P<0.05)。见表1。
表1 EGCG对脑出血大鼠mNSS评分的影响 n=10,分,
2.2 脑组织线粒体膜电位的变化 与SHAM组相比,ICH组大鼠脑组织的线粒体膜电位显著下降(P<0.01),EGCG组与ICH组相比,线粒体膜电位明显上升(P<0.01)。见表2。
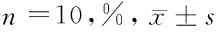
表2 脑组织中线粒体膜电位的变化
2.3 脑组织SOD和ROS水平的改变 与SHAM组相比,ICH组大鼠脑组织中的SOD水平明显下降(P<0.01);与ICH组相比,EGCG组大鼠脑组织中SOD水平明显上升(P<0.01)。与SHAM组相比,ICH组大鼠脑组织中ROS水平明显下降(P<0.01);与ICH组相比,EGCG组ROS水平明显上升(P<0.01)。见表3。

表3 脑组织中SOD和ROS水平的改变
3 讨论
脑出血是临床常见的脑血管病,占脑卒中的15%,多数是由于高血压导致的微血管瘤的破裂引起,具有高致病率、高致残率、高致死率的特点,其发病率有逐渐上升趋势,发病年龄越来越年轻化[1,2]。临床上脑出血的治疗大多以手术、康复治疗以及脱水降颅压治疗为主,但多数患者最终遗留神经功能障碍[3]。
目前国际公认的研究脑出血的模型包括有胶原酶诱导脑出血模型和自体血注入形成脑出血模型等。Rosenberg等[9]在立体定位仪辅助下注入大鼠尾状核含胶原酶的0.9%氯化钠溶液2 ml,注入10 min后即发生脑血管外血液的渗出,出血点周围水肿明显。与人类脑出血情况相似,充分模拟了人类脑血肿急性扩大的发病过程,该模型制备简单、快捷、重复性好。
脑出血发生后临近脑组织受血肿压迫,导致脑血流动力学异常及脑血流的减少,而脑血流减少导致氧化应激的发生,氧自由基增加,促进颅内水肿,诱发炎性反应,炎性反应的发生进一步加重颅内水肿,形成恶性循环,脑功能出现损伤[10]。机制保护脑组织,缓解脑出血后继发的神经功能损伤,对于脑出血患者生活治疗的提升有重要的临床意义[11,12]。探讨ICH的氧化应激、线粒体功能障碍等引起的继发性损伤机制对此至关重要。是线粒体生成ATP过程中的副产物,线粒体的氧化磷酸化是H2O2、O2-等内源性自由基主要来源。在生理情况下,ROS是细胞代谢的产物,ROS的生成和清除呈动态平衡。然而在脑出血后,大量ROS快速生成,破坏了ROS生成和清除的平衡。过量ROS导致脂质过氧化,蛋白质氧化,DNA损伤和线粒体损伤,最终导致细胞和组织的破坏[13]。此外,ROS能促进神经元凋亡,星形胶质细胞的坏死,BBB破坏,导致脑水肿加重[14]。线粒体是机体自由基的主要来源,同时也是自由基损伤的首要靶点[15]。细胞内ROS生成的主要部位是在线粒体的CI和CⅢ。线粒体功能障碍时导致氧化应激,氧化应激性损伤进一步造成线粒体功能损伤,线粒体功能障碍和氧化应激损伤形成恶性循环[16,17],其中线粒体发挥了中心地位,因此线粒体保护和抗氧化策略可能成为治疗脑出血的有效途径。在脑出血后氧化和抗氧化机制的失衡诱发氧化应激,导致过量氧自由基的生成,氧化应激是脑出血后继发脑损伤的关键因素,缓解氧化应激、保护线粒体功能、减少ROS的生成有利于减轻脑出血后的神经功能损伤。
EGCG 是从我国绿茶中提取的一种多酚类单体,绿茶儿茶素中含量最高的抗氧化组分,研究发现EGCG具有抗肿瘤、抗氧化、抗炎等药理作用,对心脑血管系统和神经系统有保护作用[18-21]。ECCG对脑出血是否有保护作用还未见报道。本研究发现,在大鼠脑出血模型中,脑组织中线粒体膜电位下降,ROS含量明显升高,自由基清除剂SOD含量减少,表明在脑出血后,脑组织线粒体功能受损,氧化还原状态失衡,脑组织中存在有氧化应激损伤,这与之前的研究结果相一致,腹腔注射EGCG组大鼠脑组织中的ROS含量和线粒体膜电位下降均明显缓解,SOD含量增加,表明在脑出血大鼠模型中,EGCG具有保护线粒体功能和减轻氧化应激损伤的作用。
综上所述,在脑内注入胶原酶法建立大鼠脑出血模型中,EGCG对于脑组织中氧化应激损伤和线粒体功能有一定的改善作用,绿茶提取物EGCG对脑出血的临床治疗可能有潜在价值。

