非霍奇金淋巴瘤合并肝功能损害患者的危险因素及风险预测模型的建立
谭鑫 乌仁娜 于奇宁 刘玲
淋巴瘤是血液科常见的恶性肿瘤疾病,近年来发病率呈逐年递增的趋势[1]。通常淋巴瘤分为非霍奇金淋巴瘤(Non-Hodgkin lymphoma,NHL)和霍奇金淋巴瘤(Hodgkin lymphoma,HL)。其中NHL发病率远较HL常见,有很强的异质性。NHL病因起源于淋巴结和淋巴组织,临床病理形态复杂,目前联合化疗是临床治疗NHL的主要手段,治疗预后较好,尤其B细胞NHL使用化疗手段疗效比较突出[2]。化学治疗能有效治疗NHL,杀伤肿瘤细胞,提高患者生存时间和生存率,甚至有NHL患者仅化疗能治愈的案例报道。但化疗在杀伤肿瘤细胞的同时也对人体正常细胞构成伤害,如伤害肝脏细胞,引起肝功能损害[3,4]。还有研究表明,淋巴瘤的免疫化疗可以使乙肝病毒(HBV)激活,影响患者的化疗和生存质量,还可能导致肝衰竭致死[5],而我国HBV感染和淋巴瘤发生率均较高,淋巴瘤患者的HBsAg携带率远较普通人群为高[6-8]。综上,我们在淋巴瘤化疗过程中关注肝损害的危险因素至关重要。本文回顾分析了120例接受NHL患者临床资料,分析了NHL患者化疗后肝功能损害的发生情况及其危险因素并建立了风险预测模型,为确保NHL患者的化疗正常进行并规避肝功能损害提供理论依据。
1 资料与方法
1.1 一般资料 选取我院血液科2013年1月至2019年4月收治的120例NHL患者,按照WHO关于淋巴瘤的分型标准[9]筛选出证实患有NHLⅡ~Ⅳ期且资料完整的患者进行统计分析研究。纳入标准:化疗前患者肝功能基本正常:丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)和总胆红素(TBL)水平不超过正常上限的1.25倍,碱性磷酸酶和谷氨酰转肽酶水平不超过正常上限的2.5倍,白蛋白水平正常。最后筛选出120例NHL患者,其中男64例,女56例;年龄13~74岁,平均年龄(41±9)岁。按照肝损害的有无分为有肝损害组(156例)和无肝损害组(64例)。
1.2 研究方法 120例NHL患者化疗方案包括CHOP(环磷酰胺+吡柔比星+长春瑞滨+地塞米松)、CHOPL(门冬酰胺酶+CHOP)、MMED(米托蒽醌+依托泊苷+甲氨蝶呤+地塞米松)、MAED(米托蒽醌+依托泊苷+阿糖胞苷+地塞米松)、R-CHOP(利妥昔单抗+ CHOP)。每个化疗疗程结束查患者肝功能指标:ALT、AST、TBL、直接胆红素(DBL)、间接胆红素(IBL)以及胆固醇(CHOL)、三酰甘油(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)。
1.3 评价标准 参考文献[10]上关于肝损害的定义:ALT水平超过正常上限1.25倍(50 U/L)或总胆红素超过正常上限2.5倍(55.6 μmol/L)。我们把脂肪肝也归类于肝损害的范畴,脂肪肝的诊断参考2010年《非酒精性脂肪性肝病诊疗指南》[11]和郭万学的《超声医学》[12]B超检查显示有脂肪肝表现。
1.4 统计学分析 应用SPSS 20.0统计软件,计数资料采用实际数量描述,采用χ2检验,筛选独立危险因素选用Logistic回归方程,列线图采用R(R3.5.3)软件包,应用rms程序包,建立列线图预测模型,同时应用caret程序包进行Bootstrap 法做内部验证,采用rms 程序包计算一致性指数(C-index),采用ROCR及rms程序包作ROC 曲线,P<0.05为差异有统计学意义。
2 结果
2.1 2组一般临床资料比较 2组性别比、年龄、体重、BMI、高血脂、高血压、糖尿病差异均无统计学意义(P>0.05),2组是否饮酒、是否抽烟、是否首次化疗、是否使用皮质激素、是否携带HBV、是否使用蒽环类药物及是否使用免疫调节剂有统计学意义(P<0.05)。见表1。
2.2 Logistic回归分析结果 依据有肝损害组与无肝损害组一般临床相关资料对比结果,对是否饮酒、是否抽烟、是否首次化疗、是否使用皮质激素、是否携带HBV、是否使用蒽环类药物及是否使用免疫调节剂作二元Logistic回归分析,结果表明:饮酒(OR=0.125,95%CI:0.026~0.608)、抽烟(OR=0.112,95%CI:0.026~0.484)、首次化疗(OR=12.713,95%CI:2.933~55.107)、使用皮质激素(OR=0.046,95%CI:0.009~0.238)、携带HBV(OR=0.085,95%CI:0.018~0.392)、使用蒽环类药物(OR=0.095,95%CI:0.024~0.376)及使用免疫调节剂(OR=0.090,95%CI:0.022~0.363)为肝损害的独立危险因素(P<0.05),均与肝损害高度相关。见表2。
2.3 预测NHL患者肝损害风险模型的建立 本研究基于是否饮酒、是否抽烟、是否首次化疗、是否使用皮质激素、是否携带HBV、是否使用蒽环类药物及是否使用免疫调节剂7项NHL患者肝损害风险模型的独立危险因素,建立预测NHL患者肝损害风险模型的列线图模型。并对该模型进行验证,预测值同实测值基本一致,说明本研究的列线图预测模型具有较好的预测能力,同时本研究使用Bootstrap内部验证法对NHL患者发生肝损害风险的列线图模型进行验证,C-index指数高达0.916(95%CI:0.899~0.933),说明本研究列线图模型具有良好的精准度和区分度。见图1~3。
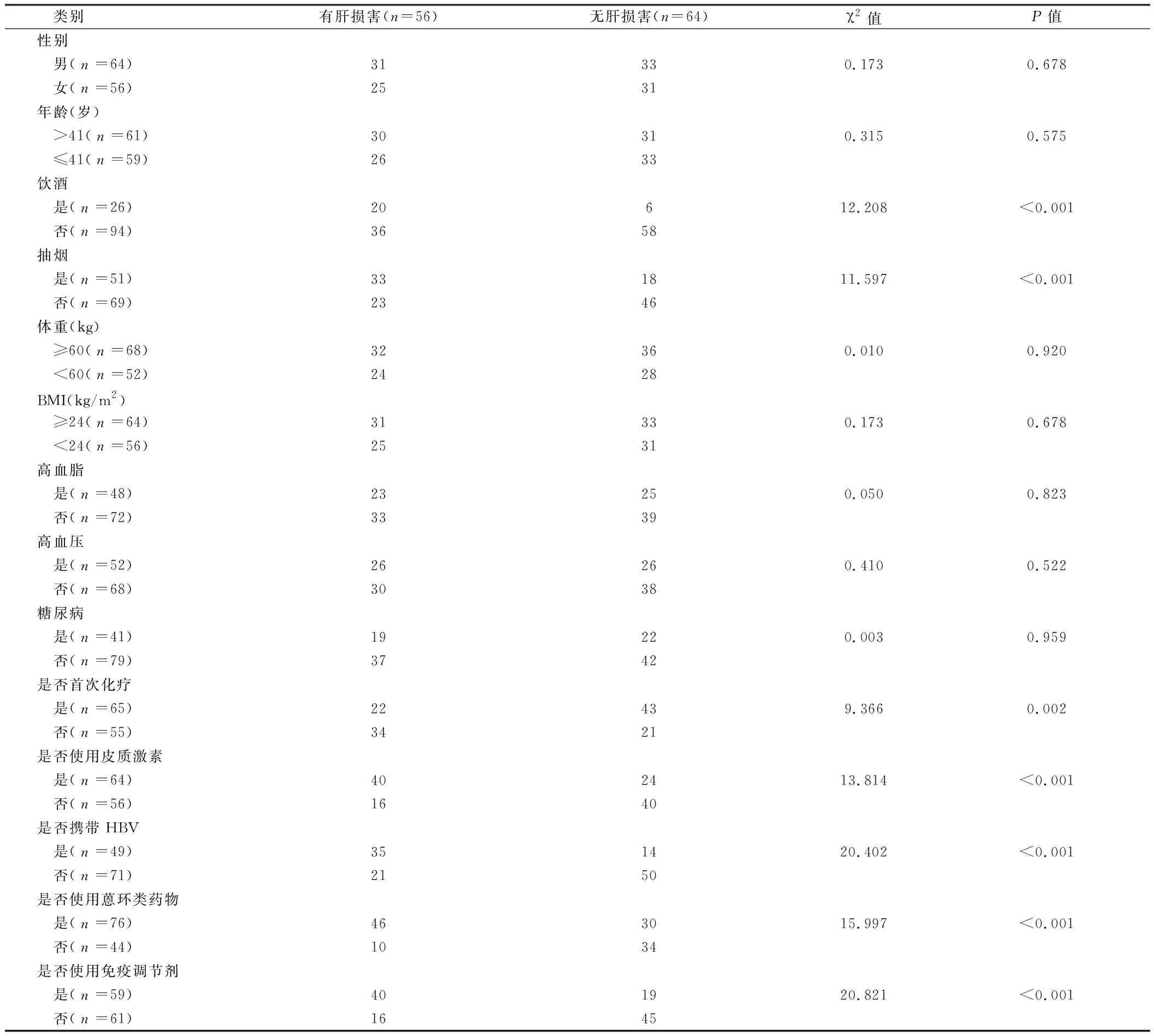
表1 2组一般临床资料单因素分析 例
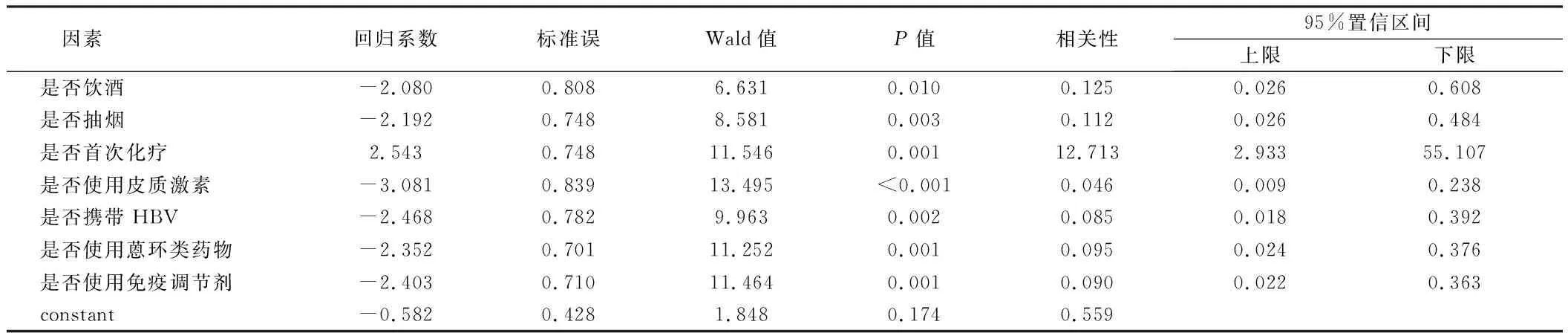
表2 Logistic回归分析结果
3 讨论
我国NHL患者的发病率呈逐年上升的趋势,且化疗后肝损害的发生率较高,严重时致肝衰竭并致患者死亡[13]。在NHL患者的临床治疗过程中,减轻患者的肝功能负担,消除致肝损害的危险因素是治疗成功与否的关键。有研究报道NHL同时携带HBV的患者肝脏损伤的发病率会明显增加,化疗能激活HBV而加重肝脏的损害,HBV阳性NHL患者化疗后肝损害的发生率明显高于未携带HBV的NHL患者[14-18]。我们的研究结果也证实了HBV在NHL患者的化疗过程中是独立的危险因素。
已有研究阐明NHL患者化疗后肝功能受损也可能与使用免疫抑制剂、糖皮质激素有关[19]。本研究与报道的结果一致,我们发现NHL化疗方案大多含有免疫抑制剂和糖皮质激素,这增加了病毒激活的几率,使HBV重新有机会大量复制,进而引起肝脏损耗[20]。临床上实际工作中我们发现有HBV阳性NHL患者使用了糖皮质激素后肝损害很严重的病例。

图1 预测NHL患者肝损害风险模型的建立图2 列线图模型预测NHL患者肝损害风险的验证图3 列线图模型预测NHL患者肝损害风险的ROC曲线
蒽环类药物抗生素是一类广谱抗肿瘤药,可用于NHL患者的治疗。这类药物常有心脏毒性、骨髓抑制、肝脏毒性、肾脏毒性等。有研究表明其肝脏毒性机制主要通过影响肝脏氨基酸代谢、脂质代谢、嘌呤代谢和能量代谢引起的,较为复杂[21]。
此外,众所周知,长期大量饮酒能致酒精性肝病(ALD),包括酒精性肝炎(AH)、肝硬化、脂肪肝和肝纤维化等,严重可致肝细胞坏死甚至肝衰竭。不为多数人知的是抽烟对肝脏也有毒性作用,尼古丁代谢能给肝脏代谢造成严重负担,引起ALT和AST升高,造成明显的肝损伤[22]。
logistic回归为非线性概率型的预测模型,能够研究分类观察结果和一些协变量之间的多变量分析方法,常用于探讨诱发疾病的高危因素[23]。本研究通过单因素及多因素 logistic回归分析结果表明:饮酒(OR=0.125,95%CI:0.026~0.608)、抽烟(OR=0.112,95%CI:0.026~0.484)、首次化疗(OR=12.713,95%CI:2.933~55.107)、使用皮质激素(OR=0.046,95%CI:0.009~0.238)、携带HBV(OR=0.085,95%CI:0.018~0.392)、使用蒽环类药物(OR=0.095,95%CI:0.024~0.376)及使用免疫调节剂(OR=0.090,95%CI:0.022~0.363)为肝损害的独立危险因素,均与肝损害高度相关。这表明:饮酒、抽烟、首次化疗、使用皮质激素、携带HBV、使用蒽环类药物及使用免疫调节剂均为NHL患者可能导致肝损害的独立危险因素,具有统计学差异,均与肝损害高度相关,结果与已有的文献报道一致。
列线图能够把复杂的回归方程转化为可视化图形,让预测模型的结果更加清晰,方便患者的风险评估[24]。本研究基于是否饮酒、是否抽烟、是否首次化疗、是否使用皮质激素、是否携带HBV、是否使用蒽环类药物及是否使用免疫调节剂7项NHL患者肝损害风险模型的独立危险因素,建立预测NHL患者肝损害风险模型的列线图模型。并对该模型进行验证,预测值同实测值基本一致,说明本研究的列线图预测模型具有较好的预测能力,同时本研究使用Bootstrap 内部验证法对NHL患者发生肝损害风险的列线图模型进行验证,C-index指数高达0.916(95%CI:0.899~0.933),说明本研究列线图模型具有良好的精准度和区分度。
综上所述,NHL患者临床化疗期间定期监测和复查肝功能变化,尽量避免使用糖皮质激素、蒽环类药物和免疫调节剂,如果发现任何异常,则应重新检查患者的HBV-DNA复制状态,并适时给肝辅助用药和抗乙肝药物,防止重症肝炎的发生,增加NHL患者的生存几率,这些措施对NHL患者具有重要的意义。

