FMEA 改进过氧化氢低温等离子灭菌器安全的应用研究
□ 王冬 WANG Dong 张曼晖 ZHANG Man-hui 许锋 XU Feng
近年来院感事件时有发生。美国急救医学研究所(Emergency Care Research Institute, ECRI)每年发布的十大医疗危害指南,感染风险已从2019 年的第5 位上升到2020 年的第3 位。2015年国务院提出“放管服”改革方案,在消毒器械领域产品资质要求也由审批制转变为备案制,最终采用安全评价报告。因此,需要加强过氧化氢低温等离子灭菌器的风险管理。风险概念具有两个组成部分:一是损害发生的概率,即损害发生的经常性;二是损害的后果,即它的严重性[1-2]。
失效模式与效应分析(Failure Mode and Effects Analysis,FMEA)是系统地识别和评价单一故障模式后果的技术。每次分析一个部件,通常着眼于一个单一故障条件。以“自底向上”模式进行,即随着程序进到下一个更高的功能系统层次。本文利用FMEA 对过氧化氢低温等离子灭菌器安全使用进行管理。
资料和方法
1.一般资料。某医院在用过氧化氢低温等离子灭菌器10 台,包含两个品牌、三个型号。选择2019 年1 月—8 月灭菌器运行数据为对照组,2019 年9 月—2020 年4 月灭菌器运行数据为改进组。
2.方法。对照组采用过氧化氢低温等离子灭菌器常规管理措施,改进组实施FMEA 风险管理。基于FMEA 的过氧化氢低温等离子灭菌器风险流程包括:风险识别、风险分析与评估、风险控制与效果评价。
2.1 风险识别。风险识别包括:选定主题、组建FMEA 团队及绘制流程图。选定过氧化氢低温等离子灭菌器安全使用风险评估及改进为主题。组建FMEA 小组,小组成员包括医学工程处装备管理人员、感染办负责人、手术室护士长和工程师。采用头脑风暴法,依据国家标准《过氧化氢低温等离子体灭菌器》(GB/T32309-2015)、《过氧化氢气体等离子体低温灭菌装置的通用要求》(GB27955-2011);行业标准《医疗机构消毒技术规范》(WS/T367-2012)、《医疗器械风险管理对医疗器械的应用》(YY/T 0316-2016);中华护理学会编写的《硬式内镜清洗消毒及灭菌技术操作指南》、灭菌器和被灭菌器械、设备说明书等。结合实际工作经验,绘制过氧化氢低温等离子灭菌器安全使用的风险流程图(图1),并查找潜在的失效模式。
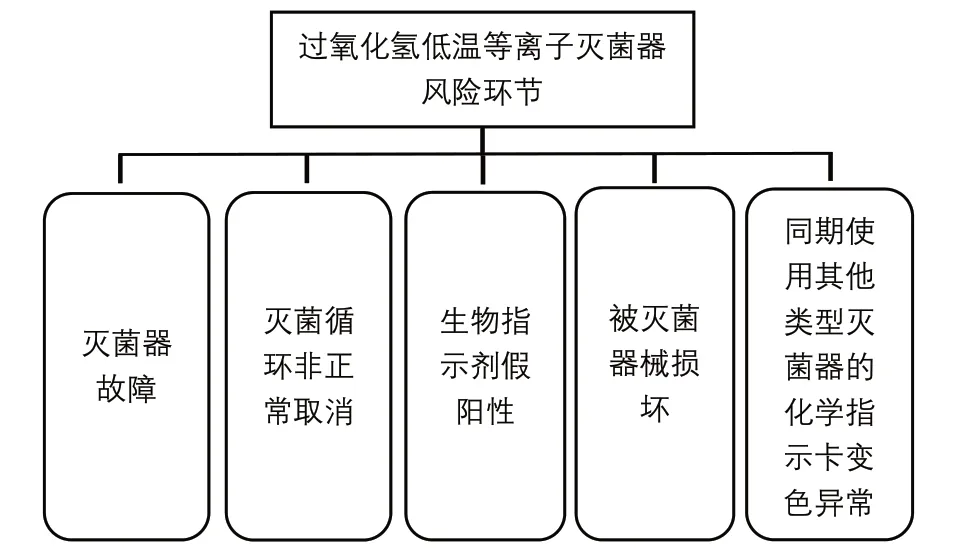
图1 过氧化氢低温等离子灭菌器安全使用的风险流程图
2.2 风险分析与评估。研究团队依据标准规范和临床实践经验,确定潜在失效模式。每个失效模式需从严重程度、发生概率和可探测度三个维度进行定量分析,即效应分析。严重程度S (Severity,S)指该失效模式发生时所带来的危害;发生概率O (Occurrence,O)指该失效模式发生的可能性;可探测度D(Detection,D)指该失效发生时采取现行控制措施能够被侦测出来的概率[3-6]。具体分级评分标准见表1-3。根据FMEA 评分标准,计算出各失效模式的风险优先指数(Risk Priority Number,RPN),RPN 值为三个维度评分的乘积,即RPN=S×O×D。RPN 值与其代表意义成正比,RPN 值越高代表越危险,表示该失效模式急需进行改善。
2.3 风险控制与效果评价。针对每个失效模式,分析潜在失效原因,并制定改进措施进行整改,拟定改进周期,控制和消除风险。改进周期结束后,对控制后的风险点再次进行评分计算RPN 值,即进行效果评价,RPN 值显著降低说明整改有效。
结果
1.风险评估。过氧化氢低温等离子灭菌器安全使用风险包括灭菌器故障、灭菌循环非正常取消、生物指示剂假阳性、被灭菌器械损坏和同期使用其他类型灭菌器的化学指示卡变色异常五大方面风险点[7-11]。见表4。

表1 事件严重程度分级评分标准

表2 事件发生概率分级评分标准

表3 事件可探测度分级评分标准
2.控制措施。针对失效模式,FMEA 小组成员与涉及的相关部门充分讨论,分析其失效原因,制定了相应的整改措施和整改周期。
2.1 强化准入管理。过氧化氢低温等离子灭菌器安全使用的准入环节,涉及灭菌器和相关配套使用耗材,重点关注资质查验、到货验收、运输存储条件核查等。灭菌器和耗材属于医疗器械,需遵循《医疗器械监督管理条例》(国务院令680 号)、《医疗器械使用质量监督管理办法》(国家食品药品监督管理总局令第18 号)等相关规定。资质查验包括:医疗器械注册证、医疗器械经营许可证或医疗器械经营备案凭证、营业执照、厂家授权等常规资质。消毒产品需另提供安全评价报告。消毒器械生产企业应当取得所在地省级卫生行政部门发放的卫生许可证后,方可从事消毒产品的生产。到货验收时要重点检查产品合格证、耗材有效期和运输条件证明文件等。
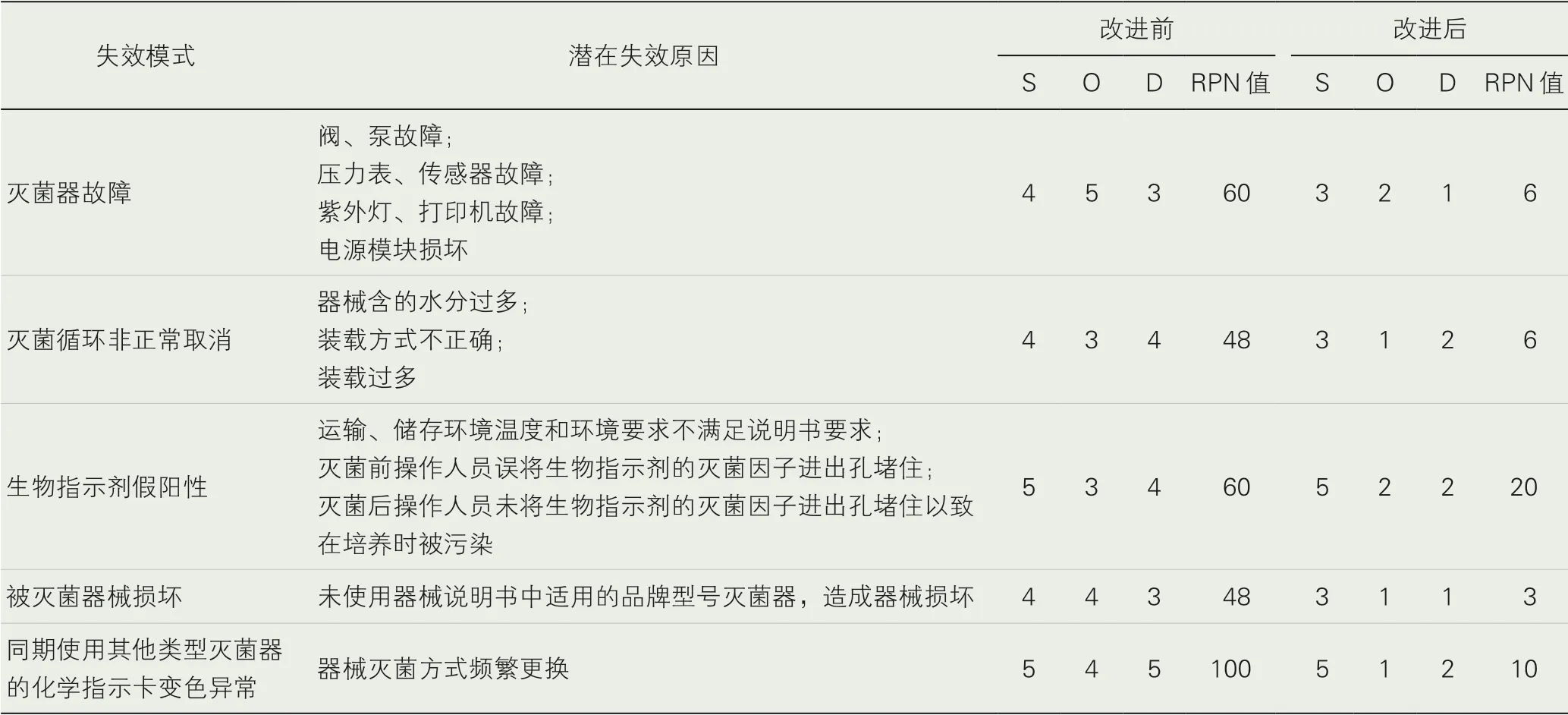
表4 潜在失效模式分析
2.2 强化制度建设。医院应在遵守法律法规的基础上,完善管理体系,健全工作制度;合理配置专业人员,定期进行使用操作培训,应当按照诊疗规范及操作指南、医疗器械使用说明书等,遵守医疗器械适用范围、禁忌证及注意事项,注意主要风险和关键性能指标;建立统一的应急调配机制;应建立过氧化氢低温等离子灭菌临床使用质量与风险管理制度,开展临床使用质量控制与持续改进。
2.3 强化人员培训。为应对人员流动和技术更新的现实状况,临床操作人员和工程技术人员需定期开展培训,考核合格后方可上岗。临床操作人员的培训应注重操作流程、三大监测注意事项、应急处理流程和常见问题等。工程技术人员的培训应注重新技术的介绍、常规巡检质控流程和常见故障排除等。
2.4 强化临床标准操作。临床使用应执行标准操作,比如规范装载:不碰壁、不叠放;器械充分干燥后再放入灭菌器;硬式内镜不可随意更换灭菌方式等。在灭菌适用范围要考虑两个维度,(1)国家标准《过氧化氢低温等离子体灭菌器》(GB/T32309-2015)中明确了不能灭菌的物品,不能灭菌的物品应特别关注①内径小于1mm,长度大于500mm 的不锈钢管状器械;②不完全干燥的物品;③一端封闭的内腔;④不能承受压力的器械;⑤器械具有复杂的内部部件,难以清洁,例如密封轴承。(2)要遵循灭菌器和需灭菌设备器械厂家说明书中推荐的消毒方式、品牌、型号和循环模式,同时说明书中会明确在灭菌过程中是否需要安装消毒配件。
2.5 强化巡检保养管理。积极遵循《国务院办公厅关于加强三级公立医院绩效考核工作的意见》(国办发〔2019〕4 号)和《医疗器械临床使用管理办法(征求意见稿)》的要求。过氧化氢低温等离子体灭菌器维修保养及质量控制管理方面应做到:(1)配置合理维修人员和维修场地,涉及有毒有害作业应有合适的维修场所和有效防护;(2)开展日常保养和维护,有巡检、保养、维修等相关记录及设备管理部门对临床使用部门的监管、培训记录;(3)配置必备的检测和质量控制设备,医学设备管理部门应当按照产品说明书的要求定期对设备进行预防性维护,确保在用设备完好,有记录和标识,并对发现的问题及时处理。
巡检和保养要实行三级管理。第一级,临床操作人员灭菌前观察设备状态,保持设备清洁,需要时更换收集盒和打印纸;第二级,临床工程师每月要巡检工作电压和漏气率等参数;第三级,厂家工程师每半年或1500 个循环开展一次小保养,每一年或3000 个循环开展一次大保养。保养涉及清洁设备、更换备件和测试三部分。大小保养清洁设备和测试的内容是一样的,清洁设备:清洁门及灭菌仓内部组件、清洁控制面板组件、检查并清洁热敏打印头;测试包括:全套的电器测试和空锅测试。小保养需更换真空泵润滑油、回油过滤器、传输阀腔体搁架固定扣、空气滤芯。大保养需更换真空泵润滑油、回油过滤器、传输阀、腔体搁架固定扣、空气滤芯、催化式排气净化过滤器、通风阀高效空气过滤器、密封圈、紫外线灯光学窗、紫外线灯头、H2O2探测组件的探测光学窗、温度热偶感应器、传递阀、注射针。
2.6 强化灭菌器更新管理。过氧化氢低温等离子灭菌器厂家推荐的使用年限一般为10 年。超期服役、故障率过高和维修费用超过原值的50%都应该考虑更换新机。灭菌器更新时,应重点考虑新技术机型,新技术包括:快速生物检测技术、自动烘干减少器械水分功能、灭菌器信息联网和统计功能等。
3.效果评价。使用Excel 对数据进行录入,采用SAS9.4 软件进行统计分析。分类变量采用χ2检验进行分析,以α=0.05为检验水平,认为p<0.05 时差异有统计学意义。
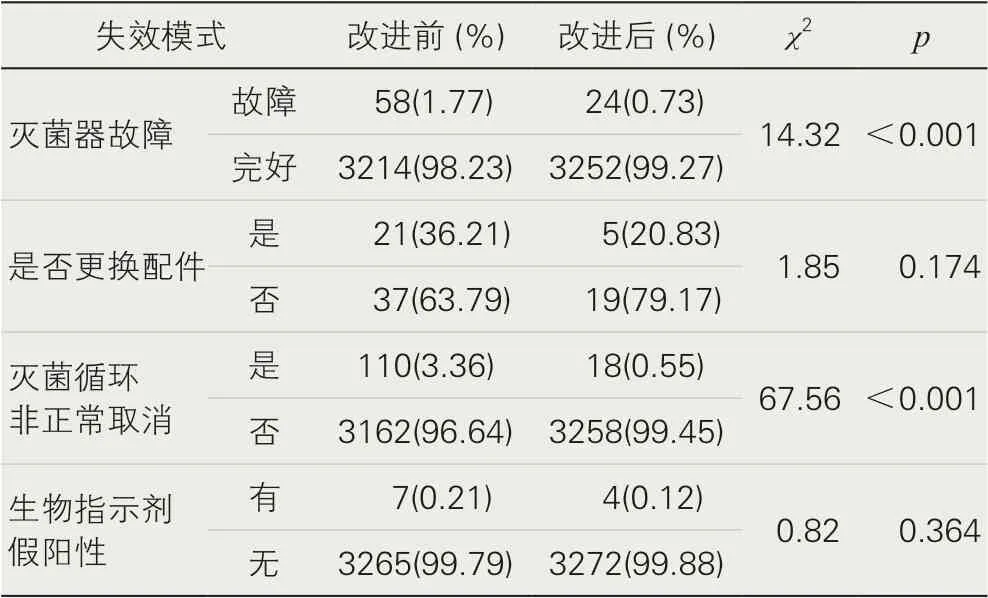
表5 改进前后过氧化氢低温等离子灭菌器使用情况
表5 结果显示,改进后灭菌器故障率(0.73)、灭菌循环非正常取消比例(0.55)与改进前相比差异有统计学意义(p<0.05),整改后失效事件明显少于改进前。改进后更换配件比例(20.83%)、生物指示剂假阳性事件比例(0.12%)与改进前相比差异虽无统计学意义(p>0.05),但较整改前有所下降。同期使用其他类型灭菌器的化学指示卡变色异常问题,采用单一灭菌方式后,变色异常问题没有再出现。措施的实施有助于减少过氧化氢低温等离子灭菌器失效事件的发生。
结论
本研究运用FMEA 方法分析过氧化氢低温等离子灭菌器安全使用中的失效环节,使得RPN 值较高的潜在隐患得到量化从而确定重点改进项目,增强对设备安全使用的认知,降低不良事件的发生率,有效消除潜在失效因子,提高医疗安全性,值得应用于其他医疗设备的风险管理中。

