白蛋白结合型紫杉醇和多西他赛在食管癌同步化放疗中的应用比较
葛 琴 钱 霞 顾红芳 赵奎领 张紫寒 杨百霞 谢国栋
江苏省南通市肿瘤医院放疗科 226361
食管癌是常见的消化道恶性肿瘤之一,根据2018年全球肿瘤流行病统计(GLOBOCAN)的数据,中国食管癌发病率和死亡率分别居于全国第5位和第4位,每年新发病例30.7万例,死亡28.3万例[1]。大多数食管癌患者就诊时已是进展期甚至晚期,不适合手术或合并基础疾病不能耐受手术,因此同步化放疗在食管癌治疗中占重要地位。根据NCCN指南和中国食管癌诊疗指南共识,同步化疗方案以“氟尿嘧啶+顺铂”和“紫杉类+铂类”等方案为首选。紫杉醇(Paclitaxel,PTX)是近年国际市场上最热门的抗癌药物,但PTX水溶性极差、不良反应发生率高[2],在临床应用中受到诸多限制,针对上述缺点,科学家们研制了Docetaxel和nab-PTX等新剂型紫杉类抗肿瘤药物。nab-PTX作为化疗药物中的超级战斗机[3],目前已在多个国家被批准用于治疗转移性乳腺癌的二线治疗、非小细胞肺癌和晚期胰腺癌一线治疗,但用于治疗食管癌的研究报道鲜见。本研究回顾性分析了 nab-PTX和Docetaxel分别联合奈达铂同步放疗食管癌的近期临床疗效和安全性,旨在寻找更加高效且低毒的抗肿瘤治疗方案。
1 资料与方法
1.1 一般资料 收集2019 年1—12月我院放疗科胸组初治的58例确诊食管鳞癌患者的临床资料,进行回顾性分析。根据其治疗方法的不同进行分组,其中应用Docetaxel联合奈达铂治疗23例为Docetaxel组,应用nab-PTX 联合奈达铂治疗35例为 nab-PTX组。2组患者的性别、年龄、NLR和PNI[入院时采空腹血,使用流式细胞仪检测患者中性粒细胞数值、淋巴细胞数值以及血清白蛋白水平,计算NLR即中性粒细胞值与淋巴细胞值比率;PNI=淋巴细胞计数总值(×109/L)×5+血清白蛋白(g/L)]、肿瘤位置、临床分期等基线资料比较差异无统计学意义(P>0.05)。见表1。
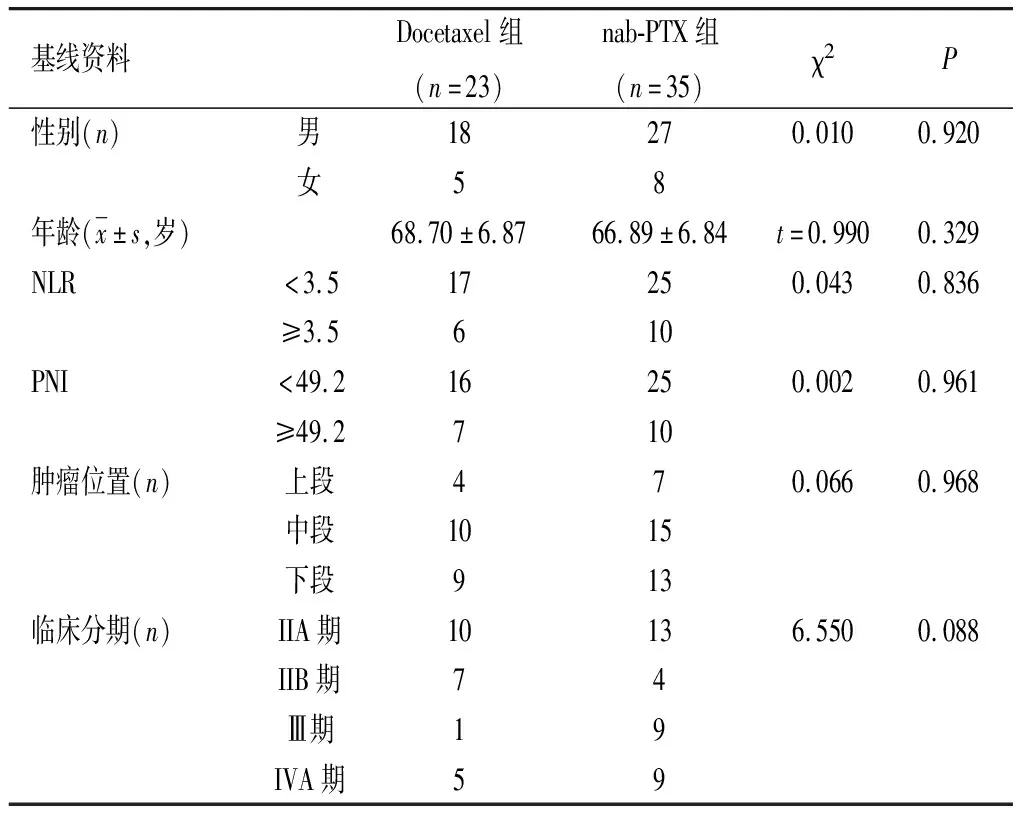
表1 58例食管癌患者入组时基线资料比较
1.2 方法 放疗:患者取仰卧位,头颈肩用热塑膜固定,平静呼吸;CT模拟机定位,扫描层厚为5mm,范围为颅底至双肾下缘。图像经局域网传输到Pinnacle3.9计划系统进行三维重建,结合纤维胃镜、食管钡餐或碘油造影以及CT图像勾画靶区及危险器官。肿瘤靶区:食管可见病灶及阳性淋巴结(淋巴结转移勾画标准:短径>10mm,特殊部位如气管、食管沟和食管旁淋巴结短径>5mm)。临床靶区:肿瘤靶区上下外扩3cm。计划靶区:临床靶区前后、左右、上下均匀外扩1cm。靶区及计划由至少2名副主任职称以上医师确定后执行。放疗剂量DT 60Gy,200cGy/次,5次/周。Docetaxel 组:患者给药前1d开始服用地塞米松片,4.5mg bid,持续3d,以预防过敏反应和体液潴留;静脉滴注Docetaxel(江苏恒瑞医药股份有限公司,国药准字:H20163032;规格:每支20mg)75mg/m2,d1;给药前30min,患者静脉注射地塞米松5mg,雷尼替丁200mg;使用Docetaxel 过程中全程心电监护监测生命体征。nab-PTX 组:患者取 nab-PTX(石药集团欧意药业有限公司,国药准字:H20183044;规格:每支100mg)260mg/m2,使用专用输液器30min 内静脉滴注完毕,d1。所有患者均联合奈达铂(齐鲁制药有限公司,国药准字:H20050563;规格:每支10mg)100mg/m2静脉滴注,滴注时间≥1h,d1。治疗以3~4周为1个周期,每例患者化疗 2~3个周期,最多不超过4个周期。
1.3 观察指标
1.3.1 肿瘤缓解评估:依据实体瘤疗效评价标准RECIST 1.0版:完全缓解(CR)为靶病灶完全消失、淋巴结短直径≤10mm,至少维持4周;部分缓解(PR)为基线靶病灶缩小≥30%,至少维持4周;疾病稳定(SD)为介于PR和疾病进展(PD)之间; PD即基线靶病灶增大≥20%,或出现新病灶。ORR=(CR+PR)/总病例数×100%;DCR=(CR+PR+SD)/总病例数×100%。
1.3.2 不良反应:根据通用不良事件术语标准4.0版(Common Terminology Criteria Adverse Events 4.0, CTCAE V4.0),描述治疗后不良反应的情况。中性粒细胞减少:1级:(2~1.5)×109/L;2级:(1.5~1.0)×109/L;3级:(1.0~0.5)×109/L;4级:<0.5×109/L。血小板减少:1级:(100~75)×109/L;2级:(75~50)×109/L;3级:(50~25)×109/L;4级:<25×109/L。腹泻:1级:无症状,仅有临床或诊断性观察结果,无须治疗;2级:腹痛,黏液便或血便;3级:重度或持续性腹痛,发热,肠梗阻,腹膜刺激征;4级:危及生命,需紧急干预治疗;5级:死亡。周围神经炎:1级:无症状;2级:中度疼痛,日常生活活动受限;3级:重度症状,个人生活不能自理;4级:危及生命,需要急诊治疗;5级:死亡。
1.3.3 血清学指标和免疫细胞功能检测:治疗前和治疗结束时分别抽取两组患者空腹静脉血15ml、5ml,3 000r/min离心10min,置于-20℃冰箱中保存。采用酶联免疫法(德国罗氏 Modular PPE)检测患者治疗前、后的血清 VEGF 和T淋巴细胞亚群水平,所有操作步骤均严格按照试剂盒说明书进行。
2 结果
2.1 2组患者近期疗效比较 肿瘤缓解评估:nab-PTX 组患者的 ORR、DCR高于Docetaxel 组(P<0.05)。见表2。
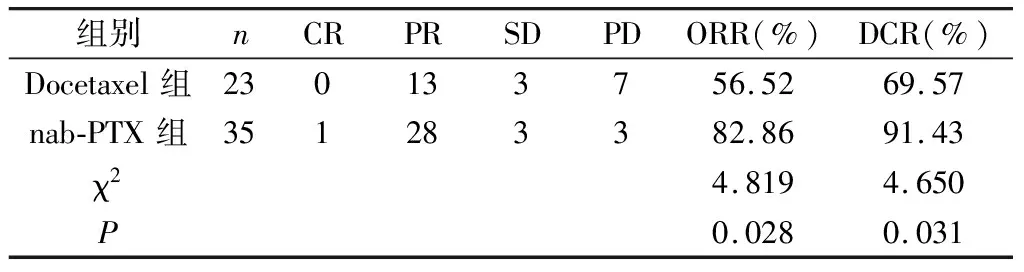
表2 2组患者近期疗效比较(n)
2.2 2组患者不良反应情况比较 nab-PTX组患者中性粒细胞减少、血小板减少、腹泻、周围神经炎等不良反应发生率低于Docetaxel组(P<0.05)。见表3。
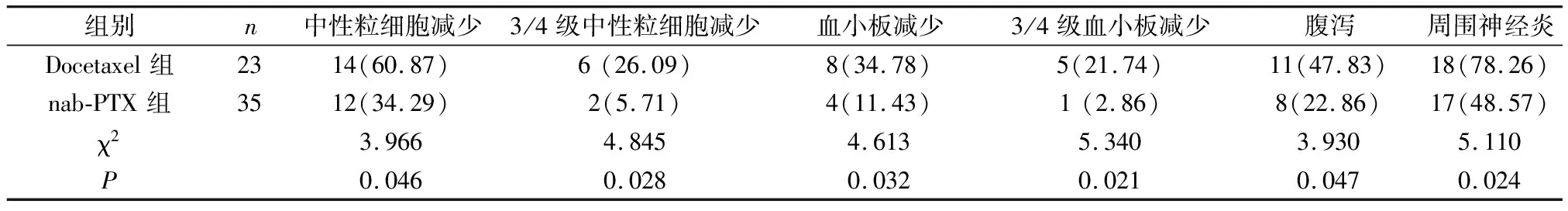
表3 2组患者不良反应比较[n(%)]
2.3 2组患者血管内皮生长因子及免疫指标变化比较 2组患者治疗前各指标比较,差异无统计学意义(P>0.05)。治疗完成后,nab-PTX组CD3+和CD4+较治疗前均显著升高,VEGF、CD8+较治疗前显著下降,显著优于Docetaxel组,差异均有统计学意义(均P<0.05)。见表4。
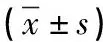
表4 2组患者血清血管内皮生长因子及免疫细胞功能检测比较
3 讨论
近年来随着肿瘤多学科综合治疗协作组(Multidisciplinary team,MDT)诊疗模式的运行和日渐规范化,恶性肿瘤的治疗和预后有了长足的进步。越来越多的研究也提出食管癌和其他肿瘤治疗一样需通过MDT,在手术、放疗、内镜下黏膜剥脱或摘除术以及光动力治疗等基础上,结合化疗、免疫、靶向和生物治疗等手段,从而摸索出更为合理有效的治疗方式。食管癌患者确诊时多为中晚期,失去手术最佳治疗时机,同步化放疗是进展期食管癌的重要治疗方式。恶性肿瘤化疗方案种类繁多,如何制定高效低毒的化疗方案,一直是我国临床工作者关注的热点。
Docetaxel作用与PTX相同,为M期周期特异性药物,可促进小管聚合成稳定的微管并抑制其聚解,从而使小管的数量显著减少,并可破坏微管网状结构。体外实验表明,对多种小鼠及人体肿瘤细胞株有细胞毒作用,抗瘤谱较PTX广。Docetaxel也不需要蓖麻油来助溶,但不幸的是,其需要聚山梨酯80及无水乙醇助溶,二者都会增加不良反应,患者在治疗之前,需要预服糖皮质激素来预防体液潴留和过敏反应。
nab-PTX是一种抗微管药物,可诱导和促进微管装配、具有聚合和稳定作用,可干扰微管束的正常动力学再排列,从而阻滞关键的细胞间期和有丝分裂过程。nab-PTX采用纳米技术,借助天然nab-PTX的药物递送和生物利用度,同时避免了有机溶剂引起的超敏/毒性反应,不需要激素预处理[4],国外多项研究报道了nab-PTX在数种恶性肿瘤治疗中的优势[5-6]。nab-PTX除了能够避免蓖麻油引起的过敏反应,还大大减少了对中性粒细胞的毒性,治疗后严重中性粒细胞减少事件只有PTX的一半。
紫杉醇类药物的临床不良反应累及不同系统和器官,主要表现为血液学毒性、外周神经性麻木、脱发以及胃肠道反应[7]。本研究中,nab-PTX组患者血液学毒性以中性粒细胞减少、血小板减少常见,贫血发生率低,且不良反应多以1/2级为主,3/4级较少;nab-PTX组胃肠道反应、周围神经炎等不良反应发生率低于Docetaxel组(P<0.05),且患者经治疗后均可纠正。nab-PTX 组患者整体耐受性良好,表明 nab-PTX 同步治疗食管癌的安全性较高。
恶性肿瘤特别是中晚期伴转移的肿瘤,患者大多合并免疫功能的抑制,免疫功能检测指标表现为CD3+、CD4+下降以及CD8淋巴细胞增多。本研究中,两组患者治疗前血清学指标及免疫功能检测比较,差异无统计学意义(P>0.05)。另VEGF是影响血管生成的重要因子之一,可参与肿瘤血管管的生成,既往对食管癌的分子病理研究发现,30%~60% 的食管癌可检测到 VEGF 过表达。研究者[8]认为VEGF 能够促进内皮细胞的迁移与增殖,并能够诱导肿瘤血管的新生,为肿瘤细胞的增殖提供所需的营养物质,促进肿瘤基质形成、肿瘤持续生长及肿瘤细胞进入新生的血管,最终使肿瘤发生转移。本研究,治疗结束时,nab-PTX组CD3+、CD4+水平较治疗前均显著升高,VEGF和CD8+水平较治疗前显著下降,显著优于Docetaxel组,差异均有统计学意义。可见nab-PTX组比Docetaxel组更能改善患者预后,且nab-PTX组免疫功能改善明显,较Docetaxel组更能提高生活质量。
综上所述,nab-PTX 联合奈达铂同步放疗食管癌,患者耐受性好,给药前不需激素预处理,安全性好,同时患者免疫功能改善明显,临床应用价值显著;但因研究病例数较少,观察时间较短,究其远期疗效及晚期不良反应,仍需进一步扩大样本量进行探索。

