C-myc基因重排的套细胞淋巴瘤临床病理分析
邹宗楷,沈洪武,何惠端,杨伟平,纪思灵
(福建医科大学附属漳州市医院病理科,漳州 363000)
套细胞淋巴瘤(mantle cell lymphoma MCL)约占非霍奇金淋巴瘤(NHL)5%~6%,以老年男性为主,发现时多为III/IV期病变。近年来,化疗联合利妥昔单抗等治疗使患者的预后显著提高,但部分患者复发并最终死亡。MCL病因及发病机制仍不清楚,带有基因表达和深度测序的分子谱分析发现其存在细胞周期、DNA损伤反应、增殖和凋亡途径的基因组和表观遗传学异常[1]。C-myc是一种原癌基因,定位于8q24区,编码核蛋白转录因子C-myc。Cmyc主要通过易位、重组扩增方式活化,在细胞增殖及凋亡方面有重要的生物学功能[2]。目前,在C-myc相关淋巴瘤的研究主要集中在伯基特淋巴瘤和弥漫性大B细胞淋巴瘤(DLBCL)。据报道[3,4],C-myc在发病率较低的MCL中重排发生率1.46%~7.97%,在母细胞样/多形性变异型中高达16.50%~18.18%。C-myc在MCL中临床意义的研究较少,本研究通过免疫组织化学及FISH方法分析C-myc基因易位与MCL组织学分型、乳酸脱氢酶(LDH)水平、Ki-67指数、KPS评分、Ann Arbor分期等临床病理因素的相关性,阐述C-myc表达情况及其重要临床意义,以此提高病理及临床对MCL的诊治新认识。
材料和方法
1 材料来源
收集福建医科大学附属漳州市医院2010年12月至2015年12月间明确诊断的40例MCL病理蜡块。其中男性28例、女性12例,年龄34~84岁,中位数年龄66岁。标本部位:浅表淋巴结28例,胃肠道8例,胆囊、脾各1例,鼻咽、扁桃体各1例。其中经典型28例、母细胞型11例、多形性型1例。以40例反应性淋巴结炎组织作为阴性对照。标本均经10%中性福尔马林固定,常规石蜡包埋。收集完整临床病理资料(如年龄、性别、分期、类型、预后等)。病理评估由两位病理医师依据2016版WHO造血和淋巴组织肿瘤分类标准明确诊断。该项目同时被漳州市医院伦理审查委员会批准。
2 主要试剂与仪器
BenchMarkXT全自动免疫组织化学染色仪(罗氏公司,美国),Olympus BX51型荧光显微镜(日本),Leica原位杂交仪(ThermoBrite,德国);C-myc基因双色断裂分离重组探针(橙色探针277kb chr8:128432540-128709819,绿色探针407kb chr8:130338931-130745615)由北京金菩嘉技术有限公司提供;兔抗人C-myc单克隆抗体(RMA-0664即用型)、抗Ki-67抗体购自福州迈新生物技术有限公司。胃蛋白酶为Sigma产品。
3 C-myc、Ki-67免疫组织化学染色及结果判定
严格按照试剂盒和仪器说明书进行免疫组织化学检测,用PBS替代一抗作为空白对照,以人伯基特淋巴瘤组织在每张切片中设阳性对照;染色后苏木素复染。免疫组织化学结果判定:C-myc主要表达于细胞核,阳性呈棕褐色、棕黄色或浅黄色。参考Vander免疫组织化学判读标准,随机选择10个高倍视野中阳性细胞在同类型细胞中的百分比的平均值作为整张切片的判读结果,C-myc以肿瘤细胞数≥20%为阳性。Ki-67阳性定位于细胞核,阳性呈黄褐色,随机选择10个高倍视野,计算每个视野内肿瘤组织中阳性细胞的百分率(%),以平均值作为Ki-67增殖指数。
4 C-myc基因易位FISH检测及结果判读
采用3 μm石蜡组织切片进行直接法FISH检测。严格按照试剂盒和仪器说明书进行技术操作,包括石蜡样本玻片预处理、杂交仪自动变性杂交、玻片洗涤、DAPI复染、结果观察等。Alexa Flour555标记的橙色探针识别C-myc基因着丝粒(119kb),异硫氰酸荧光素(FITC)标记的绿色探针识别C-myc基因端粒(1.5Mb)并结合断裂点的端粒,三色滤光镜下观察间期细胞荧光杂交信号,FISH图像分析软件进行图像采集、分析和保存。结果判定:按照说明书要求,首先建立本实验室阈值。FISH信号根据2名实验员分别计数200个细胞信号检出,阳性Cutoff值(正常对照的平均值+3个标准差)来自40例反应性增生的淋巴结标本。确定本实验室C-myc探针易位阳性阈值为12%,扩增阳性阈值为15%。正常细胞C-myc基因显示为2个由红色和绿色荧光融合的黄色信号,C-myc基因易位重排细胞显示1红1绿1黄信号,≥3个黄色信号判断为C-myc基因扩增,且2个分离信号间的距离≥3倍信号直径。每张切片上加一反应性淋巴结组织作为阴性对照。
5 统计学分析
采用SPSS18.0软件进行统计学分析。组间差异比较采用卡方检验或Fisher精确检验,C-myc和Ki67相关性采用Spearman检验。P<0.05为差异有统计学意义。
结 果
1 套细胞淋巴瘤组织病理学特征
病理切片HE染色显示:与对照组比较,淋巴结性MCL淋巴结结构破坏,瘤细胞弥漫增生。MCL常见组织学类型有3种类型:①经典型淋巴结结构破坏,瘤细胞中等偏小,弥漫增生,形态相对单一,胞质少,核略不规则,少见核分裂(图1A);②母细胞样型瘤细胞类似淋巴母细胞,核形不规则、染色质细,核分裂多见(图1B);③多形型瘤细胞大小不一,可见较大型瘤细胞,核不规则、多个小核仁,核分裂易见(图1C)。
2 套细胞淋巴瘤中C-myc表达和Ki-67指数增高
MCL中C-myc在肿瘤组织中免疫反应阳性细胞的百分率≥20%有5例(12.5%),4例为母细胞型,1例为多形型,C-myc在肿瘤组织中免疫反应阳性细胞的百分率分别为1例25%、2例30%、1例40%、1例50%;对照组40例反应性淋巴结炎组织均无C-myc阳性表达,MCL中C-myc免疫反应阳性细胞数显著高于对照组(表1)。C-myc阳性细胞核主要呈棕褐色、棕黄色或浅黄色(图1D);而C-myc阴性细胞核呈淡蓝色(图1E)。12例母细胞型/多形性型Ki-67指数均≥60%(图1F),对照组Ki-67指数均<20%,呈黄褐色。全部MCL病例均cyclin D1阳性。
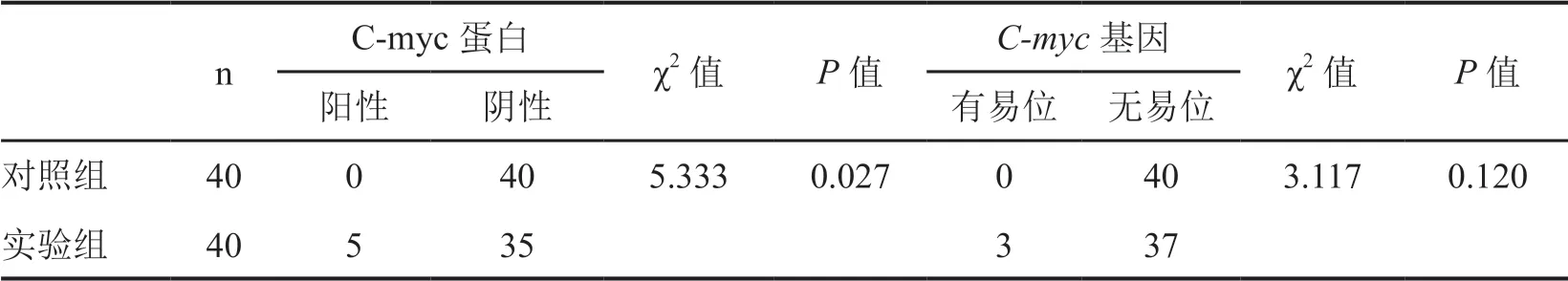
表1 C-myc蛋白和基因在套细胞淋巴瘤中的免疫组织化学表达Tab. 2 Expression of C-myc protein and gene in mantle cell lymphoma
3 套细胞淋巴瘤中C-myc基因重排易位
40例MCL中,检测出C-myc基因易位3例(7.5%)(图1G),均为母细胞型,信号值分别为12% 、13% 和14%,均有C-myc蛋白阳性表达。C-myc蛋白表达阴性组中无C-myc基因易位的病例(图1H),MCL中C-myc蛋白表达与C-myc基因易位显著高于对照组。3例C-myc基因易位的Ki-67指数分别为60%、70% 、80%,无基因易位的套细胞淋巴瘤Ki-67指数均<35%。

图1 套细胞淋巴瘤HE 染色与免疫组织化学、FISH检测。A,经典型套细胞淋巴瘤HE染色;B,母细胞样型套细胞淋巴瘤HE染色;C,多形型套细胞淋巴瘤HE染色;D,母细胞型套细胞淋巴瘤C-myc蛋白免疫组织化学染色阳性;阳性率30%;E,经典型套细胞淋巴瘤C-myc免疫组织化学染色阴性;F,母细胞型套细胞淋巴瘤Ki-67免疫组织化学染色,指数60%;G,经典型套细胞淋巴瘤C-myc FISH染色,示无C-myc基因易位病例细胞核内为2个由红色和绿色荧光融合的黄色信号(箭头);H,母细胞型套细胞淋巴瘤C-myc FISH染色,示有C-myc基因易位病例细胞核内可见1个红色信号、1个绿色信号和1个红绿混合的黄色信号(箭头);比例尺,50μmFig. 1 HE staining, immunohistochemistry staining and FISH examination of mantle cell lymphoma. A, classical type: the diffuse proliferation of tumor cells destroys the structure of normal lymph nodes. The tumor cell morphology is relatively single. Most cases are composed of small to medium sized lymphoid cells with less cytoplasm, slightly irregular nuclei and fewly mitosis; B, blast-like cells type: tumor cells are similar to lymphoblasts with irregular nuclear membrane, fine chromatin, and more mitosis; C, pleomorphic type: the tumors are composed of cells vary in size. Some larger tumor cells are present in this case with irregular nuclei, multiple small nucleoli and more mitosis; D, 30% expression of C-myc protein in blast-like cells type. Fully automatic IHC staining; E, negative expression of C-myc protein in classical type. Fully automatic IHC staining; F, 60% expression of Ki-67 index in blast-like cells type. Fully automatic IHC staining; G, A case of classical type without C-myc gene translocation shows two yellow signals formed by a mixture of the red and green fluorescence signals in the nucleus (arrow), FISH method; H, the cases of blast-like cells type with positively gene translocation of C-myc showed one red signal, one green signal and one yellow signal formed by a mixture of the red and green signals in the nucleus(red arrow), FISH method; scale bar, 50μm.
4 套细胞淋巴瘤患者C-myc基因易位与临床病例特征的关系
MCL中,C-myc基因易位与年龄、性别、临床分期无明显相关,而与组织学母细胞型/多形型分型、LDH水平升高、Ki-67指数≥60%、KPS评分低于90明显正相关(表2)。
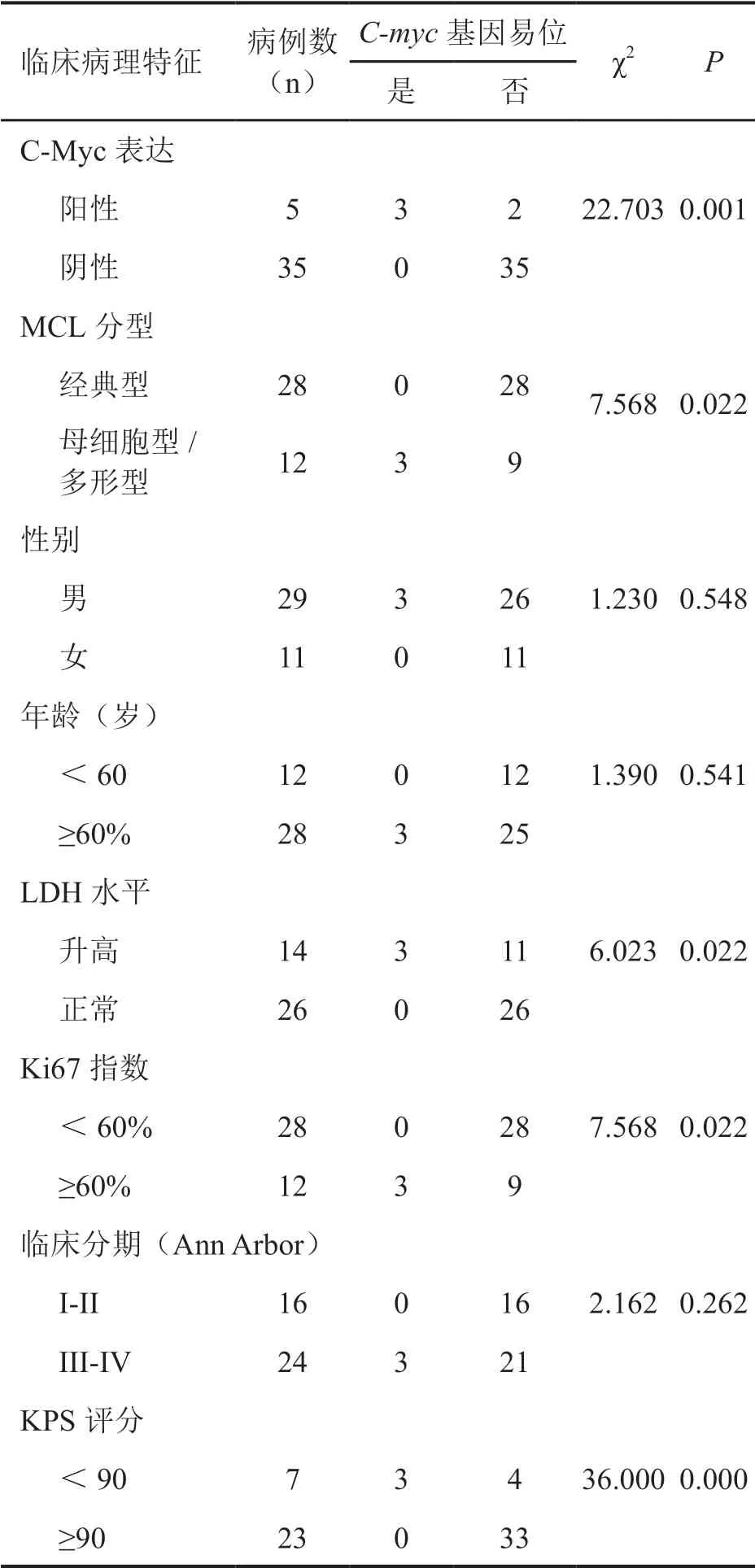
表2 套细胞淋巴瘤患者C-myc基因易位临床病理学意义Tab. 2 Clinical significance of C-myc gene translocation in patients with mantle cell lymphoma
5 3例C-myc基因重排易位的套细胞淋巴瘤临床特征
3例C-myc基因易位者在性别、年龄、体能状况、受累区域、LDH水平、Ann Arbor分期及治疗效果等临床病理因素均表现为高级别B细胞淋巴瘤的征象,对治疗反应差,仅部分缓解,预后不良(表3)。

表3 3例C-myc基因重排的MCL临床资料Tab.3 Clinical characteristic s of three cases of MCL with C-myc gene rearrangement
讨 论
导致细胞周期蛋白D1(cyclin D1)过表达的染色体异位t(11; 14)(q13; q32)始终存在于MCL中,但是继发性细胞遗传学改变,如基因重排、二次染色体畸变也非常普遍。MCL中C-myc存在不同程度的异常,包括基因易位和扩增,与预后不良有关[4]。与许多其他癌基因中发现的体细胞突变或融合蛋白相反,C-myc失调是通过失去对C-myc表达的严格控制而导致淋巴瘤形成。
本组病例,3例母细胞样型FISH检测到C-myc基因重排,占所有病例7.5%、占母细胞样/多形性MCL组25%,对比文献报道[34],数值偏高,且Cmyc基因易位与性别和年龄、临床分期无显著相关性、淋巴瘤组和对照组均无基因扩增,可能与病例数较少或地区、人群差异有关。3例C-myc基因易位者表现为高级别B细胞淋巴瘤的临床征象,且组织学分型、LDH水平、Ki-67指数、KPS评分与基因重排易位的相关性均有统计学意义,符合有关文献报道[3,4]。
B细胞淋巴瘤中C-myc失调是伯基特淋巴瘤的主要事件,其次是侵袭性淋巴瘤,如DLBCL,在低度恶性B细胞淋巴瘤中,C-myc重排通常会导致转化为高侵袭性淋巴瘤[5]。近年来,国内学者[6]通过免疫组织化学及RT-PCR研究C-myc在胃黏膜相关淋巴组织淋巴瘤患者预后评估中的意义,证实C-myc蛋白表达及基因异常与临床分期、IPI相关,可作为判断预后的指标。
Hao[7]等FISH分析5例MCL的复杂核型,提示涉及C-myc基因的8q24异常是罕见的继发性异常,与母细胞样/多形性变异型的形态学特征有关,也与淋巴瘤性白血病侵袭有关。Setoodeh[8]报告4例C-myc易位或扩增的MCL,具有侵略性并显示出高Ki67指数。陈伟伟[9]等FISH检测50例伴外周血及骨髓侵犯的MCL患者p53、C-myc/8q24等多种基因异常,显示18例伴有C-myc获得,提示Cmyc异常是独立预后不良因素。Choe[10]等收集65例MCL患者,C-myc蛋白表达阳性4例,占所有病例6.15%,占母细胞样/多形性型36.36%,2例发现基因重排,均为高C-myc表达的母细胞样变异型,占所有病例3.07%,占母细胞样/多形性型18.18%,Ki-67和p53表达明显更高,无进展生存期和总体生存期均显著缩短。Hu[4]在17例母细胞样/多形性型MCL发现具有C-myc重排的MCL符合晚期疾病、侵略性特征、Ki-67指数高、p53表达、复杂核型和预后不良的特点,据此提出“双重打击”淋巴瘤的思路。如前所述,本实验组3例基因重排的MCL均属母细胞型,也符合2016版WHO淋巴组织肿瘤分类[11]“双重打击”高级别B细胞淋巴瘤(HGBL)的总体概念。
Chisholm[3]等评估包含1214个淋巴瘤的组织微阵列,其中138例MCL的C-myc蛋白染色水平>25%者占2.1%,FISH基因检查时,11例出现基因异常占7.97%,提示以25%为C-myc蛋白阳性阈值,似乎偏高,不能敏感性反映基因异常。Choe[10]等通过ROC曲线确定20% C-myc蛋白水平为影响患者生存的有意义阈值。Horn[12]等建议C-myc蛋白表达以20%为界,有助于确定存在C-myc基因重排且低水平蛋白表达的淋巴瘤。本实验组C-myc蛋白以着色肿瘤细胞数≥20%为阳性阈值,显示出基因重排和免疫组织化学较高的一致性。
Lee[13]等报道C-myc基因在MCL中结构异常且蛋白过表达,是MCL对依鲁替尼的内在抗性基础,作为HSP90的受体蛋白,C-myc可通过PU-H71抑制,以克服原发性依鲁替尼耐药性。本实验组2例患者治疗方案为R+伊布替尼和R+DHAP,部分缓解,但生存时间较短,分别为28和35个月,目前对“双重打击”HGBL的治疗研究中显示使用R-EPOCH和RHyper-CVAD的方案可能对预后会有更好的效果[14,15]。
C-myc基因重排的MCL是一组独特类型疾病,多为母细胞样或多形性变异型,具有Ki-67指数高和C-myc蛋白过表达特点。C-myc重排可传达重要的预后信息,临床上应该将具有高级别形态特点且C-myc蛋白阳性率≥20%的MCL进行FISH检测,以明确有无C-myc基因重排易位,将其结果纳入病理报告中,有助于全面的病理诊断并协助临床进行有效化疗或精准靶向用药。

