miR-26a通过调控Wnt/β-catenin信号通路抑制食管癌发生发展
杨晨晨,徐茜,付娟娟
(1无锡太湖学院健康与护理学院基础医学教研室,无锡 214064;2新疆医科大学基础医学院免疫学教研室,乌鲁木齐 830011;3无锡市第五人民医院病理科,无锡 214000)
食管癌是我国高发的恶性肿瘤之一,其发病率和死亡率分别居第5位和第4位[1,2]。食管癌病程进展很快,较早发生邻近组织和远端组织的转移以及对周围组织的侵袭,淋巴结转移普遍存在,甚至在黏膜下层刚受到侵袭时就已经发生淋巴结转移,这也是食管鳞癌总体预后差的主要原因[3,4]。阐明食管癌发生发展及侵袭转移的分子调节机制、确定新的早期筛选分子靶点和研发新的治疗药物具有重要意义。miRNA是内源表达的小型非编码RNA通过引起细胞的降解而负向调节基因表达目标mRNA,抑制这些mRNA的翻译[5]。miRNA参与重要的细胞过程,例如应激反应,发育,分化,凋亡和扩散[6]。已报道许多恶性肿瘤中miRNA表达发生改变,如乳腺癌[7]、肺癌[8]、肝癌[9]、胃癌[10]、结肠癌[11]等。越来越多的研究表明miRNA可以充当癌基因或抑癌基因,并且它们通常在肿瘤中失调。在这方面,致癌的miRNA经常上调,而肿瘤抑制miRNA在肿瘤中下调。miR-26a在肿瘤方面已有很多研究,但其在肿瘤发生中的角色仍有争议,具体体现为miR-26a在肝癌[12]和乳腺癌[13]等肿瘤中表达水平下调,其与靶基因结合可抑制肿瘤生长。但是在非小细胞肺癌中[14],miR-26a呈现过表达趋势。miR-26a表达和生物学功能的不同可能与癌细胞遗传背景有关。我们的前期研究表明[15],人食管癌组织中miR-26a表达下调,从而发挥抑癌作用。为了进一步证实miR-26a对在体内对食管癌的作用,本研究通过建立人食管癌过表达和干扰荷瘤裸鼠模型,进一步探讨miR-26a对食管癌细胞体内生长的影响。
材料与方法
1 主要试剂和仪器
TRIzol提取试剂(Invitrogen公司),慢病毒包装(上海吉凯基因化学技术有限公司),miR-26a上下游引物由吉玛基因股份有限公司合成。原位杂交专用磷酸盐缓冲液(PBS)粉(武汉博士德生物工程有限公司),0.25%胰蛋白(Gibico BRL,美国),2×SCC(武汉博士德生物工程有限公司)磷酸缓冲盐溶液(PBS)(HyClone,美国),原位杂交试剂盒(武汉博士德生物工程有限公司)miR-26a探 针[miRCURY LNA Detection Probe,5’-DIG and 3’DIG(hsa-miR-26a-5p)](Exiqon公司,丹麦),反转录试剂盒(Thermo公司),实时荧光定量PCR检测试剂盒(Roch公司),RPMI-1640培养基(Gibico BRL),胎牛血清(Hyclone公司),MTDH一抗、细胞周期蛋白D1(cyclin D1)、c-myc和β-catenin一抗购自Abcam公司,倒置显微镜(日本Olympus公司),荧光定量PCR仪(Roch公司),柠檬酸、苏木素染色液、中性树脂凝胶购自碧云天生物技术有限公司,其他试剂如无水乙醇、95%乙醇等均为国产分析纯。
2 实验动物
5~8周龄的BALB/c-nu鼠,SPF级,雌性,体质量15~20 g,购自北京维通利华实验动物技术有限公司。医学实验动物质量合格证号:11400700086622。所有动物实验都经新疆医科大学临床医学研究院动物实验伦理委员会批准。
3 组织标本
收集2003—2010年间手术切除并经病理检查证实食管鳞癌组织和正常的癌旁组织45对,食管癌组织及癌旁正常组织切片标本均来自新疆医科大学第一附属医院胸外科。所有患者术前均未接受过任何系统的放化疗等治疗,并通过新疆医科大学第一附属医院伦理委员会伦理审查,所有研究标本均获得患者家属的知情同意。
4 细胞株与细胞培养
人食管癌细胞系Eca109(于1973年从人食管中段鳞癌组织通过小组织块原代培养建系而来的,细胞形态呈上皮细胞样,贴壁生长,用于过表达实验)、KYSE-450细胞系(细胞形态呈上皮细胞样,贴壁生长,用于干扰实验)。所有细胞培养于含10%(v/v)胎牛血清(FBS)和5 mg/mL青霉素-链霉素的RPMI1640培养液中。培养条件为37℃的5%CO2温箱孵育。
5 RT-PCR检测
各细胞株中miR-26a的表达采用液氮研磨和TRIzol试剂抽提肿瘤组织中的总RNA,采用TRIzol试剂抽提细胞中的总RNA,合成cDNA,并进行PCR扩增。各基因序列引物见表1。

表1 RT-PCR引物序列Tab.1 Sequences of primers for RT-PCR
6 慢病毒转染分组
本研究用干扰和过表达miR-26a慢病毒转染细胞。干扰miR-26a慢病毒转染实验的分组:miR-26a干扰(miR-26a-INFR)组,以携带miR-26a干扰序列的慢病毒感染KYSE-450细胞;空载体干扰(INFR-Vec)组,干扰空载体慢病毒感染KYSE-450细胞;干扰空白对照(INFR-Blk)组,正常培养的KYSE-450细胞。过表达miR-26a慢病毒转染实验的分组:miR-26a过表达(miR-26a-OE)组,携带miR-26a过表达基因的慢病毒感染Eca109细胞;空载体过表达(OE-Vec)组,过表达空载体慢病毒感染Eca109细胞;过表达空白对照(OE-Blk)组,正常培养的Eca109细胞。
7 Annexin V-PI法流式细胞术检测细胞凋亡
细胞处理后培养72 h,收集细胞,用预冷1×PBS(4℃)重悬细胞一次,1000 r/min离心5 min,洗涤细胞。然后加入100 μL的1×binding buffer 悬浮细胞。加入5 μL的Annexin V-FITC混匀后,避光,室温孵育15 min。上机前5 min再加入5 μL的PI染色,上机前补加200 μL的1×binding buffer,流式细胞仪(贝克曼库尔特,型号:DXflex,美国)检测细胞凋亡。
8 裸鼠荷瘤实验
实验前裸鼠需适应性饲养1周,分干扰实验组和过表达实验组。干扰miR-26a实验组包括miR-26a-INFR组(皮下注射感染携带miR-26a 干扰序列慢病毒的KYSE-450细胞)、INFR-Vec组(皮下注射感染干扰空载体慢病毒的KYSE-450细胞)、INFR-Blk组(皮下注射正常培养的KYSE-450细胞);过表达实验组包括miR-26a-OE组(皮下注射感染miR-26a过表达病毒的Eca109细胞)、OE-VecE组(皮下注射感染过表达载体病毒的Eca109细胞)、OE-Blk组(皮下注射正常培养的Eca109细胞)。用0.1%台盼蓝生理盐水进行活细胞计数。将对数生长期的各组细胞制成细胞密度为1×107个/mL的细胞悬液,在无菌条件下,每只裸鼠背部皮下接种细胞0.2 mL(细胞数为2×106个)。瘤块长出后,用游标卡尺测量裸鼠瘤块长径(A)及垂直横径(B),按公式V=A×B2/2计算裸鼠肿瘤体积,接种后28 d,麻醉后照相,用脱颈法处死裸鼠。切取肿瘤组织和肝、肺组织,10%中性甲醛固定,梯度乙醇溶液脱水,二甲苯透明,石蜡包埋,常规4 μm连续切片。
9 原位杂交实验
将组织芯片常规脱蜡,用自来水将水化后的载玻片清洗2遍,蒸馏水清洗3遍,每遍5 min。用3%H2O2室温处理10 min,蒸馏水洗涤2次。将组织切片上滴加3%柠檬酸新鲜稀释的胃蛋白酶(1 mL 3%柠檬酸+2滴浓缩型胃蛋白酶),37℃消化15 min。PBS(原位杂交专用)洗3次,每次5 min。每张切片加30 μL预杂交液。用杂交稀释液microRNA buffer稀释双地高辛标记的miR-26a探针,浓度为80 μmol/L,每张切片加30 μL,杂交过夜。2×SSC、0.5×SSC、0.2×SSC杂交液进行杂交后洗涤。滴加封闭液,37℃孵育20 min。甩去多余液体,不洗。先将载玻片上标本周围的封闭液擦净,每张载玻片加80 μL生物素化鼠抗地高辛,室温孵育120 min。用原位杂交专用PBS洗涤4次,每次5 min。滴加SABC,37℃孵育20 min。用原位杂交专用PBS洗涤3次,每次5 min。DAB显色,苏木素复染10 min,酒精脱水,二甲苯透明,用中性树胶封片,显微镜下观察结果。每张切片分别随机选取5个高倍镜视野进行观察。阳性细胞比例评分如下:0分(无阳性肿瘤细胞),1分(<10%阳性肿瘤细胞),2分(10~50%阳性瘤细胞)和3分(>50%阳性瘤细胞)。染色强度根据以下标准分级:0分(无染色),1分(弱染色=淡黄色),2分(中度染色=黄棕色)和3分(强染色=棕色)。染色指数(SI)计算为染色强度得分×阳性细胞比例。SI分数为0、1、2、4、6和9,其中4~9的SI评分用于定义miR-26a的高表达,0~2分用来表示miR-26a的未表达或低表达。
10 免疫组织化学染色
采用免疫组织化学(IHC)法检测各组裸鼠肿瘤组织中Wnt/β-catenin信号通路相关蛋白(c-myc、cyclin D1和β-catenin)表达水平。以4 μm厚度切片制作每只裸鼠瘤块的石蜡切片,采用免疫组织化学S-P法检测各组裸鼠瘤块组织中c-myc、cyclin D1和β-catenin表达,抗c-myc、cyclin D1和β-catenin一抗浓度分别为1:100、1:200、1:200。DAB显色后,中性树胶封片,光镜下每片随机选取不同的5个视野,采集图像,根据细胞染色强度评分为5级,无阳性着色(阴性)计0分,高倍镜下隐约可见淡黄色(可疑弱阳性)计1分,低倍镜下隐约可见高倍镜下明确可见淡黄色(弱阳性)计2分,低倍镜下可见棕黄色(阳性)计3分,低倍镜下可见棕褐色(强阳性)计4分;根据阳性细胞百分比评为4级,≤25%计1分,26%~50%计2分,51%~75%计3分,>75%计4分,将两项评分相乘得出最终评分结果。
11 统计学处理
采用SPSS 22.0统计学软件(IBM Corp., Armonk, NY)对实验数据进行统计学分析。所有值均表示为(平均值±标准差)表示,各组均数通过方差齐性检验,3组间比较采用单因素方差分析,方差齐时组内两两比较采用LSD法,方差不齐时采用Dunnett法,使用GraphPad 5.0(GraphPad Software,Inc.,La Jolla,CA,USA)软件进行绘图。以P<0.05为差异有统计学意义。
结 果
1 食管癌组织中miR-26a低表达
通过RT-PCR检测45对食管癌和正常组织中的表达,发现相对于食管癌旁组织,miR-26a在食管癌组织中的表达显著降低(图1)。

图1 miR-26a在食管癌组织中表达水平的RT-PCR检测与统计学分析。Cancer,癌组织;Paracancer, 癌旁组织;*P<0.05Fig. 1 RT-PCR detection and statistical analysis of expression of miR-26a in esophageal cancer. Cancer, cancerous tissue; Paracancer, paracancerous tissue; *P<0.05
2 miR-26a对ESCC细胞凋亡不产生影响
Annexin V-PI法流式细胞术检测显示:转染miR-26a干扰慢病毒和转染miR-26a过表达慢病毒72 h后,各组细胞凋亡率无明显差异(图2),即改变miR-26a表达水平对ESCC细胞凋亡无明显影响。
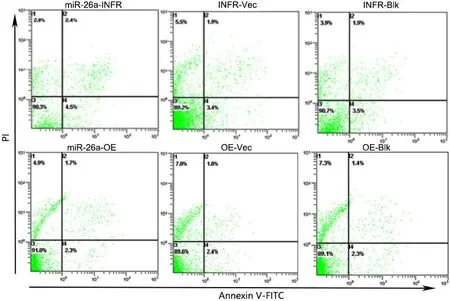
图2 改变miR-26a表达对ESCC细胞凋亡影响的流式细胞术分析Fig. 2 Flow cytometry assay for the effect of changing miR-26a expression on cell apoptosis of ESCC cells
3 miR-26a抑制裸鼠成瘤
生理盐水组未成瘤,过表达miR-26a细胞和干扰miR-26a细胞皮下注射裸鼠后,1.5~2周后均形成大小不等的皮下瘤(图3)。转染miR-26a干扰和过表达慢病毒后的细胞裸鼠皮下注射后,miR-26a-OE组的瘤体体积明显小于相应对照组(14 d:P=0.042;21 d:P=0.039)。miR-26a-INFR组的瘤体体积明显高于相应对照组(14 d:P=0.042;21 d:P=0.039)。经测量各组裸鼠体质量发现,在各个时间点miR-26a过表达慢病毒转染实验的裸鼠的平均体质量差异无统计学意义(P>0.05)。在miR-26a干扰慢病毒转染实验的各组裸鼠中,miR-26a-OE组裸鼠体质量较其他3组有下降趋势,但差异也无统计学意义(P>0.05)。
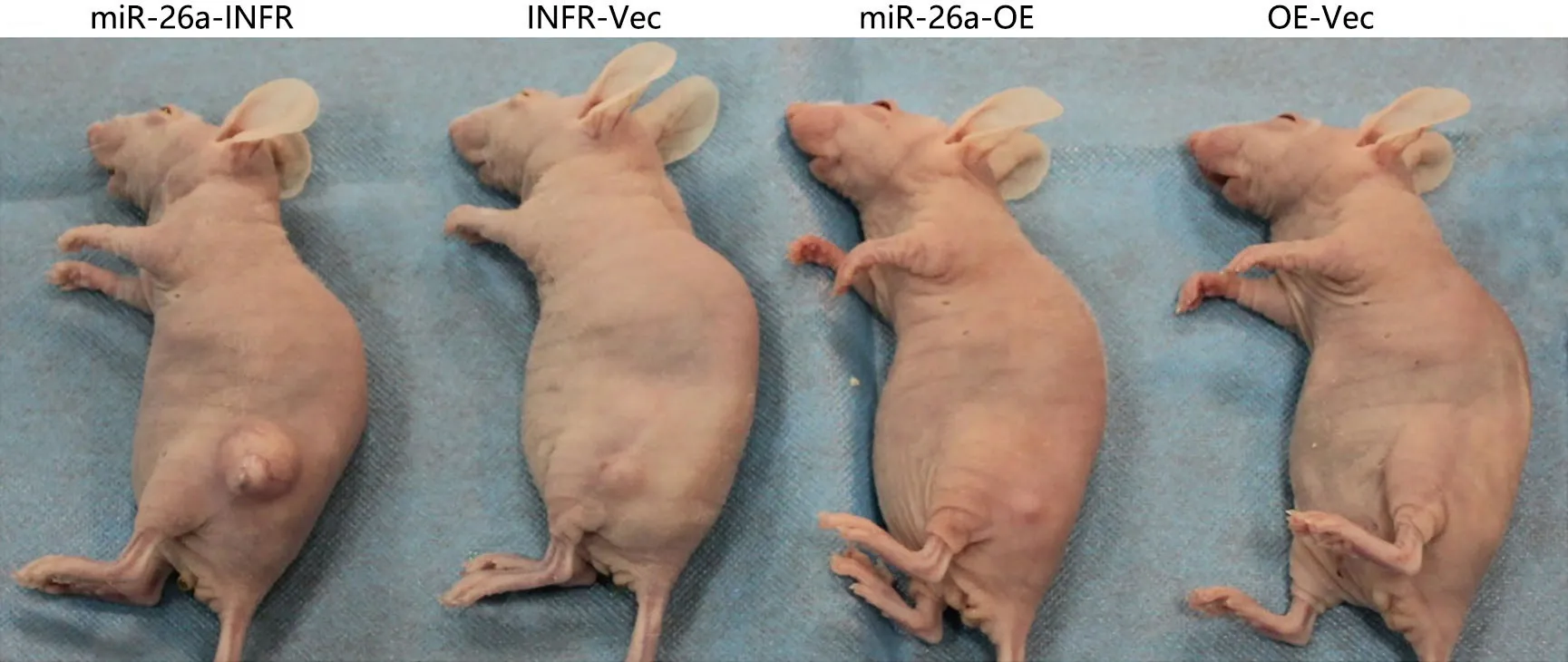
图3 改变miR-26a表达水平对裸鼠成瘤的影响Fig. 3 Effect of changing miR-26a expression on tumorigenesis in nude mice
原位杂交检测显示, miR-26a-INFR组的miR-26a表达水平较INFR-Vec组和INFR-Blk组明显降低,肿瘤组织胞质及胞核可见棕黄色颗粒沉着;miR-26a-OE组的miR-26a较OE-Vec组和OE-Blk组明显增高(图4,表2)。

图4 裸鼠瘤体miR-26a表达的原位杂交检测。比例尺,50 μmFig. 4 In situ hybridization examination of miR-26a expression in nude mouse tumor. Scale bar, 50 μm

表2 裸鼠瘤体miR-26a表达水平比较Tab. 2 Comparison of miR-26a expression levels in nude mouse tumor tissue
4 miR-26a下调Wnt/β-catenin信号通路相关蛋白c-myc、cyclin D1和β-catenin水平
免疫组织化学S-P法检测各组裸鼠瘤组织中cmyc、cyclin D1和β-catenin水 平 显 示,miR-26a-INFR组c-myc、cyclin D1和β-catenin水平显著高于INFR-Vec组和INFR-Blk组,miR-26a-OE组cmyc、cyclin D1和β-catenin水平显著低于OE-Vec组和OE-Blk组(图5,表3),由此提示miR-26a可下调Wnt/β-catenin信号通路相关蛋白c-myc、cyclin D1和β-catenin水平。

图5 miR-26a对裸鼠瘤组织中Wnt/β-catenin信号通路相关蛋白c-myc、cyclin D1和β-catenin水平影响的免疫组织化学检测。比例尺,50 μmFig. 5 Immunohistochemical examination for the effect of miR-26a on levels of Wnt/β-catenin signaling pathway-associated proteins, c-myc, cyclin D1 and β-catenin, in nude mouse tumor tissues. Scale bar, 50 μm
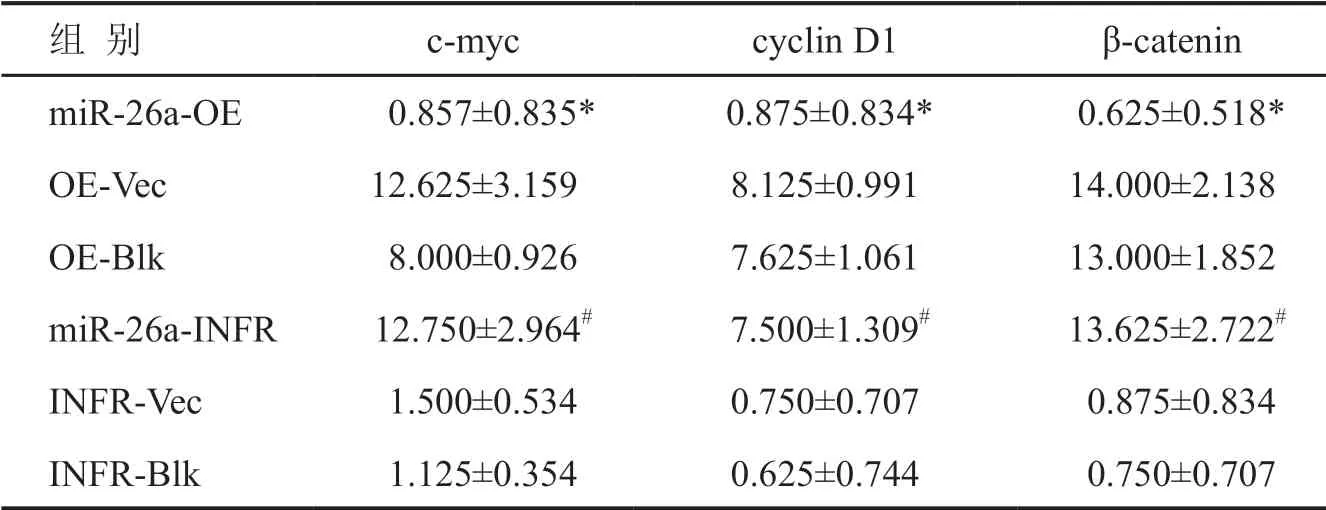
表3 裸鼠瘤组织中c-myc、cyclin D1和β-catenin水平比较Tab. 3 Comparison of levels of c-myc, cyclin D1and β-catenin in nude mouse tumor tissues
讨 论
miR-26a在肿瘤方面已有很多研究,但其在肿瘤发生中的角色仍有争议,例如:miR-26a在各前列腺癌组织中的表达明显升高,其在前列腺癌组织中的肿瘤促进作用[16]。Coronel-Hernández等[17]报道,在结肠癌中,miR-26a对PTEN的负调控直接影响AKT磷酸化水平。miR-26a直接下调PTEN,而mir-26a过度表达的细胞具有更高的增殖和迁移率。这些研究提示miR-26a能促进结肠癌的发展。Liu等[18]在非小细胞肺癌中的研究显示,miR-26a在淋巴结转移肿瘤组织中的表达水平高于原发性肿瘤组织。miR-26a的异位表达显著增强了肺癌细胞的迁移和侵袭能力,表明miR-26a可能是转移性肺癌患者的潜在治疗候选物。以上表明miR-26a在前列腺癌、结肠癌、非小细胞肺癌中呈现过表达的趋势。另有研究显示,miR-26a在肝癌[19]和乳腺癌[20]等肿瘤中表达水平下调,其与靶基因结合可抑制肿瘤生长。miR-26a的表达失调参与了多种肿瘤的发生发展和侵袭转移,miR-26a在不同的肿瘤和不同的组织学类型中发挥着不同的作用,凸显其功能的复杂程度。
为了进一步证实研究miR-26a对食管癌发生发展中的作用,本研究通过模拟食管癌在体内的生长情况,采用裸鼠荷瘤实验,用过表达或者干扰miR-26a的食管癌细胞,皮下注射裸鼠。28 d内,除生理盐水组外,其它各组裸鼠均成瘤。miR-26a过表达组裸鼠瘤体体积明显较过表达空载体对照组和过表达空白对照组小,miR-26a干扰组裸鼠瘤体体积明显较干扰空载体对照组和干扰空白对照组大,提示miR-26a在食管癌裸鼠体内有抑制食管癌生长的作用。原位杂交检测各组裸鼠瘤体中miR-26a的表达发现,miR-26a过表达组miR-26a表达量高于过表达空载体组和过表达空白对照组,miR-26a干扰组miR-26a表达量明显较干扰空载体对照组组和干扰空白对照组低,证明干扰或过表达的miR-26a裸鼠荷瘤实验模型制备成功。
Wnt/β-catenin信号通路作为一种在进化中高度保守的信号通路,在细胞增殖、分化及黏附等多种细胞生物学行为中发挥重要作用,并且在成熟细胞的多种生理进程中也起到至关重要的影响作用。Wnt/β-catenin信号通路的异常调节可导致多种疾病,Wnt/β-catenin信号转导通路在人类肿瘤的发生、发展中起重要作用,以该通路分子作为抗肿瘤治疗靶点已引起众多肿瘤和药物研究者的极大兴趣。Huang等[21]研究显示,miR-29a的过表达可以抑制Wnt/β-catenin途径的活性,同时,Wnt/β-catenin途径的激活剂LiCl可以逆转miR-29a过表达诱导的抗肿瘤作用。Nie等[22]研究发现,miR-125b在人三阴性乳腺癌(TNBC)组织和细胞系中高表达,抑制miR-125b表达可抑制细胞内Wnt/β-catenin途径和EMT的活性,从而抑制MDA-MB-468 TNBC细胞的增殖和迁移。
目前研究已发现食管癌中Wnt/β-catenin信号通路异常激活,且在食管癌发生和进展中发挥重要作用[23-25]。但miR-26a是否调节Wnt/β-catenin信号通路影响食管癌细胞生物学特性尚不清楚。我们前期的研究通过细胞功能学实验证明了miR-26a抑制食管癌增殖、侵袭、迁移移。荷瘤实验中发现干扰miR-26a后,cyclin D1、c-myc和β-catenin水平升高,过表达miR-26a使cyclin D1、c-myc和β-catenin水平下调,表明miR-26a能够抑制Wnt/β-catenin信号通路的激活。由此我们认为,miR-26a可能通过抑制Wnt/β-catenin信号通路阻碍人食管癌细胞增殖、侵袭和迁移能力,miR-26a对食管癌细胞生物学特性的影响可能与抑制Wnt/β-catenin信号通路的激活有关。

