miR-21-5p抑制缺氧诱导的肺动脉内皮细胞损伤
崔艳红,刘培培,孙潺
(南阳市中心医院呼吸内科二病区,南阳 473000)
肺动脉高压(pulmonary arterial hypertension,PAH)是一种极具破坏性且能危及生命的疾病,其特征是肺血管阻力和肺动脉压的持续增加,并导致右心功能障碍[1]。虽然已提出了许多假说,但目前PAH进展的具体调控机制仍不明确。近来研究表明,慢性缺氧是PAH患者血管重构的重要刺激因素[2,3],低氧诱导的肺动脉内皮细胞(pulmonary artery endothelial cell,PAEC)损伤在PAH的血管重构中发挥重大作用[4,5]。然而,影响PAEC损伤反应中涉及的具体分子机制仍不完全清楚。
微小RNA(microRNAs,miRNAs)是一类长度约为21~23个核苷酸的小的非编码单链RNA分子,其可通过与特定mRNA靶标的3’-非翻译区(untranslation region,UTR)相互作用而在转录后下调基因表达[6]。miRNAs在胚胎发育、细胞增殖、迁移、凋亡和免疫应答等多种生物过程中起调节作用[6,7]。生物信息学预测表明30%以上的基因受miRNA调控[7]。在慢性缺氧和野百合碱诱导的PAH大鼠模型中,已经明确指出众多miRNAs参与调控PAH的进展[8]。miR-21-5p作为miRNAs的一员,其已被证明是包括肿瘤细胞、内皮细胞和平滑肌细胞在内的许多细胞类型的缺氧敏感性标记物[9,10]。目前,miR-21-5p在缺氧导致的PAEC损伤中的主要功能尚不清楚。因此,本研究通过构建缺氧刺激诱导的HPAEC损伤模型研究miR-21-5p的功能,并阐述其中涉及的分子机制。
材料和方法
1 主要试剂与材料
DMEM培养基和胎牛血清(Gibco公司);L-谷氨酰胺、内皮细胞生长添加剂(endothelial cell growth supplement,ECGS)、肝素钠和脂质体Lipofectamine 2000(Invitrogen公司);miR-21-5p模拟物(miR-21-5p mimic)和miR-21-5p的阴性对照物(miR-NC)(上海万生昊天生物技术有限公司);Krüeppel样因子6(Krüeppel-like factor 6,KLF6)过表达载体质粒(pcDNA-KLF6)和对照载体质粒(pcDNA-Con)(上海生工生物工程股份有限公司);Hoechst 33342染液、Trizol试剂和乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒(北京索莱宝生物技术有限公司);FastKing一步法反转录-荧光定量试剂盒(天根生化科技(北京)有限公司);Annexin V-FITC/PI试剂盒(江苏凯基生物技术股份有限公司);Bradford法蛋白定量试剂盒、RIPA裂解液、兔抗GAPDH抗体、小鼠抗β-actin抗体和辣根过氧化物酶(horse radish peroxidase,HRP)偶联的山羊抗兔或驴抗小鼠IgG (H+L)二抗(武汉博士德生物工程有限公司);小鼠抗Cleaved caspase-3和小鼠抗KLF6抗体(Santa Cruz Biotechnology公司);原代人肺动脉内皮细胞(HPAEC)(上海中乔新舟生物科技有限公司)。
2 细胞培养
原代HPAEC培养在含有20%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素、2 mmol/L L-谷氨酰胺、100 μg/mL ECGS和20 μg/ml肝素钠的DMEM培养基中,置于5% CO2的潮湿的细胞培养箱中。待细胞传代至于第5~8代时用于后续实验。
3 细胞缺氧处理
取第5~8代HPAEC至于Forma 3130型缺氧细胞培养箱(美国Thermo Scientific公司)(培养条件为37 °C、5% CO2、90% N2和5% O2)中分别培养12、24和48 h。
4 细胞转染
取第5~8代HPAEC置于不含抗生素但含20%胎牛血清2 mmol/L L-谷氨酰胺、100 μg/ml ECGS和20 μg/mL肝素钠的DMEM培养基中,待细胞生长至约70%~80%汇合时,更换无血清培养基培养6 h,用Lipofectamine 2000试剂分别将miR-NC、miR-21-5pmimic、pcDNA-Con和pcDNA-KLF6转入HPAEC,孵育6 h后更换正常培养基继续培养48 h。
5 RT-qPCR
用Trizol试剂提取细胞总RNA,然后按照说明书步骤用FastKing一步法反转录-荧光定量试剂盒在SLAN-96P型实时荧光定量PCR系统(上海宏石医疗科技有限公司)中进行反应。引物序列为:5′-TAGCTTATCAGACTGATGTTGA-3′(miR-21-5p正向引物);5′-CTCGCTTCGGCAGCACA-3′(U6,正向引物),5′-AACGCTTCACGAATTTGCGT-3′ (U6,反向引物)。以U6作内部对照,用2-ΔΔCt法计算其miR-21-5p相对表达量。
6 LDH活性检测
将已转染miR-NC、miR-21-5p-mimic、miR-NC+ pcDNA-Con、miR-21-5p-mimic+pcDNA-Con、miR-21-5p-mimic+pcDNA-KLF6的HPAEC分别接种于96孔板并至于常氧或缺氧条件培养48 h后,每孔加入10 μL LDH释放试剂并于37 °C下孵育1 h,用OSE-MP25型微孔板离心机(天根生化科技(北京)有限公司)以500 r/min离心5 min收集细胞的上清液。并按照试剂盒说明,将上清液重新加到一个新的96孔板中,各孔分别加入50 μL LDH检测液,室温避光孵育30 min,用SuPerMax 3000FA型酶标仪(上海闪谱生物科技有限公司)检测450 nm处各孔光密度值以评估上清液中LDH的活性。
7 Hoechst染色
将已转染miR-NC或miR-21-5p-mimic的HPAE- C分别接种于96孔板并至于常氧或缺氧条件培养48 h后,将细胞用4%多聚甲醛固定,用5 μg/mL Hoechst 33342染料室温避光染色15 min,然后用TS-2型荧光显微镜(Nikon,日本)观察细胞核形态。
8 流式细胞术
将已转染miR-NC、miR-21-5p-mimic、miR-NC+ pcDNA-Con、miR-21-5p-mimic+pcDNA-Con、miR-21-5p-mimic+pcDNA-KLF6的HPAEC分别接种于6孔板并置于常氧或缺氧条件培养48 h后,并按照试剂盒说明书,在室温避光条件下分别孵育10 μL Annexin V-FITC和PI染液10 min,然后用EXFLOW-206型流式细胞仪(深圳市达科为生物技术股份有限公司)检测细胞凋亡率。
9 Western blot
用RIPA提取HPAEC的蛋白,Bradford法对蛋白定量后,用SDS-PAGE电泳分离蛋白,并将分离的蛋白转移至PVDF膜。将PVDF膜上蛋白用用5%(w/v)脱脂乳封闭后,室温孵育1:1000稀释的Cleaved caspase-3、KLF6和GAPDH或β-actin一抗2 h。用TBST洗膜后,室温孵育1:1000稀释的HRP偶联山羊抗兔或驴抗小鼠IgG (H+L)二抗1 h。TBST再次洗膜后,用化学发光液对条带显影,并用Image J软件通过光密度值测定法定量相对条带表达丰度,并用内参GAPDH或β-actin的条带的光密度值进行标准化。
10 miR-21-5p靶基因的预测和鉴定
用TargetScanHuman 7.2(http://www.targetscan.org/vert_72/)预测miR-21-5p靶基因。构建携带miR-21-5p靶基因KLF6的野生型(WT)或突变(MUT)3’-UTR的pmiRRB-report双荧光素酶报告载体质粒。用Lipofectamine 2000试剂分别将构建的WT或MUT的双荧光素酶报告载体质粒和miR-21-5p mimic或miR-NC转入细胞,并在转染48 h后,在GloMaxTM 20/20型生物化学发光分析仪(美国Promega公司)上用双荧光素酶报告基因测定试剂盒测量荧光素酶活性。
11 统计学分析
结果以均数±标准差表示。用SPSS 24.0软件对数据进行统计分析,多组数据间均数的两两比较采用单因素方差分析事后SNK-q检验。P<0.05时,认为有统计差异。
结 果
1 缺氧导致HPAEC中miR-21-5p表达下调
首先探索miR-21-5p表达是否响应缺氧条件。RT-qPCR检测显示,与常氧条件相比,缺氧条件下HPAEC中miR-21-5p表达降低,并且随着缺氧时间的延长,miR-21-5p的表达水平逐渐降低。后续实验选择缺氧处理时间为48h。
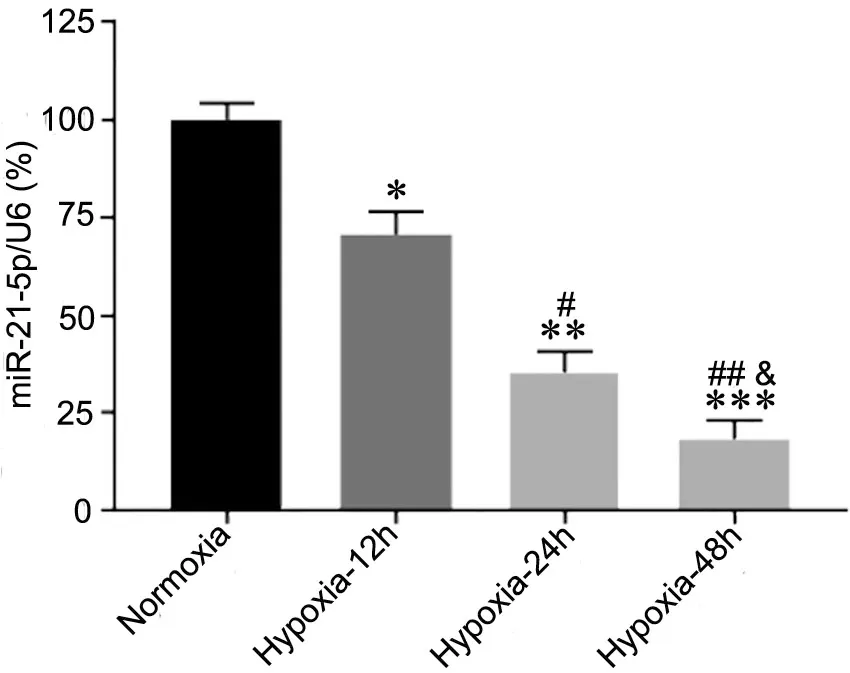
图1 HPAEC在常氧条件48 h或暴露于缺氧条件12、24和48 h,RT-qPCR检测miR-21-5p的表达。与Normoxia组比较:*P<0.05,**P<0.01,***P<0.001;与Hypoxia-12h组比较,#P<0.05,##P<0.01;与Hypoxia-24h组比较,&P<0.05;n=3Fig. 1 The expression of miR-21-5p was detected by RT-qPCR after 48 h of normoxia condition or 12, 24 and 48 h of hypoxia exposure respectively. Compared with Normoxia group: *P<0.05, **P<0.01, ***P<0.001; compared with Hypoxia-12h group: #P<0.05, ##P<0.01; compared with Hypoxia-24h group: &P<0.05; n=3
2 过表达miR-21-5p减轻缺氧诱导的HPAEC损伤
LDH活性检测显示,与常氧条件下的miR-NC组相比,缺氧条件下miR-NC组HPAEC的LDH的释放活性明显增加;与缺氧条件下的miR-NC组比较,缺氧条件下的miR-21-5p-mimic组HPAEC的LDH的释放活性明显降低,但仍高于常氧条件下的miR-NC组(图2A)。Hoechst染色显示,常氧条件下的miR-NC组HPAEC的细胞核正常,缺氧条件下的miR-NC组HPAEC的细胞核出现核固缩和凋亡荧光碎片,但miR-21-5p-mimic转染可明显减轻缺氧诱导的这些现象(图2B)。流式细胞术检测显示,miR-21-5p-mimic转染可明显减少由缺氧诱导的HPAEC凋亡(图2C、D)。此外Western blot检测进一步证实,缺氧可导致HPAEC中Cleaved caspase-3升高,用miR-21-5p-mimic转染可显著抑制缺氧诱导的HPAEC中Cleaved caspase-3水平(图2E、F)。
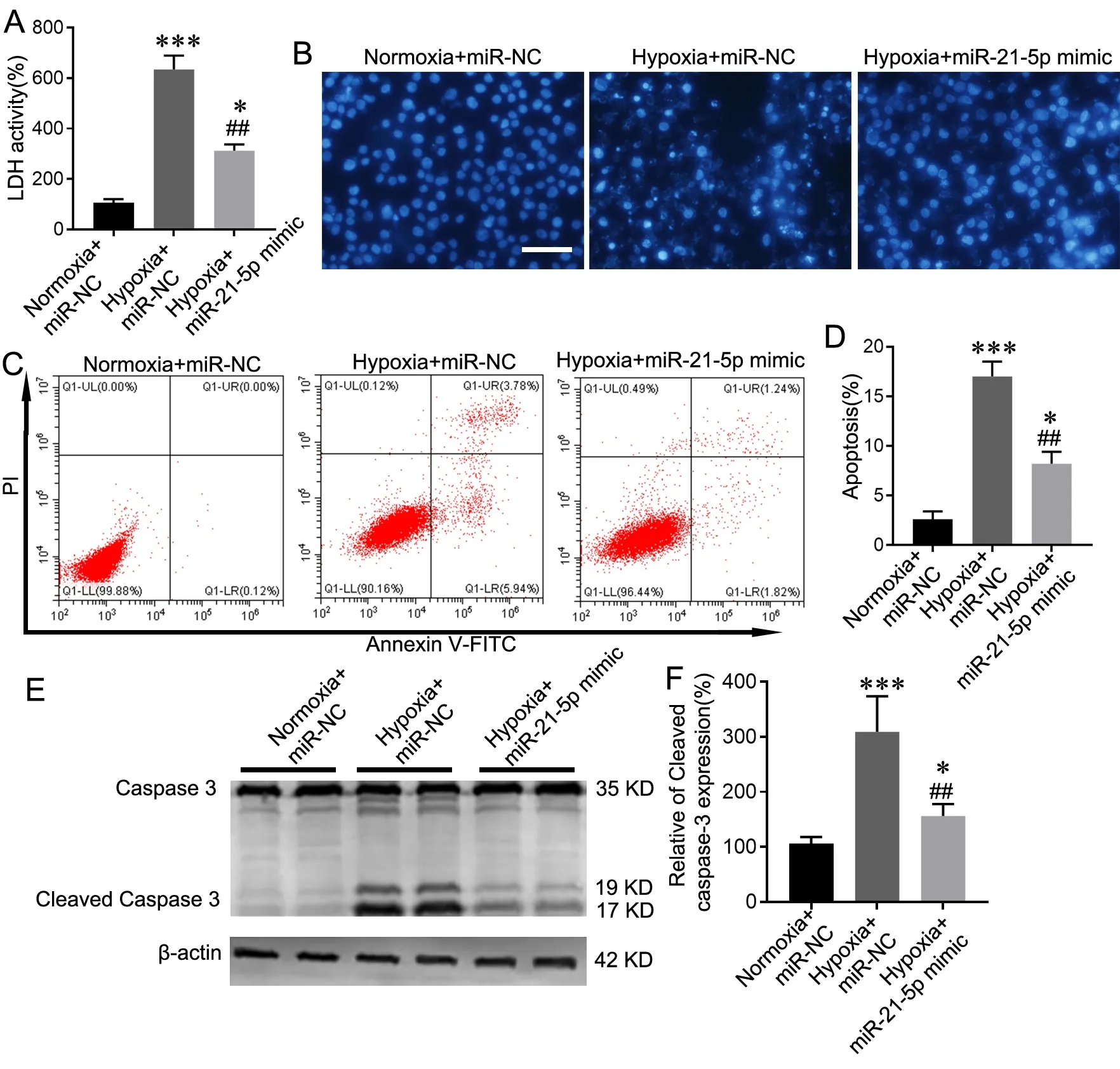
图2 过表达miR-21-5p可减轻缺氧诱导的HPAEC损伤。A,LDH释放水平;Hoechst染色(比例尺,20 μm);C,凋亡率代表性流式细胞术检测结果;D,凋亡率统计学分析;E,Cleaved caspase-3水平的代表性Western blot检测结果;F,Cleaved caspase-3水平统计学分析。与Normoxia+miR-NC组比较:*P<0.05,***P<0.001;与Hypoxia+miR-NC组比较:##P<0.01;n=4。Fig. 2 Overexpression of miR-21-5p attenuated hypoxia-induced HPAEC injury. A, LDH release level of HPAEC in different treatment groups; B, Hoechst staining (scale bar, 20 μm); C, representative flow cytometry analysis of apoptosis rate; D, statistical analysis of the apoptosis rate; E, representative Western blot detection of Cleaved caspase-3 level; F, statistical analysis of Cleaved caspase-3 level. Compared with Normoxia + miR-NC group: *P<0.05, ***P<0.001; compared with Hypoxia + miR-NC group, ##P<0.01; n=4
3 过表达KLF6抑制miR-21-5p对缺氧诱导的HPAEC损伤的保护作用
用TargetScanHuman 7.2软件预测KLF6可能是miR-21-5p的靶基因,因此,本研究首先检测了缺氧条件下HPAEC中KLF6水平。Western blot检测显示,与常氧条件比较,缺氧条件下HPAEC中KLF6蛋白表达明显升高(图3A、B)。对KLF6预测的与miR-21-5p具有结合位点的序列点突变(图3C)后,荧光素酶报告基因分析显示,miR-21-5p-mimic与KLF6 WT荧光报告质粒共转染能降低荧光相对活性,而miR-21-5p-mimic与KLF6 MUT荧光报告质粒共转染对荧光相对活性无影响(图3D);且进一步通过Western blot证明miR-21-5p过表达能降低KLF4水平(图3E、F)。这些结果表明KLF6是miR-21-5p的靶基因。
为进一步验证KLF6在miR-21-5p抑制缺氧诱导的HPAEC损伤中的功能,本实验用pcDNA-KLF6和miR-21-5p-mimic共转染HPAEC,并评估细胞损伤的相关指标。结果显示,在缺氧条件下,与pcDNA-Con和miR-21-5p-mimic共转染比较,pcDNA-KLF6和miR-21-5p-mimic共转染显著增加HPAEC的LDH释放水平(图3G)和凋亡率(图3H、I)。这些结果表明,过表达KLF6能消除miR-21-5p对缺氧诱导的HPAEC损伤的抑制作用。
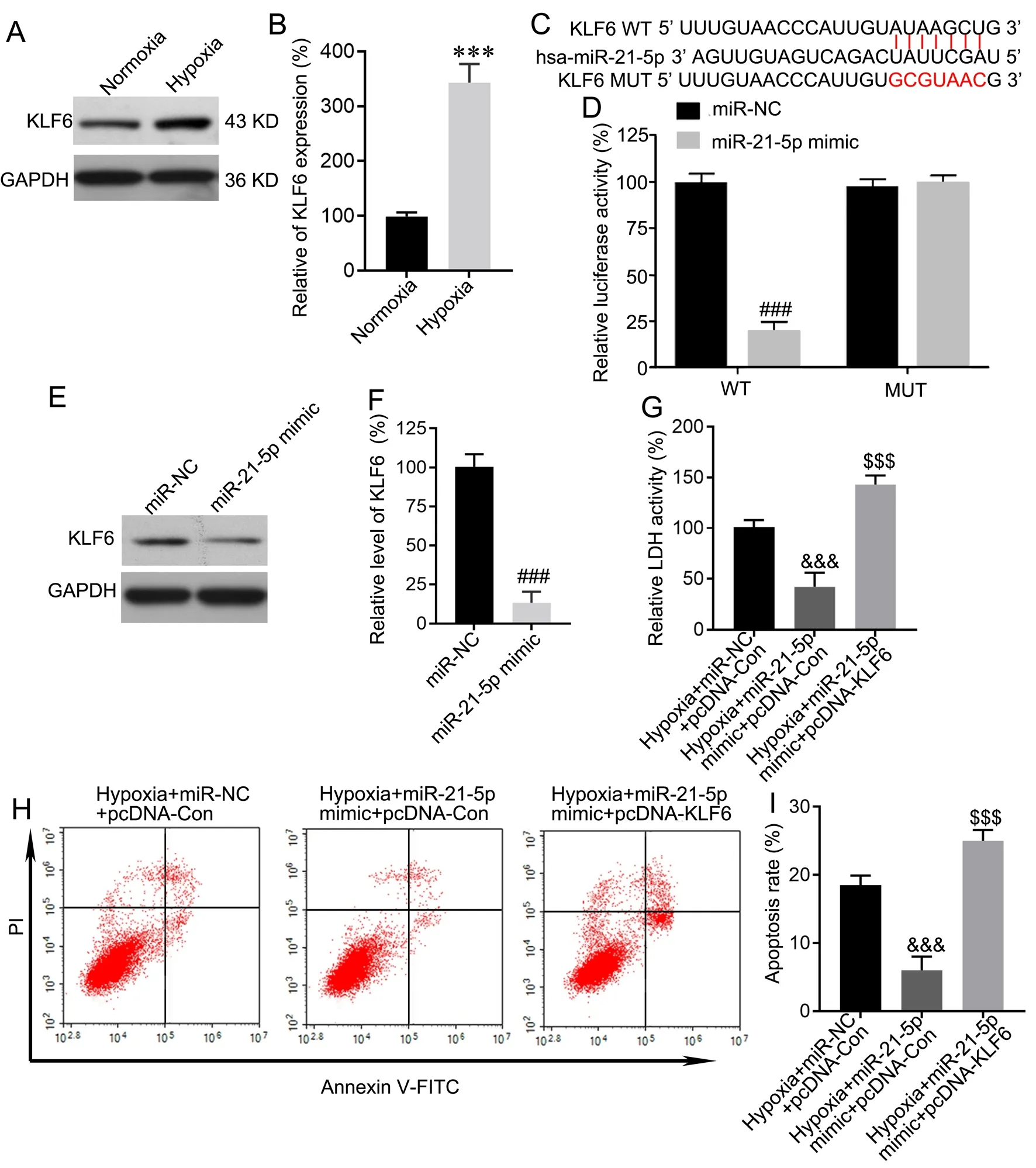
图3 miR-21-5p通过下调KLF6抗HPAEC缺氧损伤。A,缺氧对HPAEC中KLF6水平影响的代表性Western blot检测;B,缺氧对HPAEC中KLF6水平影响的统计学分析;与Normoxia组比较:***P<0.001,n=3。C和D,miR-21-5p和KLF6之间的碱基互补序列(C)以及通过荧光素酶活性测定法验证(D);与miR-NC组比较:###P<0.001,n=3。E,miR-21-5p-mimic对HPAEC中KLF6水平影响的代表性Western blot检测;F,miR-21-5p-mimic对HPAEC中KLF6水平影响的统计学分析;与miR-NC组比较:###P<0.001,n=3。G,缺氧、miR-21-5p-mimic和KLF6对HPAEC释放LDH影响的统计学分析;与Hypoxia+miR-NC+pcDNA-Con组比较:&&&P<0.001,n=3。与Hypoxia+miR-21-5p-mimic+pcDNA-Con组比较:$$$P<0.001,n=3。H,缺氧、miR-21-5p-mimic和KLF6对HPAEC凋亡的代表性流式细胞术检测结果I,缺氧、miR-21-5p-mimic和KLF6对HPAEC凋亡率的统计学分析;与Hypoxia+miR-NC+pcDNA-Con组比较:&&&P<0.001;与Hypoxia+miR-21-5p-mimic+pcDNA-Con组比较:$$$P<0.001;n=3Fig. 3 miR-21-5p inhibits hypoxia-induced injury of HPAEC by down-regulating KLF6. A, representative Western blot detection of the effect of hypoxia on KLF6 level in HPAEC; B, statistical analysis of the effect of hypoxia on KLF6 level in HPAEC; compared with normoxia group: ***P<0.001, n=3. C and D, base complementation sequence between miR-21-5p and KLF6 (C) was verified by luciferase activity assay (D); compared with miR-NC group, ###P<0.001, n=3. E, representative Western blot detection of the effect of miR-21-5p-mimic on KLF6 level in HPAEC; F, statistical analysis of the effect of miR-21-5p-mimic on KLF6 level in HPAEC; compared with miR-NC group, ###P<0.001, n=3. G, statistical analysis of effect of hypoxia, miR-21-5p-mimic and KLF6 on LDH release from HPAEC; compared with Hypoxia + miR-NC + pcDNA-Con group, &&&P<0.001, n=3. H, representative flow cytometry results of hypoxia, miR-21-5p-mimic and KLF6 on apoptosis of HPAEC; I, statistical analysis of effect of hypoxia, miR-21-5p-mimic and KLF6 on apoptosis rate of HPAEC; compared with Hypoxia + miR-NC + pcDNA-Con group, &&&P<0.001; compared with Hypoxia+miR-21-5p-mimic+pcDNA-Con group, $$$P<0.001; n=3
讨 论
PAH是一种慢性进行性和致命性疾病[1]。而目前,常用的治疗策略对PAH治疗效果有限[11]。众所周知,缺氧诱导的PAEC损伤参与低氧性PAH的病理过程[4,5]。以往的研究已经报道,在缺氧诱导的大鼠PAH模型中,肺动脉血管内膜完整性遭到严重破坏[8]。血管内膜主要由血管内皮构成,血管内皮不仅是血管与血液间的通透性屏障,而且血管内皮能分泌多种血管活性物质[12]。长期低氧能诱导血管内皮功能障碍,进而诱导PAEC活化、血管炎症增加、损伤凋亡、脱落和NO释放降低、血管收缩舒张功能障碍最终导致血管重构和血管闭塞,最终导致PAH的形成[13,14]。因此,抑制低氧诱导的PAEC损伤凋亡能促进肺动脉血管内皮的修复和改善内皮功能,进而改善PAH的血管重构。本研究结果显示,在缺氧诱导的HPAEC损伤的同时伴随着miR-21-5p表达的降低,而过表达miR-21-5p则能显著减轻缺氧诱导的HPAEC损伤,这一结果说明miR-21-5p可能是预防和治疗PAH的新靶点。
本研究进一步对miR-21-5p发挥细胞保护的机制进行了探索。miRNA是通过转录后抑制靶基因表达来发挥生物学效应[6]。本研究首先通过生物信息学发现KLF6与miR-21-5p存在碱基互补序列,并通过荧光素酶活性法和Western blot证实KLF6是miR-21-5p的靶基因。Krüppel样因子(KLF)可以与特定的DNA基序结合并调节代谢、细胞增殖和分化等各种细胞功能[15,16]。KLF6是该家族的一员,已经被报道其能促进细胞凋亡的作用[16,17]。本研究结果显示,miR-21-5p能通过下调KLF6来抑制缺氧诱导的HPAEC损伤。
总之,本研究结果显示,缺氧能下调HPAEC中的miR-21-5p表达,而过表达miR-21-5p则能抑制缺氧诱导的HPAEC损伤,且miR-21-5p这一功能通过下调靶基因KLF6编码的蛋白表达来实现。因此,miR-21-5p可能是预防和治疗PAH的新靶点。

