大鼠肠道菌群对吡嗪酰胺及其活性代谢产物吡嗪酸药动学参数的影响
刘庆香 武正华 赖雅琳 范国荣 范琦


摘 要 目的:研究大鼠腸道菌群对吡嗪酰胺及其活性代谢产物吡嗪酸药动学参数的影响。方法:将16只SD大鼠随机分为实验组和对照组,每组8只。实验组大鼠灌胃混合抗生素(硫酸链霉素+硫酸新霉素)构建伪无菌大鼠模型。建模后,两组大鼠灌胃吡嗪酰胺(150 mg/kg),并于给药前和给药后0.167、0.333、0.667、1、1.5、2、3、4、6、9 h时从眼眶静脉丛采血0.1 mL,给药后12、24 h时从眼眶静脉丛采血0.3 mL。以非那西丁为内标,采用液相色谱-串联质谱法测定大鼠血浆中吡嗪酰胺和吡嗪酸的浓度。以Agilent Zorbax SB-Aq为色谱柱,以0.2%甲酸水溶液(含8 mmol/L乙酸铵)-甲醇为流动相进行梯度洗脱,流速为1 mL/min,柱温为30 ℃,进样量为10 μL;以电喷雾电离源为离子源,离子源温度为500 ℃;碰撞气为氮气,压力为10 psi;质谱传输接口温度为100 ℃;质谱监测模式为多反应监测,采集模式为正离子模式;用于定量分析的离子对分别为m/z 124.0→79.0(吡嗪酰胺)、m/z 125.1→79.1(吡嗪酸)、m/z 180.0→110.2(内标),去簇电压分别为55、26、85 V,碰撞电压分别为24、23、28 V。使用DAS 2.1.1软件计算药动学参数并比较。结果:吡嗪酰胺和吡嗪酸检测质量浓度的线性范围分别为25~5 000 ng/mL(r=0.997 6)、100~12 500 ng/mL(r=0.999 0);定量下限分别为25、100 ng/mL;批内、批间准确度为92.93%~100.50%,批内、批间精密度和基质效应试验的RSD均不高于8.42%(n=6或n=3)。与对照组比较,实验组大鼠体内吡嗪酰胺的tmax显著延长(P<0.01),而其余药动学参数组间比较差异无统计学意义(P>0.05)。结论:大鼠肠道菌群改变可导致单剂量吡嗪酰胺的吸收延迟。
关键词 吡嗪酰胺;吡嗪酸;大鼠;肠道菌群;药动学;液相色谱-串联质谱法
ABSTRACT OBJECTIVE: To study the effects of rat intestinal flora on the pharmacokinetic parameters of pyrazinamide and its active metabolite pyrazinoic acid. METHODS: Totally 16 SD rats were randomly divided into trial group and control group, with 8 rats in each group. Trial group was given mixed antibiotics (streptomycin sulfate+neomycin sulfate) intragastrically to construct pseudoaseptic rat model. After modeling, both groups were given pyrazinamide intragastrically (150 mg/kg). Before and 0.167, 0.333, 0.667, 1, 1.5, 2, 3, 4, 6, 9 h after administration, 0.1 mL blood sample was collected from orbital venous plexus, and 0.3 mL blood sample was collected from orbital venous plexus 12, 24 h after administration. Using phenacetin as internal standard, LC-MS/MS method was adopted to determine the plasma concentration of pyrazinamide and pyrazinoic acid. The determination was performed on Agilent ZORBAX SB-Aq column with mobile phase consisted of 0.2% formic acid (containing 8 mmol/L ammonium acetate)-methanol (gradient elution) at the flow rate of 1 mL/min. The column temperature was set at 30 ℃, and sample size was 10 μL. The ion source was ESI and the temperature of ion source was 500 ℃. The collision gas was nitrogen and the pressure was 10 psi. The temperature of mass transfer interface was 100 ℃. The mass spectrum monitoring mode was multi reaction monitoring, and the collection mode was positive ion mode. The monitoring transition ion-pairs were m/z 124.0→79.0 (pyrazinamide), m/z 125.1→79.1 (pyrazinic acid) and m/z 180.0→110.2 (internal standard). The de-clustering potential and collision voltage were 55, 26 and 85 V, 24, 23 and 28 V, respectively. The pharmacokinetic parameters were calculated and compared by using DAS 2.1.1 software. RESULTS: The linear ranges of pyrazinamide and pyrazinoic acid were 25-5 000 ng/mL (r=0.997 6) and 100-12 500 ng/mL (r=0.999 0). The lower limits of quantification were 25 and 100 ng/mL, respectively. Intra-batch and inter-batch accuracy were 92.93%-100.50%, and RSDs of intra-batch and inter-batch precision and matrix effect tests were all lower than or equal to 8.42% (n=6 or n=3). Compared with control group, tmax of pyrazinamide in trial group was prolonged significantly (P<0.01); there was no statistical significance in other pharmacokinetic parameters between 2 groups (P>0.05). CONCLUSIONS: The absorption of single dose pyrazinamide is delayed with the change of intestinal flora in rats.
KEYWORDS Pyrazinamide; Pyrazinoic acid; Rat; Intestinal flora; Pharmacokinetics; LC-MS/MS
结核病是全球最严重的传染病之一[1]。吡嗪酰胺(化学结构式见图1A)是治疗结核病的一线药物,对药物敏感性和多药耐药性结核病均表现出独特、优良的治疗作用,其不但能够降低结核病复发率,还能够缩短结核病治疗周期,常用于对异烟肼和利福平耐药的结核病患者的治疗[2]。有研究表明,吡嗪酰胺经肝微粒体酰胺酶代谢产生的主要活性代谢产物吡嗪酸(化学结构式见图1B)可与天冬氨酸脱羧酶结合,中断结核分枝杆菌辅酶A的生物合成,从而起到杀菌作用[3]。但是,相较于其它抗结核药物,吡嗪酰胺被证实具有更强的肝毒性[4-6]。已有研究报道,联用吡嗪酰胺酶抑制剂可以减轻吡嗪酰胺诱导的SD大鼠肝损伤,由此推测该药引起的肝毒性可能与其代谢产物吡嗪酸有关[7]。可见,关注吡嗪酰胺的体内代谢,对提高抗结核病的疗效、降低毒副作用均具有重要意义。
口服药物在胃肠道被吸收入血前,可能被寄居在肠道内的菌群转化为具有生物活性、生物惰性或毒性的代谢产物,然后再吸收入血[8]。本课题组前期研究显示,灌胃吡嗪酰胺后,SD大鼠体内吡嗪酰胺的胆汁浓度远高于粪便浓度,据此推测吡嗪酰胺可能在肠道内发生了生物转化。基于此,本文拟通过灌胃混合抗生素复制伪无菌SD大鼠模型,建立测定大鼠血浆中吡嗪酰胺及其活性代谢产物吡嗪酸浓度的液相色谱-串联质谱法(LC-MS/MS),研究大鼠肠道菌群对吡嗪酰胺和吡嗪酸药动学参数的影响,旨在为提高吡嗪酰胺的療效及降低其毒副作用提供参考。
1 材料
1.1 主要仪器
LC-20A型液相色谱系统(配有LC-20AD型二元泵、DGU-20A3型脱气机、SIL-20A型自动进样器、CTO- 20AC型柱温箱)、AUW220D型电子分析天平均购自日本Shimadzu公司,API 4000型三重四极杆质谱仪(配有Analyst software 1.6工作站)购自美国AB Sciex公司,MX-S型涡旋混合仪购自美国Scilogex公司,SK7200H型超声仪购自上海科导超声仪器有限公司,Research UV型超纯水机购自上海和泰仪器有限公司,Sorvall Legend Micro21R型离心机购自美国Thermo Fisher Scientific公司。
1.2 主要药品与试剂
吡嗪酰胺对照品(批号100178-201104,纯度99%)购自中国食品药品检定研究院,吡嗪酸对照品(批号STBG6304,纯度98%)购自美国Sigma-Aldrich公司,非那西丁对照品(内标,批号N1216AS,纯度98%)、吡嗪酰胺原料药(批号MB2017,纯度>99%)、硫酸链霉素原料药(批号MB1275,规格>720 U/mg)、硫酸新霉素原料药(批号MB1716,规格>600 U/mg)均购自大连美仑生物技术有限公司,羧甲基纤维素钠(CMC-Na,食品级)购自河南万邦实业有限公司,甲醇(色谱纯)购自美国Tedia试剂公司,甲酸和乙酸铵(色谱纯)购自美国ACS公司;其余试剂均为分析纯或实验室常用规格,水为超纯水。
1.3 动物
清洁级健康SD大鼠,雌雄各半,体质量均为200~220 g,购自上海市计划生育科学研究所实验动物经营部,动物生产许可证号为SCXK(沪)2018-0006。
2 方法与结果
2.1 色谱与质谱条件
2.1.1 色谱条件 以Agilent Zorbax SB-Aq(150 mm×4.6 mm,5 μm)为色谱柱,以0.2%甲酸水溶液(含8 mmol/L乙酸铵)为流动相A、以甲醇为流动相B进行梯度洗脱(0~0.6 min,40%B;0.6~4.0 min,90%B;4.0~5.0 min,40%B);流速为1 mL/min,柱温为30 ℃,进样量为10 μL。
2.1.2 质谱条件 离子源为电喷雾电离源,离子源温度为500 ℃;碰撞气为氮气,压力为10 psi;质谱传输接口温度为100 ℃;质谱监测模式为多反应监测(MRM),采集模式为正离子模式;用于定量分析的离子对分别为m/z 124.0→79.0(吡嗪酰胺)、m/z 125.1→79.1(吡嗪酸)、m/z 180.0→110.2(内标),去簇电压分别为55、26、85 V,碰撞电压分别为24、23、28 V。
2.2 校正混合对照品溶液与质控混合对照品溶液的制备
精密称取吡嗪酰胺、吡嗪酸对照品各适量,分别用80%甲醇溶解并稀释,制成质量浓度均为1 mg/mL的校正对照品储备液,于4 ℃下保存,备用。精密量取上述校正对照品储备液适量,用80%甲醇稀释,制成质量浓度分别为100、80、40、20、10、4、2、1、0.5 μg/mL的吡嗪酰胺校正对照品系列溶液和250、200、160、100、40、20、10、4、2 μg/mL的吡嗪酸校正对照品系列溶液。同法制备质量浓度分别为80、40、1、0.5 μg/mL的吡嗪酰胺质控对照品系列溶液和200、160、4、2 μg/mL的吡嗪酸质控对照品系列溶液。精密量取对应浓度的吡嗪酰胺和吡嗪酸校正对照品系列溶液各500 μL,混合,制成吡嗪酰胺质量浓度分别为50、40、20、10、5、2、1、0.5、0.25 μg/mL和吡嗪酸质量浓度分别为125、100、80、50、20、10、5、2、1 μg/mL的校正混合对照品系列溶液。同法制备吡嗪酰胺质量浓度分别为40、20、0.5、0.25 μg/mL和吡嗪酸质量浓度分别为100、80、2、1 μg/mL的高、中、低质量浓度和定量下限混合对照品溶液。
2.3 内标溶液的制备
精密称取非那西丁对照品适量,用80%甲醇溶解并稀释,制成质量浓度为1 mg/mL的内标储备液,于4 ℃下保存,备用。临用时,精密量取上述内标储备液适量,用80%甲醇稀释,制成1 μg/mL的内标溶液。
2.4 灌胃混悬液的制备
2.4.1 混合抗生素混悬液 精密称取硫酸链霉素、硫酸新霉素原料药各适量,用0.5%CMC-Na溶液溶解并稀释,制成质量浓度均为20 mg/mL的混合抗生素混悬液。
2.4.2 吡嗪酰胺混悬液 精密称取吡嗪酰胺原料药适量,用0.5%CMC-Na溶液溶解并稀释,制成质量浓度为30 mg/mL的吡嗪酰胺混悬液。
2.5 分组、造模与给药
将16只SD大鼠随机分为实验组和对照组,每组8只,雌雄各半。参考文献[9-10]方法,实验组大鼠灌胃20 mg/mL的混合抗生素混悬液(100 mg/kg),早晚各1次,连续6 d,构建伪无菌大鼠模型;对照组大鼠灌胃等体积生理盐水,早晚各1次,连续6 d。建模后,实验组(经1 d的清洗期后)和对照组大鼠均禁食不禁水12 h,单次灌胃30 mg/mL的吡嗪酰胺混悬液(150 mg/kg)[11-12]。
2.6 大鼠血浆样品的处理
取大鼠血浆样品100 μL,加内标溶液10 μL,再加甲醇300 μL,涡旋3 min,于4 ℃下以13 800×g离心10 min,取上清液,备测。
2.7 方法学考察
参考2020年版《中国药典》(四部)通则“生物样品定量分析方法验证指导原则”[13]进行方法学考察。
2.7.1 选择性 取大鼠空白血浆(不加内标)、大鼠空白血浆+混合对照品溶液(定量下限质量浓度)、大鼠灌胃给药后1.5 h的血浆样品,按“2.6”项下方法处理后,再按“2.1”项下色谱与质谱条件进样测定,记录色谱图,详见图2。结果,吡嗪酰胺、吡嗪酸、内标的保留时间分别为2.94、1.90、3.27 min,且大鼠血浆内源性杂质对上述成分的测定无干扰。
2.7.2 残留 取大鼠空白血浆+高质量浓度的校正混合对照品溶液、大鼠空白血浆(不加内标)适量,分别按“2.6”项下方法处理后,再按“2.1”项下色谱与质谱条件依次进样测定。结果,大鼠空白血浆中未见吡嗪酰胺、吡嗪酸、内标残留,表明进样高质量浓度样品后,不会影响后续样品的分析。
2.7.3 标准曲线与定量下限 取“2.2”项下校正混合对照品系列溶液各10 μL,分别加至大鼠空白血浆90 μL中,混匀,按“2.6”项下方法处理后,再按“2.1”項下色谱与质谱条件进样测定,记录峰面积。以吡嗪酰胺或吡嗪酸的质量浓度(x,ng/mL)为横坐标、以吡嗪酰胺或吡嗪酸与内标的峰面积比值(y)为纵坐标,采用最小二乘法(权重系数为1/x2)进行线性回归分析。结果,大鼠血浆中吡嗪酰胺的检测质量浓度在25~5 000 ng/mL范围内,得回归方程y=0.000 346x+0.003 13(r=0.997 6);吡嗪酸的检测质量浓度在100~12 500 ng/mL范围内,得回归方程y=0.004 9x+0.051 9(r=0.999 0);吡嗪酰胺的定量下限为25 ng/mL,吡嗪酸的定量下限为100 ng/mL。
2.7.4 准确度与精密度 取“2.2”项下吡嗪酰胺和吡嗪酸的定量下限和低、中、高质量浓度的混合对照品溶液10 μL,分别加至大鼠空白血浆90 μL中,混匀,按“2.6”项下方法处理后,再按“2.1”项下色谱与质谱条件进样测定。每质量浓度样品平行制备6份,考察批内准确度和精密度;连续3 d测定3个分析批,考察批间准确度和精密度,结果见表1。
2.7.5 稀释可靠性 分别取吡嗪酰胺、吡嗪酸的校正对照品储备液各适量,用大鼠空白血浆稀释,制成质量浓度为40 μg/mL的吡嗪酰胺血浆模拟样品和100 μg/mL的吡嗪酸血浆模拟样品,再用大鼠空白血浆稀释10倍和50倍后,按“2.6”项下方法处理,再按“2.1”项下色谱与质谱条件进样测定。每稀释倍数平行制备6份。将所测峰面积代入回归方程计算含量,并乘以相应的稀释倍数计算得到其实测质量浓度,与对应理论质量浓度的模拟血浆样品比较计算准确度[用相对误差(RE)表示]和精密度(用RSD表示)。结果,大鼠血浆中吡嗪酰胺和吡嗪酸稀释10倍后,所得RE分别为-9.05%、-5.95%,RSD分别为3.21%、4.87%(n=6);大鼠血浆中吡嗪酰胺和吡嗪酸稀释50倍后,所得RE分别为-8.65%、-8.67%,RSD分别为3.95%、4.31%(n=6)。这表明大鼠血浆样品经10倍甚至50倍稀释后,其中的吡嗪酰胺和吡嗪酸仍可用所建方法准确测定。
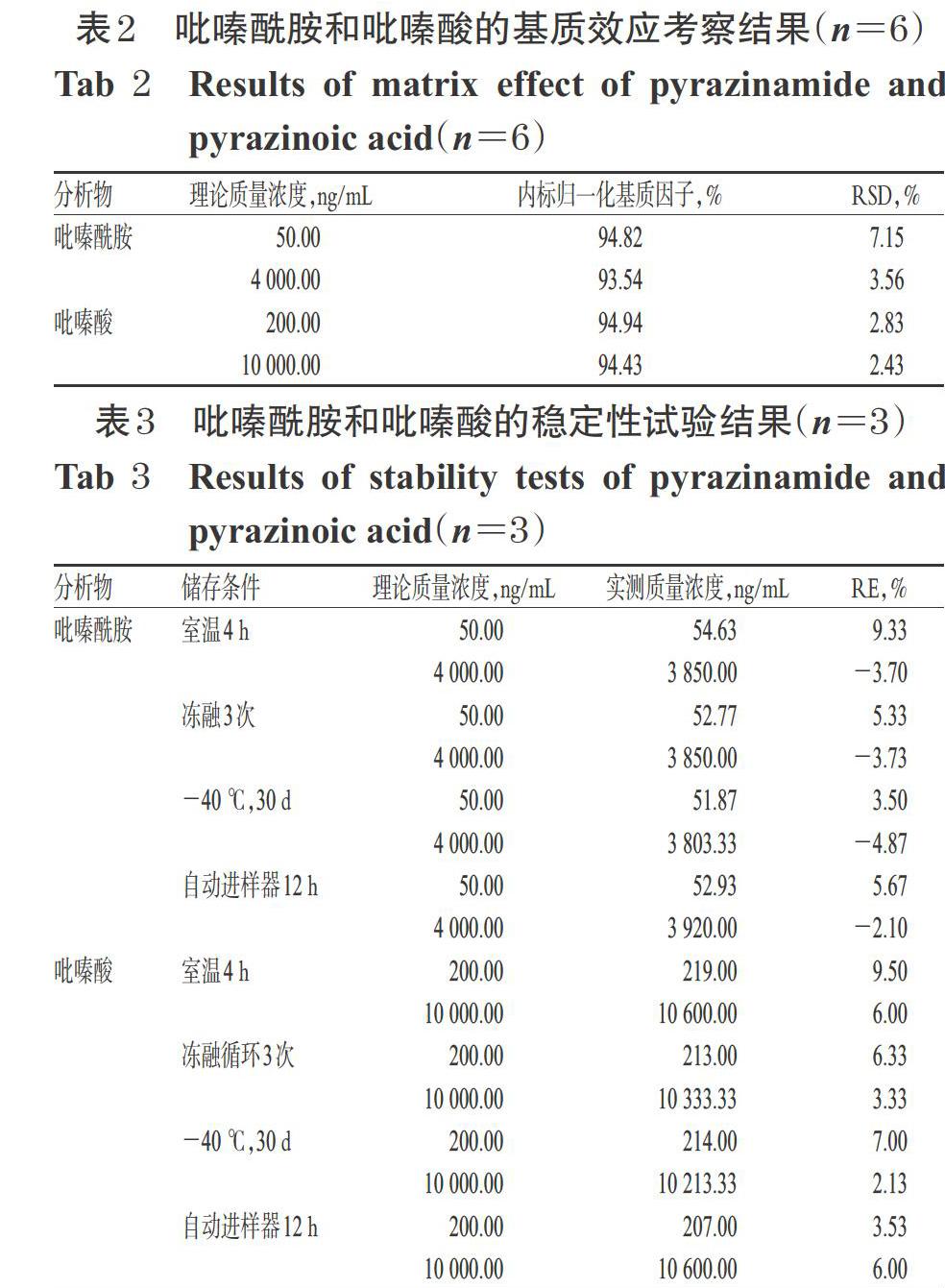
2.7.6 基质效应 取6份不同来源的大鼠空白血浆各90 μL,除不加内标外,其余均按“2.6”项下方法处理后,再分别加入内标溶液10 μL和“2.2”项下高、低质控混合对照品溶液10 μL制备高、低质量浓度的血浆样品,按“2.1”项下色谱与质谱条件进样测定,记录峰面积(A1);另按“2.2”项下方法制备对应高、低质量浓度的吡嗪酰胺、吡嗪酸、内标对照品溶液,直接进样测定,记录峰面积(A2)。以A1/A2×100%计算吡嗪酰胺、吡嗪酸、内标的基质因子,再用吡嗪酰胺和吡嗪酸的基质因子除以内标基质因子,计算内标归一化基质因子,结果见表2。
2.7.7 稳定性 取“2.2”项下高、低质量浓度的质控混合对照品溶液各10 μL,分别加至大鼠空白血浆90 μL中,混匀,分别在室温放置4 h、冻融(-20℃~室温)3次、-40 ℃冻存30 d等条件下储存后,立即按“2.6”项下方法处理,再按“2.1”项下色谱与质谱条件进样测定,记录峰面积,代入回归方程计算含量;同法考察按“2.6”项下方法处理后于自动进样器放置12 h的含量。每质量浓度样品平行制备3份,以RE考察各样品的稳定性,结果见表3。
2.8 药动学研究
2.8.1 药-时曲线的绘制 将16只SD大鼠按“2.5”项下方法分组、造模、给药,分别于给药前(0 h)和给药后0.167、0.333、0.667、1、1.5、2、3、4、6、9 h时从眼眶静脉丛采血约0.1 mL,给药后12、24 h时从眼眶静脉丛采血约0.3 mL置于肝素钠抗凝离心管中,于4 ℃下以4 700×g离心10 min,取上层血浆,于-40 ℃冻存。将上述血浆样品分别按“2.6”项下方法處理后,再按“2.1”项下色谱与质谱条件进样分析,测定血浆中吡嗪酰胺和吡嗪酸的浓度,其中0.167、0.333、0.667、1、1.5、2、3、4、6 h等9个时间点的血浆样品用大鼠空白血浆进行50倍稀释,9 h时的血浆样品进行10 倍稀释。以Origin 2019b软件绘制吡嗪酰胺和吡嗪酸在大鼠体内的药-时曲线(给药前的血浆样品是为了考察内源性杂质是否影响药物出峰,不计入药-时曲线),结果见图3。
2.8.2 药动学参数的计算 使用DAS 2.1.1软件计算实验组和对照组大鼠体内吡嗪酰胺和吡嗪酸的主要药动学参数,使用SPSS 26.0软件进行统计分析。当数据符合正态分布时,以x±s表示,两两比较采用t检验;当数据不符合正态分布时,以中位数表示,两两比较采用非参数秩和检验。P<0.05表示差异有统计学意义。结果,与对照组比较,实验组大鼠吡嗪酰胺的tmax显著延长(P<0.01);而其他药动学参数组间比较差异均无统计学意义(P>0.05),详见表4。
3 讨论
3.1 含量测定方法的建立
本文参考同时测定大鼠血浆中吡嗪酰胺及其活性代谢产物吡嗪酸含量的高效液相色谱法[14]的色谱条件,以及同时测定吡嗪酰胺与其它抗结核药物含量的LC-MS/MS法的质谱条件[15-16],建立了测定大鼠血浆中吡嗪酰胺和吡嗪酸含量的LC-MS/MS法。与高效液相色谱法比较,LC-MS/MS法分析效能更高、分析速度更快。
3.2 流动相的优化
本文前期选择流动性时,考察了0.1%和0.2%的甲酸水溶液,发现以0.2%甲酸水溶液为水相可显著提高离子化效率;考察了甲醇和乙腈,发现以甲醇为有机相可使吡嗪酰胺或吡嗪酸有更好的色谱峰峰形;且在水相中加入8 mmol/L乙酸铵可进一步改善峰形,故最终选择0.2%甲酸水溶液(含8 mmol/L乙酸铵)-甲醇作为流动相,进行梯度洗脱。
3.3 药动学实验的设计
肠道菌群主要由肠杆菌科细菌组成,既有革兰氏阳性菌,又有革兰氏阴性菌[17]。因此,本文选择能有效抑制各类肠道细菌的广谱抗生素硫酸链霉素和硫酸新霉素,通过灌胃混合抗生素混悬液的方式建立伪无菌大鼠模型,以研究大鼠肠道菌群改变对吡嗪酰胺及其活性代谢产物吡嗪酸药动学参数的影响。参考文献所报道的抗生素使用剂量,确定实验组大鼠灌胃20 mg/mL混合抗生素混悬液(100 mg/kg),早晚各1次,连续6 d[9-10]。世界卫生组织推荐吡嗪酰胺的成人用剂量为20~30 mg/kg[11],采用大鼠剂量换算公式[12]按成人用剂量的6.3倍换算,确定吡嗪酰胺的给药方案为150 mg/kg。
本研究结果显示,与对照组比较,实验组大鼠吡嗪酰胺的tmax显著延长(P<0.01),提示大鼠肠道菌群变化可导致单剂量吡嗪酰胺的吸收延迟。但本文仅考察了肠道菌群变化对单剂量灌胃后吡嗪酰胺药动学参数的影响,而吡嗪酰胺在临床上需要长期给药,故本课题组后续将进一步考察肠道菌群变化对多剂量吡嗪酰胺药动学的影响。
参考文献
[ 1 ] WORLD HEALTH ORGANIZATION. Global tuberculosis report 2019[R/OL]. [2020-11-25]. https://apps.who.int/iris/handle/10665/329368.
[ 2 ] NJIRE M,TAN Y,MUGWERU J,et al. Pyrazinamide resistance in Mycobacterium tuberculosis:review and update[J]. Adv Med Sci,2016,61(1):63-71.
[ 3 ] GOPAL P,SARATHY JP,YEE M,et al. Pyrazinamide triggers degradation of its target aspartate decarboxylase[J]. Nat Commun,2020. DOI:10.1038/s41467-020- 15516-1.
[ 4 ] YEE D,VALIQUETTE C,PELLETIER M,et al. Incidence of serious side effects from first-line antituberculosis drugs among patients treated for active tuberculosis[J].Am J Respir Crit Care Med,2003,167(11):1472-1477.
[ 5 ] 覃红娟,谭守勇,邝浩斌,等.吡嗪酰胺与抗结核药物肝损伤的相关性[J].实用医学杂志,2016,32(12):1948-1951.
[ 6 ] 马瑞娇,贾智莉,王学芳,等.基于斑马鱼模型的抗结核药物肝脏毒性比较研究[J].中国抗生素杂志,2020,45(9):953-959.
[ 7 ] SHIH TY,PAI CY,YANG P,et al. A novel mechanism underlies the hepatotoxicity of pyrazinamide[J]. Antimic- rob Agents Chemother,2013,57(4):1685-1690.
[ 8 ] SPANOGIANNOPOULOS P,BESS EN,CARMODY RN,et al. The microbial pharmacists within us:a metagenomic view of xenobiotic metabolism[J]. Nat Rev Microbiol,2016,14(5):273-287.
[ 9 ] YANG B,LI H,RUAN Q,et al. Effects of gut microbiota and ingredient-ingredient interaction on the pharmacokinetic properties of rotundic acid and pedunculoside[J].Planta Med,2019. DOI:10.1055/a-0902-5300.
[10] TIWARI SS,MUKESH S,SANGAMWAR AT,et al. In vivo metabolic investigation of cetilistat in normal versus pseudo-germ-free rats using UPLC-QTOFMS/MS and in silico toxicological evaluation of its metabolites[J].Biomed Chromatogr,2020. DOI:10.1002/bmc.4860.
[11] WORLD HEALTH ORGANIZATION. Guidelines for treatment of drug-susceptible tuberculosis and patient care:2017 update[S]. 2017-07-01.
[12] 黄继汉,黄晓晖,陈志扬,等.药理试验中动物间和动物与人体间的等效剂量换算[J].中国临床药理学与治疗学,2004,9(9):1069-1072.
[13] 国家药典委员会.中华人民共和国药典:四部[S]. 2020年版.北京:中国医药科技出版社,2020:466-472.
[14] WU JW,TSAI TH. Effect of silibinin on the pharmacokinetics of pyrazinamide and pyrazinoic acid in rats[J]. Drug Metab Dispos,2007,35(9):1603-1610.
[15] WANG L,XU Y,LIANG L,et al. LC-MS/MS method for the simultaneous determination of PA-824,moxifloxacin and pyrazinamide in rat plasma and its application to pharmacokinetic study[J]. J Pharm Biomed Anal,2014. DOI:10.1016/j.jpba.2014.03.046.
[16] WU S,FAN X,JIANG J,et al. Validation of a universal and highly sensitive two-dimensional liquid chromatography-tandem mass spectrometry methodology for the quantification of pyrazinamide,ethambutol,protionamide,and clofazimine in different biological matrices[J]. J Chromatogr B Analyt Technol Biomed Life Sci,2020. DOI:10.1016/j.jchromb.2020.122141.
[17] GUARNER F,MALAGELADA JR. Gut flora in health and disease[J]. Lancet,2003,361(9356):512-519.
(收稿日期:2020-11-03 修回日期:2021-01-10)
(編辑:邹丽娟)

