2010-2020年我国中成药药品说明书修订情况分析

摘 要 目的:为进一步规范和完善中成药药品说明书、促进其临床安全合理使用提供依据。方法:查询国家药品监督管理局网站2010年1月-2020年6月发布的、药品说明书修订内容明确的中成药品种,归纳并分析修订内容、特点及不足,提出修改建议。结果与结论:在修订内容明确的107个中成药品种中,安全性项目为修订重点,修订“禁忌”项的有106个(占99.07%),修订“注意事项”项的有103个(占96.26%),修订“不良反应”项的有102个(占95.33%),修订“警示语”项的有49个(占45.79%)等。涉及修订的药品剂型主要为口服制剂,其次为注射剂和少量外用/直肠/阴道剂型。修订内容突出了中成药适用的中医证型,强调了含有毒性和化学药成分中成药的使用注意事项,细化了特殊人群用药注意事项;但也存在缺乏量化表述、缺乏系统全面的药物相互作用提示、其他未修订的相关项目也有待完善等问题。建议中成药说明书修订以安全用药为核心,提供明确的不良反应监测数据、清晰具体的用药注意、系统全面的药物相互作用,以促进中成药的安全合理使用。
关键词 中成药;药品说明书;合理用药;修订;分析
ABSTRACT OBJECTIVE: To further standardize and improve the drug instructions of Chinese patent medicine, and to promote its clinical safe and rational use. METHODS: The varieties of Chinese patent medicines with clear content revision issued by the website of the State Drug Administration from January 2010 to June 2020 were inquired. The revised contents, characteristics and deficiencies were summarized and analyzed to put forward the revision suggestions. RESULTS & CONCLUSIONS: Among 107 Chinese patent medicine varieties the instruction content of which were revised clearly, safety items were the focus of revision; 106 types (99.07%) were revised in terms of “contraindications”, 103 types (96.26%) were revised in terms of “precautions”, 102 types (95.33%) were revised in terms of “ADR”, 49 types (45.79%) were revised in terms of “warning words”, etc. The main dosage forms involved in the revision were oral preparations, followed by injections and a small amount of external/rectal/vaginal dosage forms. The revised content highlighted the TCM syndrome types applicable to Chinese patent medicine, emphasized the precautions for the use of Chinese patent medicine containing toxic and chemical components and detailed the medication precautions for special groups. However, there were still some problems, such as lack of quantitative expression, lack of systematic and comprehensive drug interaction tips, and other related items that had not been revised needed to be improved. In order to promote the safe and rational use of Chinese patent medicine, it is suggested that the revision of Chinese patent medicine instructions should focus on safe drug use, provide clear ADR monitoring data, clear and specific medication attention and systematic and comprehensive drug interaction.
KEYWORDS Chinese patent medicine; Drug instructions; Rational drug use; Revision; Analysis
中醫药历史悠久,具有独特的理论和技术方法,在多种急慢性疾病的治疗中发挥着重要的作用[1-2]。随着中药制剂技术的发展,近年来,中成药因疗效好、携带方便深受广大患者的欢迎。以复方丹参滴丸为代表的部分中成药已向美国FDA提出上市申请,并开始进行相关临床试验,标志着我国中成药的世界影响力正在逐步扩大[3]。随着中成药使用量的增加和药品不良反应监测工作的开展,其药品不良反应越来越受到人们的关注[4]。药品说明书是正确认识和使用药品的依据,具有重要的临床意义和法律效力。药品说明书内容的完整性、详尽性、规范性与用药安全密切相关。但有调研发现,我国中成药的药品说明书普遍存在信息不完善或项目缺失的情况,可能给临床用药安全带来一定的隐患[5-6]。我国从2006年起颁布了《药品说明书和标签管理规定》《关于印发中药、天然药物处方药说明书格式内容书写要求及撰写指导原则的通知》《中成药非处方药说明书规范细则》等一系列文件[7-9],并要求中成药生产企业应依据国家药监部门的药品不良反应监测情况和上市后安全性再评价结果及时修订药品说明书,旨在进一步规范管理中成药药品说明书[10-12]。为了解我国中成药药品说明书修订情况,本研究对2010年1月-2020年6月国家药品监督管理局发布的中成药药品说明书修订信息进行统计,并分析其修订内容的特点,以期为进一步规范和完善中成药药品说明书、促进中成药临床安全合理使用提供依据。
1 资料与方法
1.1 资料来源
收集国家药品监督管理局网站2010年1月-2020年6月发布的中成药药品说明书修订信息。为确保统计资料的严谨性和准确性,本研究剔除了提供药品说明书修订范本但无法获知其具体修订内容的中成药品种,仅纳入明确说明其修订内容的中成药品种进行统计分析。
1.2 数据处理
采用Excel 2010软件对纳入的中成药药品说明书修订文件进行信息提取和统计分析,统计项目包括中成药品种、修订时间、修订项目和修订内容。
2 结果
2.1 中成药药品说明书修订基本情况
2010年1月-2020年6月,经国家药品监督管理局批准修订药品说明书内容的中成药品种共计107个,其中包含41个以某类(如雷公藤中成药制剂)或含有某种成分的不同剂型的药品(如鼻炎宁胶囊/颗粒/冲剂)等;为方便表述,某类或含有某种相同成分的不同剂型的药品修订内容相同的按1个品种计算,修订内容不同的则分别统计(具体以国家药品监督管理局网站为准)。涉及药品剂型以口服制剂为主(74个,占69.16%),其次为注射剂(29个,占27.10%)和少量外用/直肠/阴道给药制剂(4个,占3.74%)。其中,血栓通注射剂和血塞通注射剂在10年间各修订了2次。另有胃痛宁片、化痔栓、消栓通络制剂、精乌胶囊、仙灵骨葆口服制剂、养血生发胶囊、首乌丸、首乌片、首乌延寿片、首乌延寿颗粒、白蚀丸等品种在修订说明书的同时由非处方药转为处方药管理。
2.2 修订项目情况分析
107个中成药品种药品说明书修订项目统计见表1(表中,“*”为处方药;“√”表示对此项进行了修订)。由表1可知,我国中成药药品说明书修订项目主要为药品安全性项目。其中,106个品种(占99.07%)修订了“禁忌”项,103个品种(占96.26%)修订了“注意事项”项,102个品种(占95.33%)修订了“不良反应”项;对于药品说明书中的一般项目,如“功能主治”“规格”项,仅有个别品种进行了修订。
2.2.1 “禁忌”项修订情况 “禁忌”项是药品安全使用的重要提示,内容一般涉及特殊人群用药禁忌、中医证候禁忌、饮食禁忌、给药途径禁忌等。由表1可知,共有106个中成药品种对其药品说明书中的“禁忌”项进行了修订,其具体的修订情况统计见表2。由表2可见,106个修订“禁忌”项的中成药品种均对特殊人群用药禁忌进行了修订(106个品种,占100%),另有少数品种对其中医证候禁忌(8个品种,占7.55%)、饮食和给药途径禁忌(1个品种,占0.94%)进行了修订。
新生儿、婴幼儿、儿童、孕妇、哺乳期妇女禁用;对药品及所含成分有严重药品不良反应史者禁用;对药物及所含成份过敏者禁用;出血及有此倾向患者、脑出血急性期患者、肝肾功能不全患者禁用;驾驶员、高空作业者、机械操作者工作期间禁用等 中医證候 8 7.55 脾胃虚寒症见腹痛、喜暖、泄泻者禁用等 饮食 1 0.94 禁止同时与酒服用 给药途径 1 0.94 禁止儿童肌内注射 ]
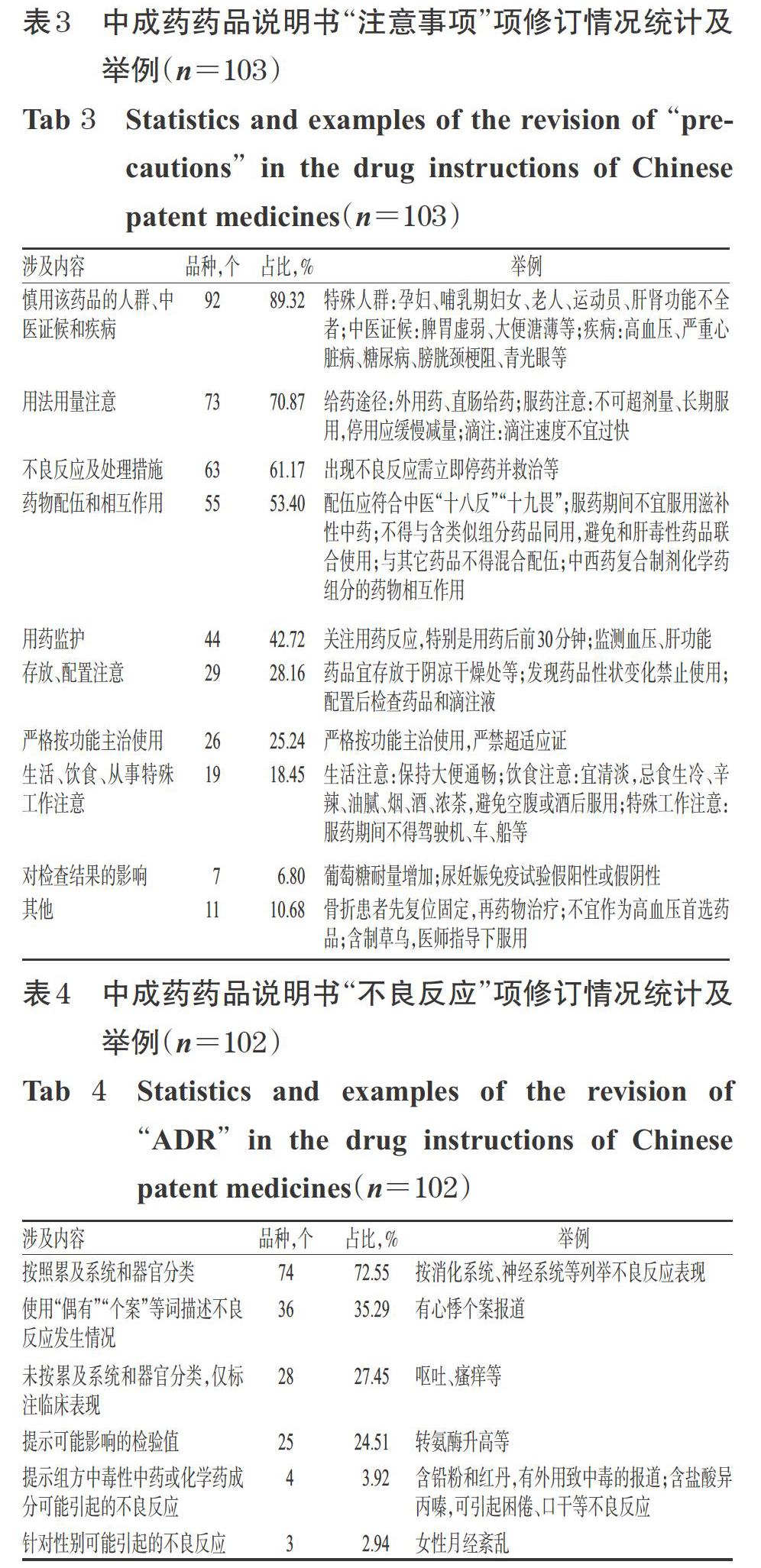
2.2.2 “注意事项”项修订情况 “注意事项”项的修订内容一般包括慎用该药品的人群/中医证候/疾病、用法用量注意、不良反应及处理措施、药物配伍和相互作用、用药监护等。由表1可知,共有103个中成药品种对其药品说明书中的“注意事项”项进行了修订,其具体的修订情况统计见表3。由表3可见,“注意事项”项中修改最多的是“慎用该药品的人群、中医证候和疾病”(92个品种,占89.32%),其次是“用法用量注意”(73个品种,占70.87%)和“不良反应及处理措施”(63个品种,占61.17%)。
2.2.3 “不良反应”项修订情况 共有102个中成药品种对其药品说明书中的“不良反应”项进行了修订,其中有74个品种(占72.55%)将可能出现的不良反应按累及系统和器官分类,36个品种(占35.29%)的药品说明书对不良反应发生频次使用“偶有”“个案”等词进行描述,未按累及系统和器官分类、仅标注临床表现的有28个品种(占27.45%),详见表4。
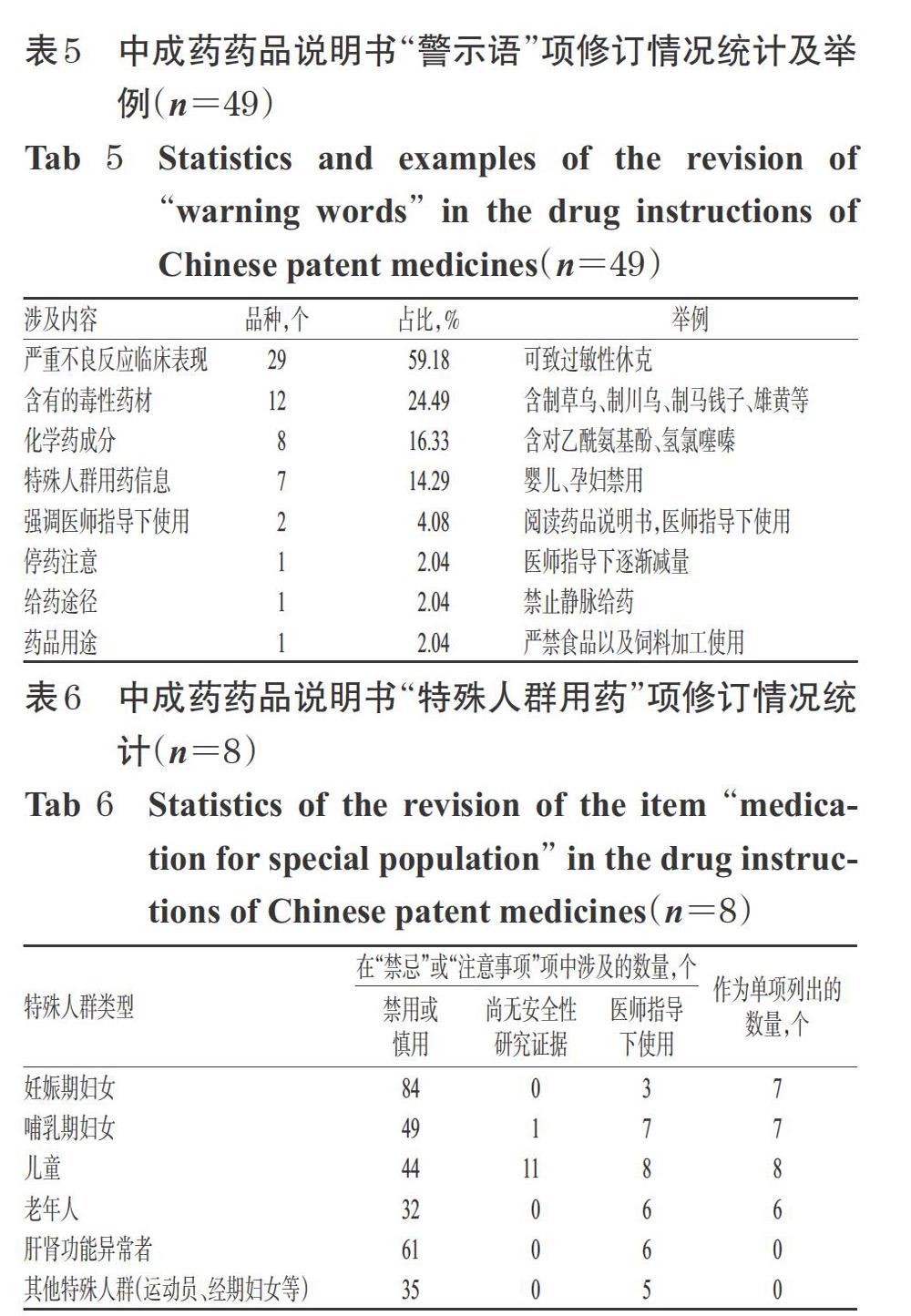
2.2.4 “警示语”项修订情况 共有49个中成药品种对其药品说明书中的“警示语”项进行了修订,其中29个品种(占59.18%)的“警示语”项表述了该产品的严重不良反应临床表现;12个品种(占24.49%)标注了该药组成中含有的毒性药材,涉及较多的毒性药材有制草乌、制川乌、制马钱子等;8个品种(占16.33%)标注了该中成药中含有的化学药成分;7个品种(占14.29%)提示了特殊人群用药信息;2个品种(占4.08%)注明了需经医师指导后才可使用;另有各1个品种(各占2.04%)提示了停药注意事项、警示药品用途和给药途径,详见表5。
2.2.5 “特殊人群用药”项修订情况 有8个中成药品种的药品说明书将“特殊人群用药”项作为单项列出。此外,由前文分析可见,另有部分说明书将特殊人群用药信息在“禁忌”“注意事项”中进行了表述,详见表6。
2.2.6 “药物相互作用”项修订情况 有5个中成药品种的药品说明书将“药物相互作用”项作为单项列出。其修订内容包括药物使用应遵循中药的“十八反”“十九畏”原则、含有相同毒性药材的中成药不宜叠加使用、化学药成分可能引起的相互作用等。5个品种修订内容分别为:复方甘草片不宜与强力镇咳药同时服用;化痰平喘片含有南沙参,应避免与藜芦同用,并应注意与盐酸异丙嗪的药物相互作用;伤科接骨片不宜与含有朱砂、马钱子的药品同服;胃痛宁片含有氢氧化铝,服药后1小时内不宜服用其它药品;珍菊降压片与其它药品联合使用时,应注意合并用药与该药的3种化学药成分和2种中药成分的相互作用。另外,由前文分析可见,部分中成药品种药品说明书的“注意事项”项中也涉及了有关“药物相互作用”内容的修订。
2.2.7 “功能主治”项修订情况 有2个中成药品种的药品说明书对“功能主治”项进行了修订,分别为益母颗粒和一扫光药膏。益母颗粒修改为活血调经、行气止痛,用于气滞血瘀痛经、月经不调的治疗;一扫光药膏药品说明书中“不良反应”项提示儿童使用后可能铅中毒,因而在“功能主治”项中删去了“小儿胎毒”的适应证。
2.2.8 “规格”项修订情况 仅有1个中成药品种(治伤风颗粒)的药品说明书对“规格”项进行了修订,修订后此项包括了每袋的克数、相当于饮片的量以及所含化学药的量。
3 讨论
3.1 中成药药品说明书修订的内容特点
3.1.1 突出中成药适用的中医证型 中成药是在中医理论指导下制成的制剂,辩证论治是其合理使用的首要条件。违背中医理论盲目使用不仅无法发挥药效,还可能引发不良反应[13-15]。药品说明书作为反映药品基本信息的法定文书,在合理用药中起重要作用[16]。本研究发现,有2个中成药品种对其药品说明书的“功能主治”项进行了修订,26个品种在“注意事项”项中强调了应严格按适应证使用。修订内容中,部分药品说明书对中成药慎用或禁用的中医证型在“禁忌”“注意事项”项中加以说明,例如生脉注射液在“禁忌”项中标注该产品“禁用于实证及暑热等病热邪尚存者”,牛黄解毒制剂在“注意事项”项中标注该产品“平素脾胃虚弱、大便溏薄者慎用”。部分修订内容还描述了中医证型表现,如蒲地蓝消炎制剂“注意事项”项中标注脾胃虚寒的表现为腹痛、喜暖、泄泻,具有该症状者慎用。可见,药品说明书的修订通过多角度强调中成药适用、慎用、禁用的中医证型和临床适应证,有利于医师选择合适的中成药品种,避免药不对证。
3.1.2 突出强调含有毒性药材或化学药成分中成药的使用注意事项 长期以来人们存在中成药安全无毒的使用误区[17]。由于其成分的特殊性,若含有毒性药材或化学药成分的中成药使用不当,将更易影响用药安全。本研究统计发现,国家药品监督管理局发布的修订信息中要求对含有毒性药材或化学药成分中成药品种的“警示语”或“注意事项”项进行修订,告知使用者中成药中含有该类特殊成分,并向其强调含有毒性药材的中成药不能长期超剂量使用,告知其含有化学药成分的中成药使用人群禁忌以及药物相互作用,以避免由于超量和不合理使用造成中毒或其他不良事件的发生。
3.1.3 细化特殊人群用药事项 特殊人群对药物的吸收和代谢能力与普通人不同,在药物使用中也应区别对待[18-19]。国外对特殊人群用药也有多种管理办法,例如美国FDA依据药品可能对胎儿造成的危害,将妊娠用药划分为A、B、C、D、E等5个等级[20];法国依据药品可能对驾驶造成的影响将其划分为4个等级[21]。我国中成药药品说明书以“禁用”“忌用”“慎用”区分使用等级。本研究统计发现,部分药品说明书修订内容对特殊人群用药注意事项进行了细化,例如保妇康栓/凝胶/泡沫剂依据妊娠的不同时期(以12周为界限)进行区分,12周以内的禁止使用,13周以后则可在医师指导下使用。相关研究显示,我国儿童药品不良反应发生率是成人的2倍,新生儿更高达成人的4倍[22]。本研究统计发现,部分儿童用药的药品说明书以新生儿、嬰儿、幼儿等不同时期或不同年龄段来区分药品是否适宜使用并标注对应的使用剂量,这更利于合理用药。此外,部分中成药的药品说明书对女性月经期、育龄期,以及有特殊工作需求的人群(如运动员、驾驶员等)进行了用药警示,如月经期患者慎用脑心通制剂、育龄期需要孕育者禁用雷公藤中成药制剂、运动员慎用小金丸、驾驶员在工作期间禁用化痰平喘片等。特殊人群用药信息的细化将更利于医师选择安全合适的药品,避免不良反应的发生。
3.2 中成药药品说明书修订的不足之处
3.2.1 缺乏量化表述 例如,在“不良反应”项的修订中,不少品种的药品说明书使用了“偶有”“个案”等表述不良反应发生率。据报道,美国FDA要求各药品生产企业将临床试验的不良反应发生率、不良反应严重程度、上市后不良反应监测数据在其药品说明书中进行量化说明[23]。量化数据的标注将更利于医师和患者客观了解药品使用的风险高低,减少患者的心理恐惧。我国部分化学药药品说明书也有此类数据,但中成药药品说明书普遍较为缺乏。此外,“注意事项”项中还有“不宜久用”“定期随诊并检查”等模糊表述,使患者难以获得明确的用药指导,容易引发药品不良反应。
3.2.2 缺乏系统全面的药物相互作用提示 随着人口老龄化的加剧和慢性病患者的增多,药品不合理联用已成为我国患者用药的重要问题[24]。由于药品联用而产生相互作用进而引发不良反应的报道逐渐增多[25-27]。美国FDA于2012年公布了药物相互作用研究方法,并要求药品说明书应阐述有临床意义的药物相互作用、联用药品剂量调整的必要性、预防措施和发生相关事件后的解决方法[28]。本次统计发现,中成药药品说明书中关于“药物相互作用”的修订内容较简单,主要涉及使用中不应违背中药配伍原则、不宜与含相似组成的药品同用、中西药复合制剂中化学药成分的药物相互作用等。但由于中成药成分复杂,物质基础多数不够明确,其药物相互作用研究一直是个难点。现有的研究大多针对中药单一成分,但仅以其中1个或几个成分难以全面反映整体情况[29]。此外,中成药之间以及中成药与化学药联用现象普遍,而药品说明书中“药物相互作用”项多表述为“尚无相关信息”,给患者造成中成药没有药物相互作用的误解,存在较大的安全隐患[13]。因此,进一步完善中成药药品说明书“药物相互作用”项将有助于保障患者的用药安全。
3.2.3 其他未修订的相关项目也有待完善 本研究统计发现,未有中成药品种修订“成分”项。日本汉方药物制剂在“成分”项中要求除了列出处方中含有的药材,还应标注药材折合成的每日药材量和提取物量[30]。而国家食品药品监督管理局《关于印发中药、天然药物处方药说明书格式内容书写要求及撰写指导原则的通知》中对“成分”项仅要求列出含有的药味、有效部位或有效成分等;注射剂类中成药应列出处方中所有辅料信息,可能引起严重不良反应的辅料种类也应列出[8]。有研究表明,我国中成药药品说明书“成分”项还缺少每片/丸相当于原药材的量[31]。当含有相同中药或成分的中成药联用时,就会造成剂量叠加,超出使用限量,甚至引发药品不良反应。另外,药品辅料的安全性也不容忽视,有部分患者会对辅料过敏,建议应将药品说明书中的辅料信息标注完整[32]。
另外,本次统计中也未见有品种修订其药品说明书中的“用法用量”项。大部分中成药药品说明书关于该项的表述均缺少每日使用极量(最大耐受剂量)、服用时间、与其它药品联用的用药间隔等相关提示。而美国FDA对该国所有药品说明书均要求标注药品每日使用极量,这对于预防超剂量使用、促进用药安全具有重要意义[23],我国也应引起足够的重视。此外,现有中成药药品说明书中“药理毒理”“药代动力学”项缺失的也较多,本次也未发现有品种对上述项目进行修订。
4 结语
药品说明书是安全用药和开展药学服务的重要依据,是临床前研究和临床研究结果的综合反映[33]。中成药药品说明书修订反映了我国对中成药监管的持续加强和日趋严格,标志着中医药正向着标准化、规范化和国际化发展,这既利于临床安全合理用藥,又利于中医药的传承和发展[34]。由本文分析可见,我国中成药药品说明书普遍存在缺项和表述不清的情况,修订工作仍任重道远。建议中成药药品说明书的修订可借鉴国外特别是亚洲国家传统植物药药品说明书的特点,结合中医药特色,分主次、分项目逐步实施[35]。例如,可将药品说明书项目按照基本信息、指导信息、安全信息分类。以安全用药作为首要原则,提供明确的药品不良反应发生率数据、清晰的用药注意事项、系统的中成药药物相互作用以及联合用药后的剂量调整建议;逐步完善药品说明书的一般信息,例如中成药相当于原药材的量、辅料的种类、每日使用极量;以及利用漫画或图标形式标注用药警示等等[21],最终提供准确、全面、清晰、通俗易懂的用药信息,保障患者用药安全。
参考文献
[ 1 ] 卢伟,潘梦,方亦可,等.中药治疗急性肝损伤作用机制研究进展[J].中南药学,2019,17(9):1504-1507.
[ 2 ] 姚璠,王莹,冷向阳,等.中医药防治血脂异常及动脉粥样硬化的进展研究[J].吉林中医药,2020,40(10):1282- 1285.
[ 3 ] 刘雪竹,杨毅,田侃,等.复方丹参滴丸完成 FDA Ⅲ期临床认证对中药国际化的启示[J].时珍国医国药,2017,28(9):2298-2230.
[ 4 ] 王焱,范丽萍,宋菊,等. 74例中药注射剂不良反应报告分析与探讨[J].中国中药杂志,2018,43(21):4347-4351.
[ 5 ] 王新芳,魏琴,罗永皎,等.中成药处方药、非处方药说明书规范性分析[J].中成药,2019,40(8):2022-2024.
[ 6 ] 吕小琴,马敏康,朱勇,等.中成药说明书安全性信息及不良反应监测数据分析[J].中国现代应用药学,2019,36(4):493-498.
[ 7 ] 国家食品药品监督管理局.药品说明书和标签管理规定:局令第24号[Z].2006-03-15.
[ 8 ] 国家食品药品监督管理局.关于印发中药、天然药物处方药说明书格式内容书写要求及撰写指导原则的通知:国食药监注〔2006〕283号[Z]. 2006-03-15.
[ 9 ] 国家食品药品监督管理局.中成药非处方药说明书规范细则:国食药监注〔2006〕540号[Z]. 2006-03-15.
[10] 孙世光.中药注射剂临床使用合理性与安全性再评价体系构建[J].中华中医药杂志,2017,32(4):1411-1414.
[11] 王军,邓庆华,邓建华.中药注射剂不良反应/不良事件及说明书修订的现状分析[J].中国药业,2016,25(20):22-24.
[12] 吴曼,马建丽. CFDA通报中药制剂不良反应及修订说明书的现状分析[J].中国药房,2015,26(5):648-650.
[13] 张冰,林志健,张晓朦,等.国产中成药说明书现状调研与修订完善建议[J].药物流行病学杂志,2017,26(8):561- 564.
[14] 李冬,宋慧,董利军,等.中成药合理使用的对策探讨[J]. 广州医科大学学报,2016,44(6):56-58.
[15] 仲向军,何杰,贡联兵,等.高脂血症中成药的合理应用[J].人民军医,2018,61(9):844-845.
[16] 国家食品药品监督管理局.药品说明书和标签管理规定[S]. 2006-03-15.
[17] 刘学龙,翟华强.北京友谊医院门诊患者对含雄黄中成药认知度调研与分析[J].北京中医药,2019,38(8):831-834.
[18] 张厚莉,许莉莉,谢彦军,等. 201例儿童药物性肝损伤不良反应/事件报告分析[J].中国药物警戒,2020,17(10):715-719.
[19] 王晶,于立丽,李文. 2017年南京市386例中药注射剂ADR报告分析[J].药物评价研究,2020,43(1):133-139.
[20] 霍记平,曲圣慧,赵志刚. 2014年美国FDA颁布的妊娠和哺乳期用药信息标签最终规则介绍[J].药品评价,2015,12(6):13-19.
[21] 洪兰,朱俊怡.国内外药品说明书和标签管理中有关警示语的比较研究[J].中国药房,2014,25(33):3161-3164.
[22] 林志健,周伟龙,张冰,等.中成药说明书中儿童用药信息的修订完善思考[J].药物流行病学杂志,2018,27(4):244-248.
[23] 王鸿蕴,王煊,朱文涛.中成药说明书与美国药品说明书对比研究[J].中国药物评价,2013,30(2):73-76.
[24] 金锐,王宇光,薛春苗,等.中成药处方点评的标准与尺度探索:七:中西药相互作用[J].中国医院药学杂志,2015,35(19):1713-1718.
[25] 李哲,罗晓,史丽敏,等.中成药与西药联合使用的现状、问题及建议[J].临床药物治疗杂志,2015,13(4):65-69.
[26] CHARLES A,MEMELA M,HELMUTH R,et al. Critical evaluation of causality assessment of herb-drug interactions in patients[J].Br J Clin Pharmacol,2018,84(4):679-693.
[27] YAN TC,XIANG LA,XI MZ,et al. Interaction between warfarin and Chinese herbal medicines[J]. Singapore Med J,2015,56(1):11-18.
[28] 蕭惠来. FDA 对药物相互作用研究及其说明书该项的建议[J].药物评价研究,2013,36(1):1-4.
[29] 姚新生.中药复方药物现代化、规范化、国际化战略的思考[J].南京中医药大学学报,2019,35(5):481-483.
[30] 刘辰,高慧,闫国跃,等.日本汉方药与我国中成药用药指导比较分析[J].中草药,2018,49(17):4178-4183.
[31] 韩炜,周跃华.关于中成药说明书成份项表述的思考[J].中国新药杂志,2016,25(14):1577-1580.
[32] 孙怡园,魏芬芳,杨悦.基于网络拓扑的药品辅料风险评估模型研究[J].中国药物警戒,2017,14(1):49-53.
[33] 周歧骥,吴美怡,刘承统.中药注射剂药品说明书标注不规范所致不合理用药调查分析[J].中国药业,2020,29(20):26-29.
[34] 田硕,郭晖,苗明三.中成药说明书完善的思考及实践[J].中华中医药杂志,2018,33(6):2225-2229.
[35] 薛斐然,刘炳林,周贝.日本汉方制剂说明书与我国中成药说明书对比浅析[J].中国现代中药,2017,19(6):877-879.
(收稿日期:2020-06-30 修回日期:2021-01-21)
(编辑:孙 冰)

