生长抑素受体2在小细胞肺癌中的表达及其与患者生物学特征的关系
徐文玲,李彦楠,朱晓莉
(东南大学 医学院,江苏 南京 210009)
小细胞肺癌(small cell lung cancer,SCLC)在肺癌中占15%[1- 4],但其恶性程度高,较早发生转移,易耐药复发。SCLC含有神经内分泌颗粒,又被划分为神经内分泌肿瘤(neuroendocrine tumor,NET)。生长抑素(somatostatin, SST)作为神经肽类激素在人体内广泛分布,主要存在于神经系统和内分泌腺,具有广泛的生物学效应。近年来的研究主要集中于SST及其类似物(somatostatin analog, SSTA)的抗肿瘤作用。其抗肿瘤作用不仅表现在能抑制绝大多数神经内分泌肿瘤,而且对普通实体瘤也同样具有抑制作用,这对肿瘤的诊断和治疗有着重要作用。SST的生物学活性是由靶细胞上的生长抑素受体(somatostatin receptor,SSTR)介导发挥的,即通过与细胞膜上相应的特异性受体相结合,发挥多种生物学功能[5- 7]。80%~90%的肺NET都表达SSTR,主要是SSTR2,分化好的肺NET比未分化的肺NET SSTR2表达密度高[8- 9]。目前针对SSTR的放射性核素标记的生长抑素类似物标靶放射治疗肿瘤成为研究的热点[10- 12],但关于SSTR2的表达高低与SCLC患者的临床病理特征,包括性别、年龄、既往吸烟史、TNM分期之间的相关性研究甚少。为此,本研究通过体外检测SSTR2在SCLC细胞及组织中的表达情况,并对SCLC患者的生物学特征(年龄、性别、吸烟、TNM分期、预后)进行统计学分析,判定SSTR2的表达与患者生物学特征是否具有相关性,评估能否将SSTR2作为诊断、治疗的靶点,从而拓宽SCLC的治疗途径。
1 材料与方法
1.1 材料
收集2008年5月至2015年9月入住东南大学附属中大医院,病理明确诊断为SCLC的初诊、未治,且有足够病理标本,根据美国国立综合癌症网络(NCCN)指南美国东部肿瘤协作组(ECOG)评分≤2,至少完成2个周期化疗,并有完整临床资料的患者。排除标准:有严重心肺疾病、肝肾功能障碍者不能耐受化疗的患者;合并内分泌系统疾病及其他部位恶性肿瘤者;PS评分>2分的患者;病理组织不充足、不能行免疫组化检测的患者。最终收集到经病理证实的SCLC石蜡标本46例。以电话方式随访患者,随访截至2016年3月。所有入选病例入组前均未接受放化疗、免疫或生物治疗等任何抗肿瘤治疗。所有标本经常规10%福尔马林固定, 石蜡包埋。其中男38例,女8例;年龄42~83岁;吸烟35例,不吸烟11例;按2009年UICC(国际抗癌联盟)修订的肺癌TNM病理分期标准1B期1例,2A期1例,2B期1例,3A期2例,3B期12例,4期29例。另取非肿瘤肺组织10例做对照分析。其中男8例,女2例;年龄45~80岁;气管镜下正常组织3例,炎性组织7例。
人小细胞肺癌细胞株NCI- H446购买自武汉博士德生物工程有限公司;上皮细胞HEK- 293由中大医院肿瘤科实验室提供。试验用兔抗人单克隆抗体SSTR2购自南京泉晖医疗器械公司,工作液浓度为1∶100。通用型SP免疫组化试剂盒、DAB试剂盒购自北京中杉金桥生物技术有限公司。
1.2 方法
免疫组织化学染色及结果判定参考文献[13],SSTR2以细胞膜出现棕色颗粒为阳性。先在低倍镜下观察大体着色情况,再在高倍镜下(×200)下随机计数5个视野,每个视野计数200个肿瘤细胞。按阳性细胞数占肿瘤细胞的比例进行分级:阴性(-)为无棕色染色或染色阳性肿瘤细胞数<5%;弱阳性(+)为阳性肿瘤细胞数5%~24%;中度阳性(++)为阳性肿瘤细胞数25%~49%;强阳性(+++)为阳性肿瘤细胞数≥50%。为便于统计,将+~+++统归为阳性表达组。
1.3 统计学处理
本试验所有资料经Excel建立数据库,采用SPSS 21.0 统计软件进行分析,Spearman相关分析法进行显著性检验,Kaplan- Meier法进行生存分析。P<0.05为差异有统计学意义。
2 结 果
2.1 SSTR2的表达
SSTR2在SCLC组织中阳性表达率为69.6% (32/46),其中强阳性(图1A)表达率为34.8%(16/46),中度阳性(图1B)表达率为23.9%(11/46),弱阳性(图1C)表达率为10.9%(5/46)。SCLC中SSTR2阴性表达见图1D。SSTR2在非肿瘤肺组织中的阳性表达率为10%(1/10)。SSTR2在非肿瘤肺组织中阴性表达见图2。
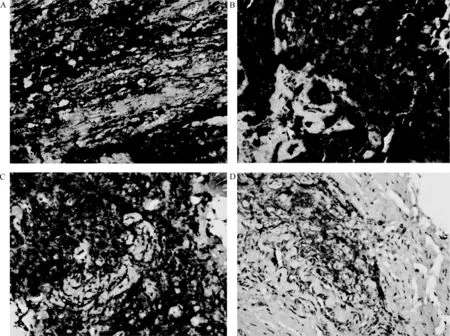
图1 SSTR2在SCLC组织中表达率(×400)
人小细胞肺癌株NCI- H446中,SSTR2呈强阳性表达(+++),呈棕色染色,主要表达于细胞膜(图3A)。上皮细胞HEK- 293中,SSTR2无表达(图3B)。
2.2 SSTR2的表达及其与生物学特性的相关性
2.2.1 SSTR2与患者临床病理特征 根据Spearman相关分析法分析,SSTR2表达与患者年龄、性别、既往吸烟史、TNM分期均无相关性(P>0.05),见表1。
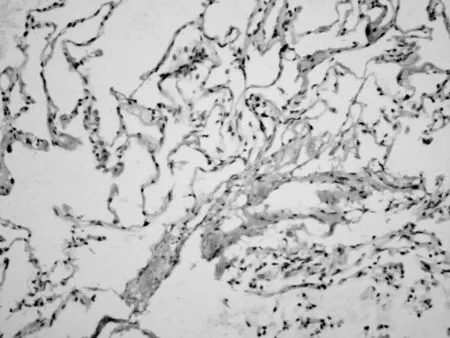
图2 SSTR2在非肿瘤肺组织中阴性表达(×200)
2.2.2 SSTR2的表达与生存期 SSTR2表达阴性者平均生存期为28.4个月,中位生存期为24个月。SSTR2表达阳性者平均生存期为33.9个月,中位生存期为21个月。由生存曲线可看出SSTR2表达阴性组与表达阳性组的曲线差异并不显著(χ2=0.022,P=0.883),说明SCLC中SSTR2的表达与患者的生存期无明显相关。见图4。
3 讨 论
SCLC恶性程度高,转移早,易耐药、复发。SCLC属于神经内分泌源性肿瘤。SSTR2在NET表面高表达,已成为SSTA靶向药物治疗的作用靶点。目前关于SSTR2的表达高低与SCLC患者临床病理特征,包括性别、年龄、既往吸烟史、TNM分期之间的相关性研究甚少。本研究结果显示,SSTR2在SCLC细胞株NCI- H446中存在强阳性表达。Erlanolsson等[14]认为,所有SCLC细胞株中有80%~100%表达SSTR2。Lewin等[10]发现,在SCLC细胞株NCI- H69中SSTR2有大量表达。本研究结果与其基本一致。目前关于SSTR2在肺癌组织中表达的报道有限。王秀问[15]运用免疫组化方式检测了118例NSCLC石蜡标本中SSTR2的阳性表达率,结果发现SSTR2在NSCLC组织的阳性表达率为62.7%,SSTR2主要定位于细胞膜上,少量细胞浆染色。Kaemmerer等[16]收集了34例SCLC患者,运用RT- PCR检测出SSTR2A的阳性表达率为45%。汪静等使用原位杂交技术检测了6例SCLC患者的手术标本中SSTR2的表达情况,结果发现5例患者SSTR2呈阳性。本研究SSTR2在SCLC组织中阳性表达率为69.6%。多个研究中患者组织中SSTR2的表达水平出现差异主要与检测样本量和检测方法有关。目前检测SSTR2表达的方法主要有受体闪烁扫描法、原位杂交法、RT- PCR法和免疫组化法。Righi等[17]认为,免疫组化检测法的敏感性低于受体闪烁扫描法。
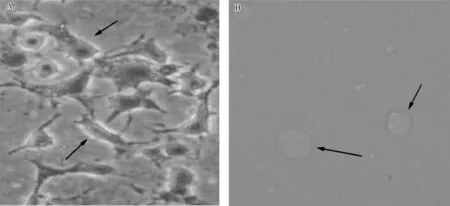
A. NCI- H446中SSTR2表达;B.上皮细胞HEK- 293中SSTR2表达
目前关于SSTR2的表达率高低与恶性肿瘤患者临床病理特征(包括性别、年龄、既往吸烟史、TNM分期)之间的相关性研究不多。王少华等[18]采用免疫组化方法对82例原发性乳腺浸润性导管癌患者检测SSTR的表达,分析这些患者肿瘤组织SSTR、病理分期及分化程度与生存的关系,结果为90%以上乳腺癌细胞表达SSTR;阳性染色表现为棕红色弥漫分布,呈风尘状和颗粒状,间质细胞亦有少量弱阳性或中度阳性表达;原发性乳腺浸润性导管癌组织SSTR的表达与肿瘤病理分化程度及病理分期显著相关,即肿瘤分化越好SSTR阳性表达程度越强,病理分期越晚SSTR阳性表达强度越弱。刘卫兵等[19]对41例大肠癌组织中的SSTR1- 3亚型蛋白阳性表达率进行测定后发现,SSTR2和SSTR3亚型蛋白与肿瘤的发生部位及分化程度均无明显相关。王秀问[15]探讨了NSCLC患者SSTR2的表达与临床病理特征之间的相关性,结果显示SSTR2的表达与患者年龄、性别、既往吸烟史、肿瘤组织类型、肿瘤的大小、肿瘤分化程度及淋巴结转移等均不相关,但与肿瘤TNM分期相关,SSTR2的表达率随分期增高呈下降趋势。然而未见文献报道SSTR2与SCLC患者临床病理特征包括性别、年龄、既往吸烟史、TNM分期之间相关性。本研究SSTR2的表达与肿瘤TNM分期间无明显相关性(P=0.485),可能原因:(1) SCLC的生物学特性与非小细胞肺癌的生物学特性存在明显差异;(2) 样本量较少,存在偏倚。
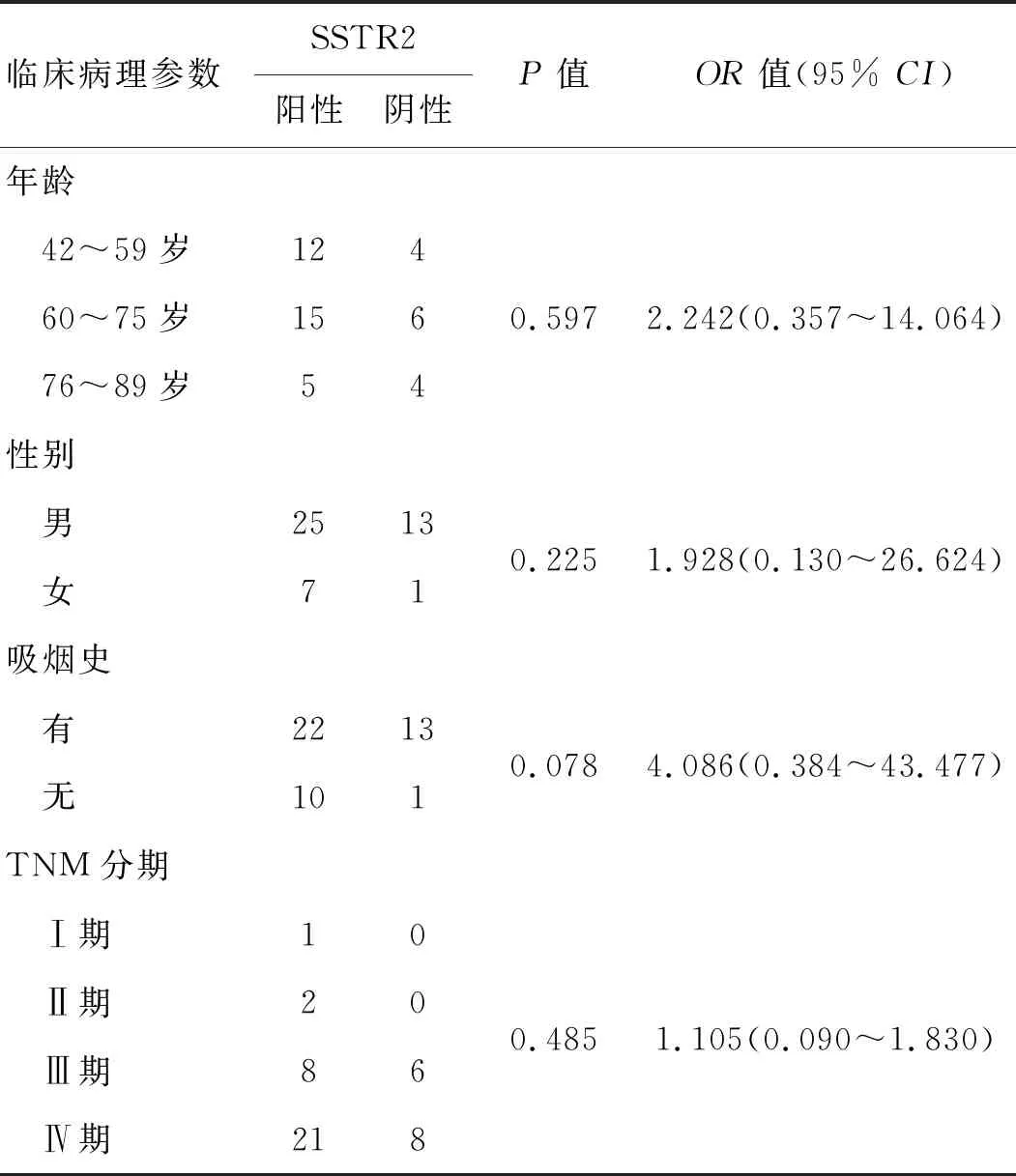
表1 SSTR2与患者临床病理特征关系例
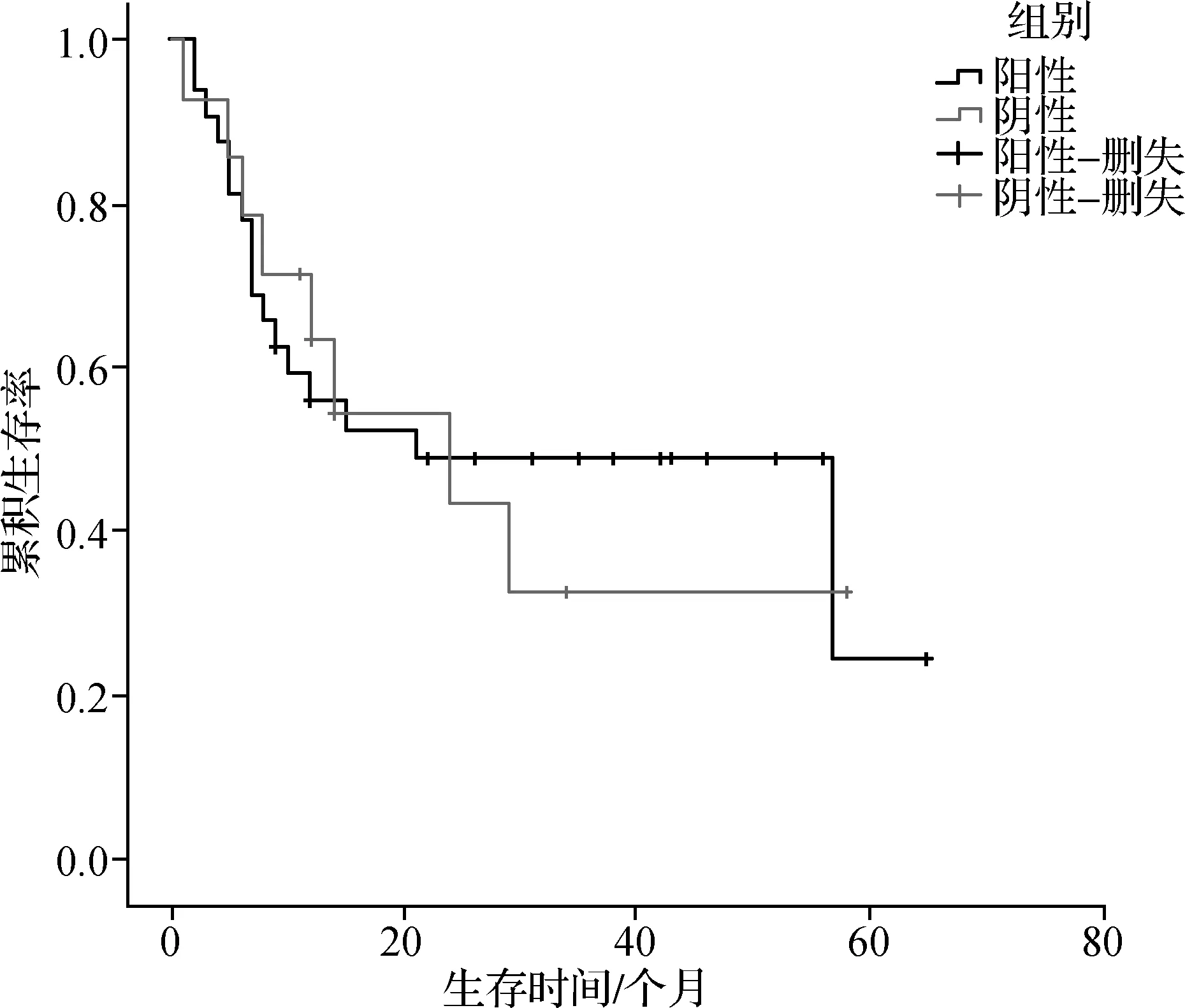
图4 SCLC患者SSTR2表达阳性组与表达阴性组Kaplan- Meier生存曲线
目前关于SSTR2的表达与恶性肿瘤预后的相关性研究甚少。一项对原发性乳腺浸润性导管癌SSTR表达与预后关系研究结果[20]显示:SSTR的表达强度与患者的五年生存率呈显著正相关,即肿瘤组织中SSTR的表达强度越强,患者的5年生存率越高,预后越好,反之,5年生存率越低,预后越差。国外研究者[21]对乳腺癌细胞R3- MCF- 7中SSTR3的表达与肿瘤细胞凋亡机制作了探讨,发现SSTR3的过表达可以上调p27kip1基因表达,使肿瘤细胞生长周期停滞;还能上调PTP- 1C表达,使PARP- 1的表达增加,从而导致肿瘤细胞凋亡。故乳腺癌细胞中SSTR3的表达越高,肿瘤细胞凋亡越快,患者预后越好。而关于SSTR2的表达与肺癌的预后鲜见报道。国内一项[15]对NSCLC中SSTR2的表达与预后之间关系的研究显示:SSTR2表达阴性组生存曲线明显低于阳性组,即SSTR2表达率越高,生存期越长。这可能与SSTR2的高表达与诱导细胞凋亡相关[20],可能的机制是SSTR能调节细胞内信号通路,例如促分裂原活化激酶(mitogen- activatedproteinkinase,MAPK)途径,其参与细胞周期停滞,诱导细胞凋亡[22],激活络氨酸磷酸酶和使激活的生长因子受体磷酸化从而产生有丝分裂信号,起抗细胞增殖作用[23]。目前关于SSTR的表达与SCLC预后的相关性研究甚少。Lapa 等[24]通过21例SCLC患者研究SSTR的表达与预后的关系,得出SSTR的表达与晚期SCLC患者的生存期无关,不能作为预测患者预后的指标。关于SSTR2的表达与SCLC患者预后的研究未见报道。本研究SSTR2表达阳性者平均生存期为33.9个月,中位生存期为21个月;SSTR2表达阴性者平均生存期为28.4个月,中位生存期为24个月。两组生存期差异无统计学意义(P=0.883)。这可能的原因为:(1) 研究样本量较少,且随访患者预后时,部分出现失访,失访率为21.7%(10/46),可能导致结果的偏倚;(2) 患者的后续治疗存在差异。若要得到更准确的结论,须进行多中心随机、双盲、对照研究。
总之,作为NET之一的SCLC,不论在肿瘤组织标本还是肿瘤细胞株中,SSTR2表达率较高,组织中中度阳性以上表达率达58.7%,而在非肿瘤肺组织及上皮对照细胞中几乎不表达。SSTR2可作为SCLC靶向诊断和治疗的稳定靶点。SSTR2在SCLC中的表达与患者年龄、性别、是否吸烟、TNM分期及生存期不相关,其可能不能作为判断SCLC患者预后的指标。

