基于转录组的百香果ARF基因家族的鉴定及表达分析
张小雪, 韦晓霞, 陈发兴
(1.福建农林大学园艺学院,福建 福州 350002;2.福建省农业科学院果树研究所,福建 福州 350013)
生长素是一种重要的植物激素,在植物生长发育过程的各个阶段,如胚胎形成、花果发育、顶端优势、维管伸长、叶片膨胀和衰老、侧根形成以及对逆境胁迫响应等,均发挥着重要调控作用[1-3].生长素应答基因在植物生长发育过程中的表达受到生长素响应因子(auxin response factor, ARF)和Aux/IAA( auxin/indole acetic acid)转录因子的调控[4].近年来,人们对ARF基因的分子结构、表达模式等进行了大量研究,对不同植物ARF基因的功能及调控机制等方面的研究也逐渐深入[5].ARF是一类能够特异性识别并结合生长素响应基因启动子区域的AuxREs (TGTCTC) 或其突变体(TGTCCC、TGTCAC和TGTCGG),进而促进或者抑制靶基因表达的转录因子[6].典型的ARFs蛋白常包含3个保守的结构域,即N端DNA结合结构域(DNA-binding domain, DBD)、C端的二聚体结构域(carboxy-terminal dimerization domain, CDT)和可变的中间结构域(middle region, MR).可变中间区域具有转录激活或抑制作用,激活域富含谷氨酰胺(Q),而抑制域富含脯氨酸(P)、甘氨酸(G)、丝氨酸(S)和亮氨酸(L)[7-8].
拟南芥和其他植物的遗传与分子研究显示,ARF蛋白在控制植物生长发育的调控网络中起着关键作用,其成员的突变会造成不同的植株表型变异.如:AtARF2突变会导致植株晚花、叶片衰老延迟以及种子数量增加[9];AtARF1/AtARF2双突变体与单突变体表型相似,但表型性状都进一步加强[10],表明ARF1与ARF2在功能上具有叠加效应;AtARF6和AtARF8是一对功能冗余的与雌雄蕊生殖能力相关的转录因子,ARF6/ARF8双突变体雄蕊花丝变短,花药延迟开裂,导致植株雌性不育[11];AtARF7/AtARF19双突变会抑制不定根的形成和减少侧根数量,而单体突变对不定根和侧根发育无较大影响,表明二者存在功能上的互补[12].OsARF16参与水稻对磷酸盐饥饿下的应激反应[13];OsARF19通过正调控OsGH3-5和OsBR11控制水稻叶片夹角大小[14].关于ARF在果实成熟过程中的调控机制,现有的研究多集中于番茄[15].番茄中共含有21个ARF家族成员[16],其中SlARF2通过负调控与果实成熟相关的调控因子(RIN、CNR、NOR、TAGL1)从而抑制果实成熟[17];SlARF4通过调控糖代谢从而影响果实早期发育[18];SlARF9调控发育早期果实的细胞分裂[19];SlARF12负调控果实膨大但不参与坐果的启动过程[20];而SlARF10则参与调控果实中叶绿素的形成、淀粉的合成以及糖物质的积累[21].
尽管ARF基因在植物生长发育的多个方面发挥着重要的作用,但这些基因家族在多年生植物中,尤其是西番莲科的多年生植物中的研究仍然相对匮乏.百香果学名西番莲(PassifloraedulisSims),是西番莲科西番莲属的几种植物的统称,主要分布于热带和亚热带气候地区,为当地农民的经济产业和增收产业[22].‘福建3号’(黄果)和‘福建1号’(紫果)是福建省多个地区均有栽培的优质鲜食百香果品种.本研究基于课题组百香果果肉不同发育时期的转录组数据,利用BlastP程序筛选并鉴定出果肉中ARF家族成员,并对其编码蛋白理化性质、亚细胞定位、保守结构域和系统进化进行分析,同时研究了ARF家族成员在果肉不同发育时期的差异表达模式.预期本研究可为今后百香果ARF基因的功能研究奠定一定基础.
1 材料与方法
1.1 材料
本研究所用‘福建3号’(黄果)和‘福建1号’(紫果)果实于2019年采自福建省龙岩市永定区百香果果园.根据Tu et al[23]的标准,将百香果果实分为幼果期(fruitlet)、绿果期(green)、转色期(veraison)、成熟期(maturation).于‘黄果’盛花后的40、55、70和80 d进行取样,于‘紫果’盛花后的30、44、50和60 d进行取样.选择园内12株无病虫害、树势健壮的果树,每株从当年一年生的藤蔓上选取3个形态特征及成熟度相似的果实.采样当天运回实验室,用水果刀将果实去皮留肉,液氮速冻后保存于-80 ℃冰箱中备用.
1.2 方法
1.2.1 百香果ARF家族成员的鉴定 从TAIR数据库(https://www. arabidopsis.org/index. jsp)和Phytozome12基因组数据库(https:// phytozome .jgi .doe. gov/pz /portal.html)分别下载拟南芥和毛果杨的蛋白质序列文件.首先用百香果转录组的蛋白序列文件构建本地Blast数据库,然后以已报道的23条拟南芥ARF蛋白序列为诱饵进行blastp搜索比对.同时,利用HMMER v3.0软件构建ARF的HMM模型,筛选出百香果中含有ARF结构域的蛋白序列(E≤10-5).最后,利用NCBI的CCD数据库(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)检测蛋白结构域,剔除不同时含B3和ARF结构域的蛋白序列.
1.2.2 百香果ARF蛋白的保守结构域及Motif分析 利用在线软件ExPASy(https://web.expasy.org/protparam/)预测百香果ARF蛋白的理化性质,并利用Softberry(http://www.softberry.com/)预测其亚细胞定位.利用NCBI的在线分析工具CDD和MEME 5.1.1鉴定PeARF蛋白的保守结构域和保守基序,并采用TBtools进行图形的可视化.
1.2.3 百香果ARF蛋白的进化分析 利用MUSCLE对百香果、拟南芥和毛果杨中的ARFs氨基酸序列进行多重序列比对,在MEGA X中采用邻接法(NJ)构建系统发育树,Bootstrap method取值1 000、Poission model 和pairwise deletion,其余参数默认,利用Evolview对基本树进行进一步美化.
1.2.4 百香果ARF表达分析 利用本课题组的RNA-seq数据,筛选出两品种在4个发育时期的基因表达数据,基于其FPKM值,利用用TBtools软件对数据采用log法均一化处理并进行热图的绘制.
2 结果与分析
2.1 百香果ARF基因家族鉴定及蛋白特性分析
通过对转录组数据库的本地Blast比对检索和HMMER搜素,得到50个百香果ARF候选基因,经CCD在线数据库对保守结构域筛选以及剔除不同时含B3和ARF结构域的蛋白序列,最终得到13条百香果ARF蛋白序列,分别命名为PeARFl~13(表1).对13个PeARF基因综合分析表明,不同ARF蛋白间的差异较大:编码ARF蛋白的氨基酸长度范围从365 aa(PeARF1)到970 aa(PeARF13),编码区从1 098 bp(PeARF1)到2913 bp(PeARF13),分子质量从39.95 ku(PeARF1)到106.33 ku(PeARF13);等电点范围从5.40(PeARF13)到8.94(PeARF1),69%的成员等电点小于7,属酸性蛋白,在酸性环境下发挥作用.所有PeARF蛋白的不稳定指数均大于43且亲水系数呈负值,表明13个PeARF均为不稳定的亲水蛋白质;亚细胞定位预测结果表明,13个ARF蛋白质均位于细胞核.

表1 百香果ARF家族基因基本信息Table 1 Basic information of ARF family genes in passion fruit
2.2 百香果ARF家族蛋白的进化分析
为了解‘黄果’和‘紫果’ARF蛋白进化情况,采用MEGAX软件构建了百香果(13个)、拟南芥(23个)和毛果杨 (39个)ARFs系统进化树(图1).进化树结果显示,75个ARF成员可被清晰的划分为4个亚家族:ClassⅠ、ClassⅡ、ClassⅢ和ClassⅣ,且每组中均含有上述3个物种的成员.其中ClassⅠ包含5个PeARF(PeARF6、PeARF3、PeARF8、PeARF2、PeARF12),ClassⅡ包含2个PeARFs(PeARF13、PeARF11),ClassⅢ包含2个PeARFs(PeARF7、PeARF4),ClassⅣ包含4个PeARFs(PeARF1、PeARF10、PeARF5、PeARF9).除PeARF3和PeARF11外,其他成员均能在毛果杨中找到同源序列.在ClassⅠ中,AtARF12-15、20-23等8个拟南芥成员单独聚在一个小分支上,在百香果和毛果杨等其他2种果树中均未发现与其高度同源的序列.
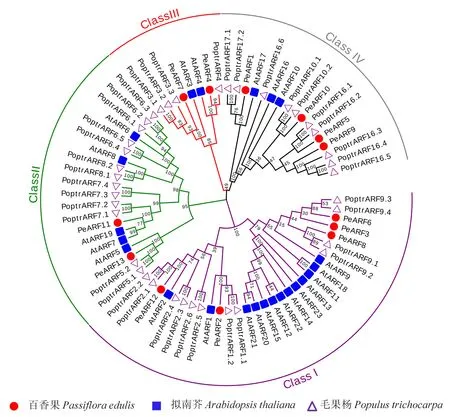
bootstrap测验采用1 000次重复,节点上的数字代表分枝的可信度,不同分组ARF蛋白的分枝颜色不同.来自百香果的ARF蛋白以‘PeARF’表示,来自拟南芥的ARF蛋白以‘AtARF’表示,来自毛果杨的ARF蛋白以‘PoptrARF’表示.图1 百香果与拟南芥、毛果杨ARF基因家族的系统进化树Fig.1 Phylogenetic tree of the ARFs genes from passion fruit, Arabidopis and Populus trichocarpa
2.3 百香果ARF蛋白结构及保守基序分析
通过CDD数据库在线分析每个ARF蛋白的结构域(图2和表1).结果表明,所有百香果ARF蛋白均含有B3和Auxin_resp结构域,而PeARF6、PeARF8、PeARF12和PeARF13序列的C末端还存在AUX_IAA结构域.
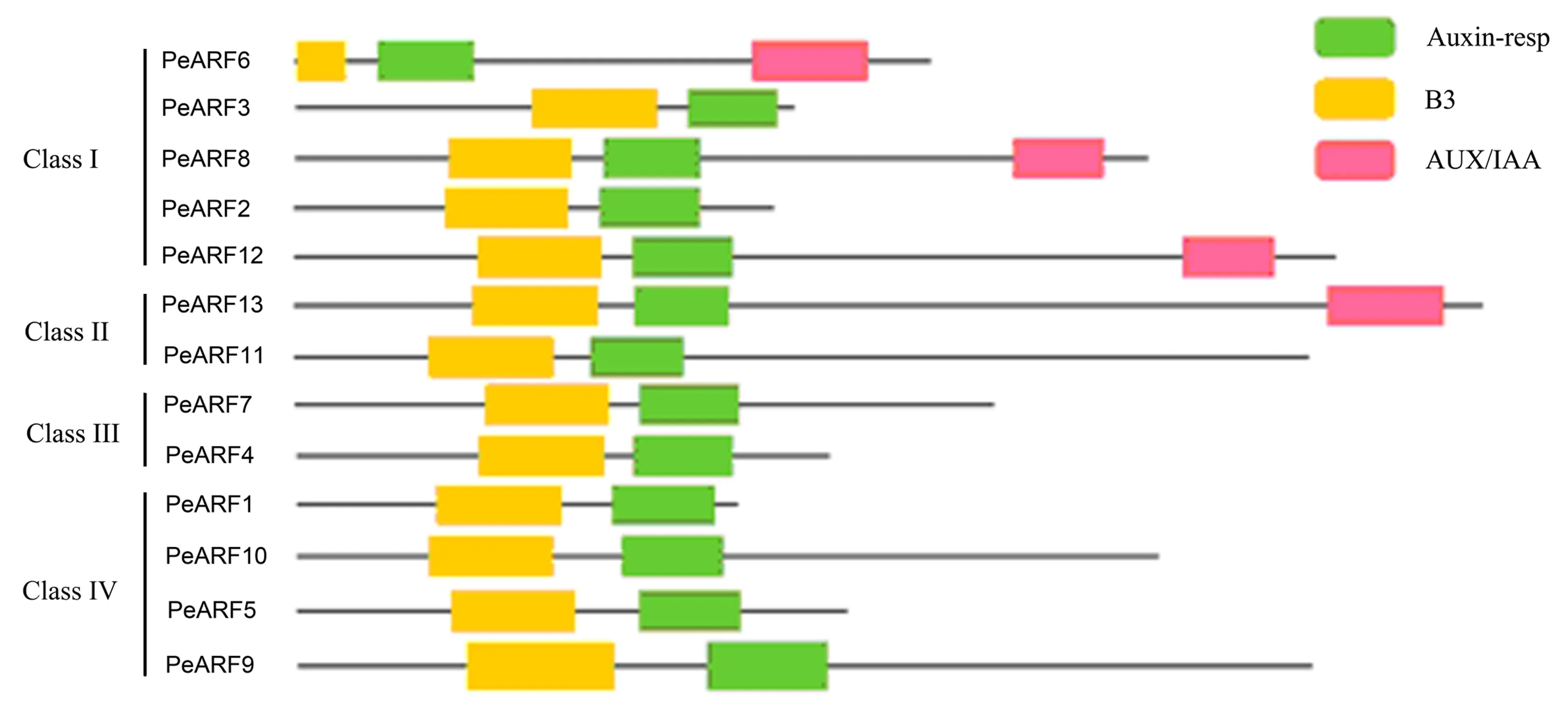
图2 PeARF家族蛋白质保守结构域分析Fig.2 Conserved domains of the PeARF family proteins
利用在线网站MEME在PeARF中鉴定获得15个保守基序(图3).不同PeARF蛋白序列的基序类型和数量都存在一定的差异.基序1、2属于B3结构域,它们与基序3和基序7共同构成DNA结合结构域;基序4、5、6、10和 12 属于Auxin_resp结构域;基序8 和 11属于AUX_IAA结构域;基序9、13、14 和 15为未知结构域.除PeARF6外,所有序列均含有DNA结合结构域的4个基序,且PeARF7包含两个基序3.13个PeARFs均至少含有Auxin_resp结构域5个基序中的3个(PeARF6、PeARF3和PeARF8缺失基序6、12,PeARF2、PeARF12、ClassⅡ和ClassⅢ中所有成员均缺失基序12,ClassⅣ中所有成员均缺失基序5).PeARF6、PeARF8、PeARF9、PeARF10、PeARF12和PeARF13含有AUX_IAA结构域中的所有2个基序,而其它成员无该基序.此外,除PeARF1和PeARF3外,所有序列均含有未知基序9,未知基序13和14仅存在于ClassⅣ成员中(PeARF1不含基序13),而未知基序15只存在于PeARF3、PeARF6 和PeARF8中.
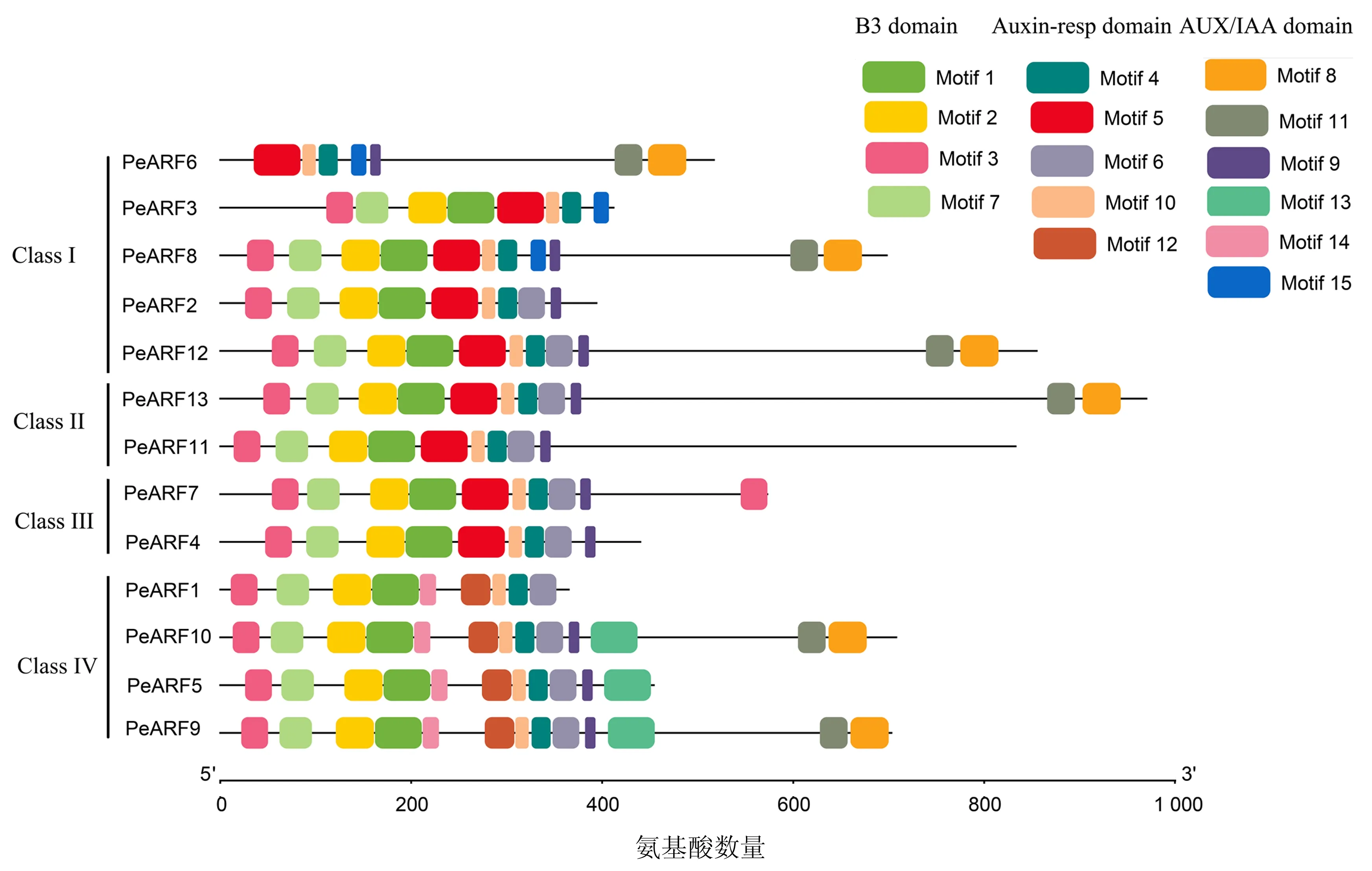
图3 百香果ARF蛋白的保守Motif分析Fig.3 Conserved motifs in passion fruit ARF proteins
为进一步明确PeARFs的蛋白保守结构域,采用MEGAX 比对和Genedoc软件分析,发现B3 DNA结构域在百香果中高度保守,其中41个氨基酸在所有的序列(PeARF6除外)中完全保守,约占结构域(102 aa)平均长度的40.2%;而在具有转录激活或抑制的中心功能区,PeARF11、PeARF13富含谷氨酰胺,PeARF2、PeARF3、PeARF4、PeARF6、PeARF7、PeARF8、PeARF9、PeARF10、PeARF12富含丝氨酸.
2.4 PeARF家族基因的表达分析
从‘黄果’和‘紫果’转录组数据中提取13个PeARF在4个果实发育期的表达数据.由图4可知,多数PeARF基因在果实的不同发育时期均有表达,但PeARF3在两品种的所有发育时期表达极低甚至不表达.随着果实的发育,大部分ARF家族成员的表达量均随着果实的成熟而下降,仅PeARF12在果实的绿果期至成熟期持续增加.如ClassⅠ中的PeARF6、PeARF8;ClassⅢ中的PeARF7以及ClassⅣ中的PeARF1、PeARF10在两品种中的表达量均于幼果期达最高值,至成熟期降至最低;而ClassⅢ中的PeARF4、ClassⅣ中的PeARF5、PeARF9在‘黄果’中的表达量仅于绿果期至转色期略有增加,随后迅速下降,但在‘紫果’中的表达量持续下降.值得注意的是,ClassⅡ中的PeARF11和PeARF13在‘黄果’和‘紫果’的转色期后均呈上升趋势.
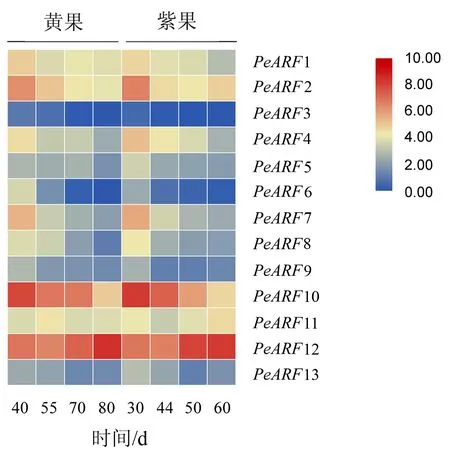
图4 ‘黄果’和‘紫果’果实成熟过程中PeARF家族基因的表达Fig.4 Heatmap representation of the PeARF genes of ‘yellow passion ruit’ and ‘purple passion fruit’ during ripening
3 讨论与结论
生长素和生长素信号是植物发育过程中大多数器官发生的关键信号传导分子,它广泛地参与植物的生理生化进程,包括器官的形态建成、花果发育、激素调节、环境刺激下的应激反应和病原体抗性等[24].ARF是生长素调节的转录因子,在生长素信号传导途径中发挥关键作用.目前,已有多个物种ARF基因家族成员的数量已被鉴定,但不同物种的ARFs数量存在较大差异.如在拟南芥、水稻、玉米、毛果杨、苹果、香蕉、甜橙、葡萄、荔枝和桃等植物中分别鉴定得到23、25 、31、39、29、47、19、19、39和18个ARF成员[25-28],然而,百香果中整个ARF基因家族的系统研究尚未见报道.本研究首次在转录组的水平上从百香果中鉴定出13个ARF基因.
保守结构域的鉴定表明,所有的PeARF蛋白均含有保守的B3、Auxin_resp结构域,而CTD结构域仅存在于PeARF6、PeARF3、PeARF12和PeARF13中.CTD是一个介导蛋白质—蛋白质互作的结构域,它可通过ARF-Aux /IAA或ARF-ARF的同源或异源二聚化来调控生长素响应基因的表达.Shen et al[8]研究显示,在苜蓿的子叶、叶片和茎中,大多数含有CTD结构域的MtARF基因的转录本水平明显的高于其缺失CTD的转录本,暗示CTD蛋白结构域可能影响MtARF基因的表达水平.而在本研究中,PeARF1、PeARF2、PeARF3、PeARF4、PeARF5、PeARF7、PeARF9、PeARF10和PeARF11均不含有CTD结构域,其CTD截断率达69%,明显的高于大豆(15.68%)、拟南芥(17.39%)、油菜(22.58%)、水稻(24%)和番茄(28.57%)[29],推测这些缺少CTD结构域的PeARFs可能以一种不依赖生长素的方式进行生长素响应基因的调控.序列比对分析表明,PeARF11、PeARF13蛋白的中间不保守区域富含谷氨酰胺,且二者均与拟南芥转录激活因子(AtARF5-AtARF8,AtARF19)属于同一个分支 ,推测其可能属于转录激活子;而PeARF2、PeARF3、PeARF4、PeARF6、PeARF7、PeARF8、PeARF9、PeARF10、PeARF12等蛋白的中间不保守区域富含丝氨酸,推测其可能属于转录抑制子.此外,所有富含谷氨酰胺的PeARFs蛋白均属于ClassⅡ,而富含丝氨酸的PeARFs蛋白则存在于ClassⅠ、ClassⅢ和ClassⅣ.因此,通过系统进化也进一步表明,不同的亚家族可能在果实的发育中发挥着不同的作用.
果实发育是细胞分裂,分化和扩增的一个复杂过程,而生长素在此过程中起关键作用.本试验中,研究了PeARFs在‘黄果’和‘紫果’果实4个不同发育阶段的表达模式.结果表明,大部分ARF家族成员的表达水平均随着果实的成熟而下降,仅PeARF11、PeARF12和PeARF13的表达量在果实发育后期有所增加,尤其是PeARF12在果实成熟期的表达水平明显的高于其它基因.如ClassⅠ中的PeARF6、PeARF8;ClassⅢ中的PeARF7以及ClassⅣ中的PeARF1、PeARF10在两品种中的表达量均于幼果期较高,随着果实的发育其表达量逐渐下降,至成熟期降至最低;而ClassⅢ中的PeARF4,ClassⅣ中的PeARF5、PeARF9在‘黄果’中的表达量仅于绿果期和转色期略有增加,随后迅速下降,但在‘紫果’中的表达量持续下降.相似的表达趋势也出现在桃[27]、葡萄[30]、西红柿[31]和西瓜[32]等果树上,其中桃果实中的PpARF11、PpARF13;葡萄果实中的VvARF3、VvARF5 、VvARF15以及西红柿果实中的SlARF1/SlARF2 /SlARF4 /SlARF7/SlARF8 /SlARF11/SlARF14在果实成熟过程中均呈下降趋势,而西瓜果实中的ClARF8、ClARF5、ClARF13在西瓜授粉13 d后其表达量逐渐增加,尤其是ClARF8在果实成熟期时表达量达最高值.这些结果暗示着部分ARF基因在植物的生长发育,尤其是果实的成熟中发挥着重要的调控作用.此外,PeARF3在两品种的所有发育时期表达极低甚至不表达,并不是因特定的发育时期或品种而表现出来,这可能是由于PeARF3具有组织特异性或者在百香果ARF基因的扩张进化中产生了无功能的假基因.拟南芥作为一种模式植物,根据AtARF1/AtARF2的功能推测其同源基因PeARF2/PeARF12可能参与百香果的种子、叶片和花器官的发育[9];PeARF13的功能可能是调控百香果叶片中维管组织的形成以及胚轴的发育[33];PeARF11可能参与了百香果中侧根的形成[12];PeARF4/PeARF7可能与百香果中雌蕊的发育相关[34];PeARF5/PeARF9/PeARF10可能调控着百香果根冠的形成以及侧根的向地性[35];而PeARF1可能参与百香果花粉壁的形成[36].
本研究基于转录组数据从百香果中鉴定出13个ARF基因,并对其编码蛋白的理化性质、保守结构域、保守基序和系统进化进行了详细的生物信息学分析;同时比较了它们在‘黄果’和‘紫果’不同果实成熟阶段的表达差异,为进一步了解百香果ARF基因家族成员的结构与功能的关系、揭示其在果实成熟过程中的作用奠定基础.然而,百香果ARF生长素响应因子的功能验证以及它是如何响应激素信号调控果实的成熟还需要今后进行深入的研究.

